分化型甲状腺癌肿瘤局部免疫细胞亚群与其复发关系
王翔 尹雅楠 孔姿莉 王颜刚
[摘要] 目的 研究分化型甲狀腺癌(DTC)免疫细胞亚群局部浸润相关模式,探讨肿瘤局部免疫细胞亚群与DTC复发的相关性。方法 TCGA数据库下载DTC病人转录本及临床相关数据,应用CIBERSORT软件反卷积算法计算22种免疫细胞在DTC病人癌组织与癌旁组织中所占比例,Kaplan-Meier法绘制生存曲线,Log-rank检验分析DTC病人肿瘤复发与免疫细胞亚群的关系。结果 TCGA数据库中下载509例DTC样本,根据病人无病生存期数据应用CIBERSORT软件以P<0.05为条件筛选出匹配样本184例,其中癌旁组织17例,癌组织167例。Kaplan-Meier生存分析显示,NK细胞高比例DTC病人1年无病生存率为98.7%,5年无病生存率为93.6%;而NK细胞低比例DTC病人1年无病生存率为92.0%,5年无病生存率为65.5%,两组5年无病生存率差异有显著性(χ2=7.591,P<0.05)。结论 DTC免疫细胞亚群与临床结果密切相关,活化的NK细胞比例增加可提高甲状腺癌病人无病生存率,针对NK细胞的免疫疗法可能成为预防DTC复发的选择之一。
[关键词] 甲状腺肿瘤;肿瘤复发,局部;免疫细胞
[中图分类号] R736.1;R73-37 [文献标志码] A [文章编号] 2096-5532(2020)05-0566-05
doi:10.11712/jms.2096-5532.2020.56.084 [开放科学(资源服务)标识码(OSID)]
[ABSTRACT] Objective To investigate the local infiltration pattern of immune cell subsets in differentiated thyroid carcinoma (DTC) and the relationship between DTC recurrence and subsets of tumor-infiltrating immune cells. Methods TCGA database was used to download the transcripts and clinical data of patients with DTC. The deconvolution algorithm in CIBERSORT software was used to calculate the proportion of 22 types of infiltrating immune cells in cancerous tissues and adjacent tissues of DTC patients. The Kaplan-Meier method was adopted to plot survival curves. The Log-rank test was used to analyze the relationship between tumor recurrence and infiltrating immune cell subsets in DTC patients. Results A total of 184 matched samples were screened out of 509 cases of DTC samples in the TCGA dataset using the CIBERSORT software according to the patients disease-free survival data under the condition of P<0.05, including 17 cases of adjacent tissues and 167 cases of cancerous tissues. The Kaplan-Meier survival analysis showed that for DTC patients with high NK cell proportion, the 1 year and 5 year disease-free survival rates were 98.7% and 93.6%, respectively, but for DTC patients with low NK cell proportion, the rates were 92.0% and 65.5%, respectively. There was a significant difference in 5 year disease-free survival rate between the two groups (χ2=7.591,P<0.05). Conclusion The subsets of tumor-infiltrating immune cells in DTC patients are closely related to the clinical outcome. Increased proportion of activated NK cells can significantly reduce DTC recurrence rate. In the future, immunotherapy based on NK cells may become one of the options for preventing the recurrence of DTC.
[KEY WORDS] thyroid neoplasms; neoplasm recurrence, local; immune cells
分化型甲状腺癌(DTC)是最常见的头颈部恶性肿瘤,占甲状腺恶性肿瘤的90%[1]。DTC 病人有良好的预后,10年病死率仅为1.7%;然而其术后复发率达1.4%~35.0%[2-3],复发病人病死率高达48%[4]。目前预测DTC复发的指标较少。肿瘤免疫细胞浸润是指免疫细胞从血液移向肿瘤组织的过程,其在肿瘤的发生发展中发挥着重要作用[5-6]。既往研究表明,肿瘤组织内部免疫细胞亚群的分布与肿瘤生长密切相关,不同肿瘤有着不同的免疫细胞亚群的分布比例[7-9]。近年来研究显示,免疫细胞疗法能够有效延长肿瘤病人的总体存活期[10-11]。而肿瘤免疫细胞亚群分布比例与临床结果高度相关,有可能成为提高DTC病人无病生存期治疗的药物靶点。CIBERSORT(单细胞类型分析方法)是一种从癌症基因表达谱中计算出癌症组织细胞组成的高分辨率分析方法,该方法通过反卷积算法可以预测癌组织中22种免疫细胞占比,其灵敏度≥94%,特异度≥95%,模型评估指标受试者工作特征曲线下面积(AUC)≥0.98[12]。本文研究以肿瘤基因组图谱(TCGA)中DTC转录本与临床数据为基础,应用R软件联合CIBERSORT软件分析DTC病人肿瘤免疫细胞亚群与癌症复发的相关性,为临床预防DTC病人肿瘤复发提供参考。现将结果报告如下。
1 材料与方法
1.1 数据来源与筛选
DTC病人转录本与临床数据来源于公共数据库TCGA(https://portal.gdc.cancer.gov/)截至2019年8月29日的数据,临床数据包括无病生存时间、复发状态、性别、年龄、肿瘤Stage分期、肿瘤T分期、肿瘤N分期、肿瘤M分期。以P<0.05为条件应用CIBERSORT软件筛选样本,将各病人无病生存期临床数据与组织样本相匹配,用于病人无病生存率(DFS)分析。病人无病生存期定义为从接受手术治疗到癌症复发所间隔的时间。
1.2 各样本肿瘤免疫细胞的构成分析
将校正后的转录本数据用CIBERSORT软件(https://cibersort.stanford.edu/)以反卷积法计算,完成由各样本转录本数据到22种免疫细胞表达比例数据的转换,22种免疫细胞分别为:初始B细胞(B cells naive)、记忆性B细胞(B cells memory)、浆细胞(Plasma cells)、CD8+T细胞(T cells CD8)、初始CD4+T细胞(CD4 T cells naive)、活化的CD4记忆性T细胞(T cells CD4 memory activated)、未活化的CD4记忆性T细胞(T cells CD4 memory resting )、滤泡辅助性T细胞(T cells follicular helper)、调节性T细胞(T cells regulatory Tregs)、γδT细胞(T cells gamma delta)、未活化的自然杀伤细胞(NK cells resting)、活化的自然杀伤细胞(NK cells activated)、单核细胞(Monocytes)、M0巨噬细胞(Macrophages M0)、M1巨噬细胞(Macrophages M1)、M2巨噬细胞(Macrophages M2)、未活化的树突状细胞(Dendritic cells resting)、活化的树突状细胞(Dendritic cells activated)、未活化的肥大细胞(Mast cells resting)、活化的肥大细胞(Mast cells activated)、嗜酸性粒细胞(Eosinophils)、中性粒细胞(Neutrophils)。通过R barplot命令对数据绘制柱状图,展示各免疫细胞在各样本中所占的比例;应用R corrplot软件包(版本号0.84)进行DTC肿瘤组织中22种免疫细胞相关性热图的绘制;应用R vioplot软件包(版本号0.3.0)进行小提琴图绘制,展示22种免疫细胞在DTC样本癌与癌旁组织间的表达差异。
1.3 肿瘤免疫细胞浸润与DTC病人肿瘤复发之间相关性分析
从TCGA数据库下载得到DTC病人临床数据,从中筛选出无病生存时间数据和病情复发数据。通过R merge命令将病人临床数据与22种免疫细胞表达数据合并,剔除癌旁组织样本数据后,绘制生存曲线并进行病人DFS的比较。
1.4 统计学方法
数据应用R软件(版本号3.6.0)与Bioconductor(http://www.bioconductor.org)软件包进行统计分析。转录本数据应用R limma軟件包(版本号3.38.3)、voom算法进行处理前矫正。若缺少无病生存期数据则将该样本从总体剔除。应用R survival软件包(版本号2.44.1.1)进行Kaplan-Meier生存曲线绘制,Log-rank检验进行生存率的比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 数据构成与筛选情况
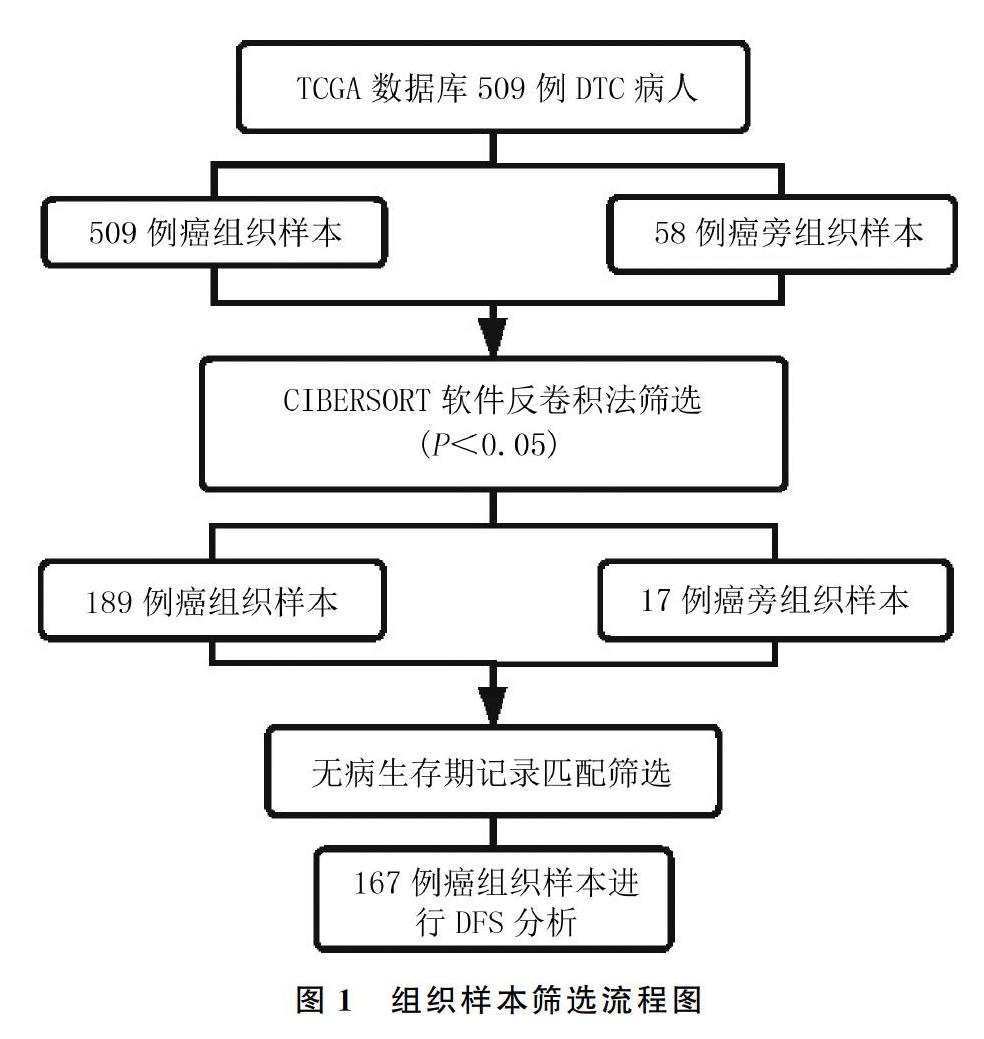
从TCGA数据库下载得到509例DTC癌组织样本与58例癌旁组织样本转录本及临床数据,通过CIBERSORT软件筛选得到206例样本,其中189例DTC癌组织样本,17例癌旁组织样本。然后通过各病人无病生存期临床数据与组织样本相匹配,筛选出167例癌组织样本。筛选流程见图1。
2.2 DTC病人肿瘤免疫细胞浸润分布情况
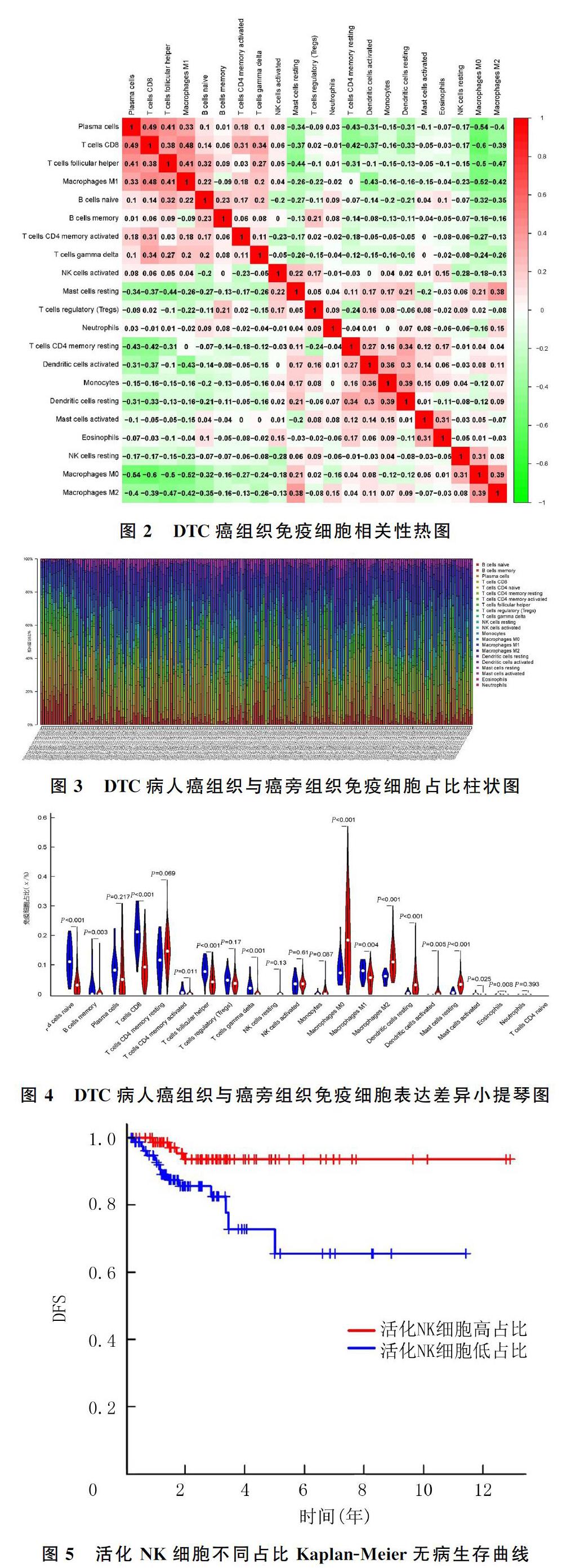
对189例DTC癌组织与17例癌旁组织样本中22种免疫细胞分布数据分别进行细胞相关性热图、柱状图与小提琴图的绘制。细胞相关性热图显示,CD8+T细胞与浆细胞(r=0.49,P<0.05)、M1巨噬细胞(r=0.48,P<0.05)呈正相关,M0巨噬细胞与CD8+T细胞(r=-0.60,P<0.05)、浆细胞(r=-0.54,P<0.05)、M1巨噬细胞(r=-0.52,P<0.05)呈负相关。见图2。柱状图可观察到各样本中免疫细胞所占比例,DTC癌组织中M0巨噬细胞占比最高,为(20.61±13.10)%,而在癌旁组织中仅占(8.60±4.90)%;CD8+T细胞在癌旁组织中占比最高,为(20.78±6.50)%,而在DTC癌组织中占比仅为(10.51±6.80)%。见图3。小提琴图可显示癌组织与癌旁组织中免疫细胞比例差异的变化,癌旁组织M0巨噬细胞占比8.60%,而在癌组织中占比为20.61%;癌旁组织M2巨噬细胞占比5.75%,而在癌组织中占比11.75%;未活化的树突状细胞在癌旁组织占比0.52%,而在癌组织中占比4.95%;未活化的肥大细胞在癌旁组织占比0.76%,而在癌组织中占比3.70%。以上免疫细胞亚群在DTC癌组织样本中呈高表达。CD8+T细胞在癌旁组织中占比20.78%,在癌组织中占比10.51%;初始B细胞在癌旁组织占比11.57%,在癌组织中占比4.10%;滤泡辅助性T细胞在癌旁组织占比8.42%,在癌组织中占比4.79%;γδT细胞在癌旁组织占比2.16%,在癌组织中占比0.42%。以上免疫细胞亚群在DTC癌组织样本中低表达。见图4。
2.3 肿瘤免疫细胞浸潤与DTC病人肿瘤复发之间相关性
将筛选得到167例DTC癌组织样本免疫细胞占比与其临床复发情况相匹配的数据,根据中位值分为免疫细胞高占比组与低占比组,绘制Kaplan-Meier生存曲线。见图5。Log-rank检验结果显示,NK细胞高占比DTC病人1年DFS为98.7%,5年DFS为93.6%;而NK细胞低占比DTC病人1年DFS为92.0%,5年DFS为65.5%,NK细胞高占比组与低占比组5年DFS相比较,差异有统计学意义(χ2=7.591,P<0.05)。而其他免疫细胞占比与肿瘤复发均无相关性(P>0.05)。
3 讨 论
免疫细胞浸润在肿瘤与肿瘤之间差异很大,并且随着时间的推移不断变化[13]。本研究应用R分析与CIBERSORT对TCGA数据库DTC病人转录本与临床资料数据进行分析,得出了以下结论:①CD8+T细胞与浆细胞、M1巨噬细胞之间可能存在共同正向效应;②DTC癌组织样本中肿瘤相关巨噬细胞、未活化的树突状细胞较癌旁组织显著增加,而初始B细胞、CD8+T细胞、滤泡辅助性T细胞、γδT细胞等显著下调,可能与肿瘤的发生发展存在紧密联系;③NK细胞与DTC病人的复发有显著相关性,活化的NK细胞可提高DTC病人DFS。
对甲状腺癌免疫细胞浸润的相关研究表明,晚期甲状腺癌病人CD3+、CD4+和CD8+T细胞水平显著降低,并且这种改变在老年病人中尤为显著,其降低程度与癌症的预后不良有显著相关性[14-15]。本文研究结果与其一致。在癌症发展过程中CD8+ T细胞可以活化成为细胞毒性T细胞,是抗感染与抑制癌症的核心免疫细胞,其代谢活性与抗肿瘤免疫力相关[16]。有研究表明,浆细胞与CD8+T细胞对于肿瘤的抑制效应相一致,并且可以增强CD8+T细胞抗肿瘤效应[17]。M1型巨噬细胞具有抗原递呈的作用,可间接激活CD8+T细胞转变为细胞毒性T细胞[18]。因此,DTC病人肿瘤组织中CD8+T细胞与浆细胞及M1型巨噬细胞有相关性。另有研究表明,树突状细胞可以刺激甲状腺髓样癌病人细胞毒性T细胞的抗肿瘤免疫应答,在临床试验中将带有肿瘤抗原的树突状细胞接种到甲状腺髓样癌病人中可以发挥良好治疗效果[19]。肿瘤相关巨噬细胞浸润约占肿瘤免疫细胞浸润的50%,且与癌症预后不良相关[20]。M1与M2型巨噬细胞可通过极化作用相互转变,M1型巨噬细胞通过分泌促炎性因子、趋化因子与递呈抗原参与正向免疫应答,发挥杀伤肿瘤细胞的作用[21];而M2型巨噬细胞是肿瘤预后的不利因素,可分泌血管内皮生长因子、表皮细胞生长因子和转化生长因子-β等促进肿瘤成长[22],并表达免疫抑制因子如程序性死亡受体-配体1(PD-L1),抑制特异性CD8+T细胞对肿瘤的细胞毒性功能,并诱导其凋亡[23]。目前,诱导肿瘤组织中M2型巨噬细胞向M1型巨噬细胞转化及M1型巨噬细胞相关外泌体表达已成为癌症治疗的新方向[24-25]。
本研究Kaplan-Meier生存分析显示,NK细胞的活性显著影响DTC病人的复发率。NK细胞是具有强效细胞溶解功能的天然淋巴细胞,其分泌的γ-干扰素可以通过激活M1型巨噬细胞发挥抗肿瘤作用[26]。针对NK细胞的肿瘤免疫治疗也在不断尝试,目前面临最大的问题是导入NK细胞后如何使其在不损伤自身正常细胞的情况下对肿瘤细胞实行精准打击[27]。有研究指出,NK细胞在甲状腺癌组织中的表达较正常组织明显下降[28];还有研究对肝癌免疫细胞浸润及预后分析指出,活化的NK细胞比例高的病人预后更好[29]。针对NK细胞的免疫疗法可能成为预防DTC病人肿瘤复发的一种新型治疗手段。本研究同时存在一定的局限性:由于本研究是基于TGCA数据库的回顾性研究,并不能避免地域、人种等差异因素的影响;Kaplan-Meier生存分析显示22种免疫细胞中只有NK细胞的活性与DTC病人复发率相关,而与其他免疫细胞均无相关性,这与样本量较少且肿瘤分期分布不均有一定关系。
综上所述,本文通过免疫细胞亚群组成与DTC病人转录本及临床数据的分析,推测影响DTC病人预后的免疫细胞为NK细胞。针对NK细胞的免疫疗法可能成为预防DTC复发的选择之一。
[参考文献]
[1] SEIB C D, SOSA J A. Evolving understanding of the epide-miology of thyroid cancer[J]. Endocrinology and Metabolism Clinics of North America, 2019,48(1):23-35.
[2] MAZZAFERRI E L, KLOOS R T. Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer[J]. The Journal of Clinical Endocrinology and Metabolism, 2001,86(4):1447-1463.
[3] DURANTE C, MONTESANO T, TORLONTANO M, et al. Papillary thyroid cancer: time course of recurrences during postsurgery surveillance[J]. The Journal of Clinical Endocrinology and Metabolism, 2013,98(2):636-642.
[4] GRANT C S, HAY I D, GOUGH I R, et al. Local recurrence in papillary thyroid carcinoma: is extent of surgical resection important[J]? Surgery,1988,104(6):954-962.
[5] SATG D. A tumor profile in primary immune deficiencies challenges the cancer immune surveillance concept[J]. Frontiers in Immunology, 2018,9:1149.
[6] MESSERSCHMIDT J L, BHATTACHARYA P, MESSERSCHMIDT G L. Cancer clonal theory, immune escape, and their evolving roles in cancer multi-agent therapeutics[J]. Current Oncology Reports, 2017,19(10):66.
[7] HE T F, SUSAN E Y, FRANKEL P H, et al. Multi-panel immunofluorescence analysis of tumor infiltrating lymphocytes in triple negative breast cancer: evolution of tumor immune profiles and patient prognosis[J]. PLoS One, 2020,15(3):e0229955.
[8] MITCHELL K G, PARRA E R, NELSON D B, et al. Tumor cellular proliferation is associated with enhanced immune checkpoint expression in stage Ⅰ non-small cell lung cancer[J]. The Journal of Thoracic and Cardiovascular Surgery, 2019,158(3):911-919.
[9] FERRARI S M, FALLAHI P, GALDIERO M R, et al. Immune and inflammatory cells in thyroid cancer microenvironment[J]. International Journal of Molecular Sciences, 2019,20(18):4413.
[10] TOPALIAN S L, HODI F S, BRAHMER J R, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in can-cer[J]. New England Journal of Medicine, 2012,366(26):2443-2454.
[11] HODI F S, ODAY S J, MCDERMOTT D F, et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. New England Journal of Medicine, 2010,363(8):711-723.
[12] NEWMAN A M, LIU C L, GREEN M R, et al. Robust enumeration of cell subsets from tissue expression profiles[J]. Nature Methods, 2015,12(5):453-457.
[13] BINDEA G, MLECNIK B, TOSOLINI M, et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer[J]. Immunity, 2013,39(4):782-795.
[14] RABOLD K, GIELEN P R, KERS-REBEL E D, et al. T-cell lymphopenia in patients with advanced thyroid carcinoma is associated with poor prognosis[J]. The Oncologist, 2019,24(3): e106-e110.
[15] SUGINO K. An analysis of lymphocyte subsets in the regional lymph nodes of patients with papillary thyroid carcinoma[J]. Surgery Today, 1994,24(4):323-327.
[16] KAMPHORST A O, ARAKI K, AHMED R. Beyond adjuvants: immunomodulation strategies to enhance T cell immunity[J]. Vaccine, 2015,33(Suppl 2): B21-B28.
[17] KROEGER D R, MILNE K, NELSON B H. Tumor-infiltrating plasma cells are associated with tertiary lymphoid structures, cytolytic T-cell responses, and superior prognosis in ovarian cancer[J]. Clinical Cancer Research, 2016,22(12):3005-3015.
[18] CHENG L F, WANG Y H, HUANG L. Exosomes from M1-polarized macrophages potentiate the cancer vaccine by creating a pro-inflammatory microenvironment in the lymph node[J]. Molecular Therapy: the Journal of the American Society of Gene Therapy, 2017,25(7):1665-1675.
[19] BACHLEITNER-HOFMANN T, STIFT A, FRIEDL J, et al. Stimulation of autologous antitumor T-cell responses against medullary thyroid carcinoma using tumor lysate-pulsed dendritic cells[J]. The Journal of Clinical Endocrinology and Metabolism, 2002,87(3):1098-1104.
[20] JACKAMAN C, TOMAY F, DUONG L, et al. Aging and cancer: the role of macrophages and neutrophils[J]. Ageing Research Reviews, 2017,36:105-116.
[21] WANG Piaopiao, WANG Huihui, HUANG Qianqian, et al. Exosomes from M1-Polarized macrophages enhance paclitaxel antitumor activity by activating macrophages-mediated inflammation[J]. Theranostics, 2019,9(6):1714-1727.
[22] YAMAGUCHI T, FUSHIDA S, YAMAMOTO Y, et al. Tumor-associated macrophages of the M2 phenotype contri-bute to progression in gastric cancer with peritoneal dissemination[J]. Gastric Cancer, 2016,19(4):1052-1065.
[23] GAJEWSKI T F, SCHREIBER H, FU Y X. Innate and adaptive immune cells in the tumor microenvironment[J]. Nature Immunology, 2013,14(10):1014-1022.
[24] ZHENG X, TURKOWSKI K, MORA J, et al. Redirecting tumor-associated macrophages to become tumoricidal effectors as a novel strategy for cancer therapy[J]. Oncotarget, 2017,8(29):48436-48452.
[25] YE Yibiao, XU Yunxiuxiu, YU Lai, et al. Long non-coding RNA cox-2 prevents immune evasion and metastasis of hepatocellular carcinoma by altering M1/M2 macrophage polarization[J]. Journal of Cellular Biochemistry, 2018,119(3):2951-2963.
[26] OSULLIVAN T, SADDAWI-KONEFKA R, VERMI W, et al. Cancer immunoediting by the innate immune system in the absence of adaptive immunity[J]. The Journal of Experimental Medicine, 2012,209(10):1869-1882.
[27] MUNTASELL A, OCHOA M C, CORDEIRO L, et al. Targeting NK-cell checkpoints for cancer immunotherapy[J]. Current Opinion in Immunology, 2017,45:73-81.
[28] SACK J, BAKER J R, WEETMAN A P, et al. Thyrocyte specific killer cell activity is decreased in patients with thyroid carcinoma[J]. Cancer,1987,59(11):1914-1917.
[29] 程熠,吳莹莹,刘东伯,等. 肝癌免疫细胞浸润模式及与预后的相关性分析[J]. 华中科技大学学报(医学版), 2019,48(3):276-280.
(本文编辑 黄建乡)

