体外循环法对犬骨骼肌缺血再灌注损伤的保护作用
周 强,童梁成,薛 庆,王国军,刘 琨,夏志强,李 颖
骨骼肌缺血再灌注损伤(ischemia reperfusion injury, IRI)是临床常见的一种外科并发症,多见于骨筋膜室综合征、挤压综合征、血管损伤和外周血管病等多种疾病[1,2]。目前,一些临床手段已广泛应用于其治疗,包括高压氧、药物干预、缺血预处理和缺血后处理等,但仍需进一步评价其作用方式和机制[3,4]。探索新的临床治疗策略,改善患者术后生活质量,是目前亟待解决的临床问题。
研究发现,缺血再灌注损伤的程度与氧自由基、炎性介质的释放密切相关,且体外循环可以影响组织缺血再灌注损伤程度[5-8]。但体外循环灌注是否可以减轻内皮细胞损伤、减少炎性因子释放、减少自由基的生成等病理过程,对犬骨骼肌缺血再灌注损伤是否具有一定的保护作用,仍有待进一步的研究。
本实验通过建立犬骨骼肌缺血再灌注损伤模型,通过HE染色法观察组织炎性细胞浸润,利用TUNEL法观察组织凋亡的变化,借助特异性的试剂检测血清中LD、SOD等酶的变化,并通过ELISA法检测组织中血清中IL-10和TNF-α等细胞因子的变化,从而评价ECC法再灌注模式对犬骨骼肌缺血再灌注损伤的保护作用,为临床相关疾病的治疗提供实验依据。
1 材料与方法
1.1 材料及设备 实验动物比格犬购于常州贝乐实验动物养殖有限公司。体重10~15 kg,犬龄2~5岁,共27只,随机分为对照组、模型组和ECC组,每组9只。铁苏木素购于武汉谷歌生物科技有限公司。SOD,LD试剂盒购于江苏晶美公司。TNF-α,IL-10 ELISA试剂盒购于Abcam公司。
1.2 犬骨骼肌缺血再灌注损伤模型建立 建立犬骨骼肌缺血再灌注损伤模型:术前12 h禁饮食,3%戊巴比妥麻醉犬后(腹腔内麻醉,30 mg/kg),仰卧位固定于操作台;左侧后肢自腹股沟处平行股动静脉处,逐层切开皮肤及皮下组织,显露股动静脉、旋髂浅支、腹壁浅支及肌支血管,结扎腹壁浅支及肌支血管,自旋髂浅支下缘结扎股动静脉,伤口无菌敷料包扎,常温下旷置。对照组动物,结扎离断6 h后予以通血。模型灌注组动物,结扎5 h后予以灌注(350 ml NaCl,7.5 ml KCl,7 ml NaHCO3,130 ml 10%葡萄糖,磷酸肌酸钠)灌注1 h后通血;ECC组动物,结扎后5 h后予以行ECC灌注,1 h后通血。经股动脉插入灌洗管,自股动脉近端插入5 mm,用3-0丝线固定,接灌洗液,用静脉输液泵以50 ml/h的速度持续灌注,直至近端清创完毕;然后予以吻合股动、静脉,重建血循环,分别检测各项指标的变化。
1.3 HE染色法观察组织炎性细胞浸润 按照上述分组,分别取各组犬骨骼肌新鲜组织,4%多聚甲醛固定24 h。组织块梯度乙醇进行脱水,75%乙醇4 h,85%乙醇2 h,90%乙醇 2 h,95%乙醇 1 h,无水乙醇Ⅰ处理30 min,无水乙醇Ⅱ处理30 min,醇苯处理5~10 min,二甲苯Ⅰ处理5~10 min,二甲苯Ⅱ处理5~10 min。组织块包埋于蜡块中,修整后-20°冷冻切片,片厚 4 μm。上述石蜡切片经过二甲苯和乙醇脱蜡处理后HE染色。苏木精染色15 min,漂洗10~30 s后0.5%伊红液染色 3 min后漂洗2 min。上述切片经过脱水处理,50%乙醇 1~2 s,70%乙醇 1~2 s,80%乙醇 1~2 s,无水乙醇 5~10 min,二甲苯(I)2 min,中性树胶封片,置于显微镜下观察,图像采集结果,分析各组间差异。
1.4 TUNEL法观察组织凋亡的变化 按照上述分组,分别取各组犬骨骼肌新鲜组织,按上述操作过程制备组织切片,经过二甲苯和乙醇脱蜡处理后TUNEL法染色处理,切片脱水后置于显微镜下观察,图像采集结果,分析各组间差异。
1.5 检测血清中指标的变化 按照上述分组,制备血清样品,按照试剂盒的操作要求,处理各组样品。生化检测法检测各组织中LD、SOD等酶的变化,分析各组间差异。ELISA法检测组织中TNF-α、IL-10等细胞因子的变化,分析各组间差异。
2 结 果
2.1 骨骼肌缺血再灌注损伤模型建立 成功建立犬骨骼肌缺血再灌注损伤模型(图1)。
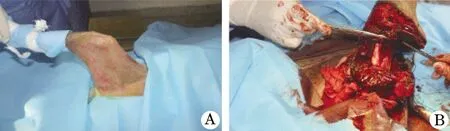
图1 犬骨骼肌缺血再灌注损伤模型
2.2 组织炎性细胞浸润 HE染色实验结果表明,与对照组相比较,模型组动物的组织炎性细胞浸润明显,提示缺血再灌注损伤可引起组织的炎性反应;经ECC法灌注的动物,其组织炎性细胞浸润程度显著低于其他灌注组动物(图2)。
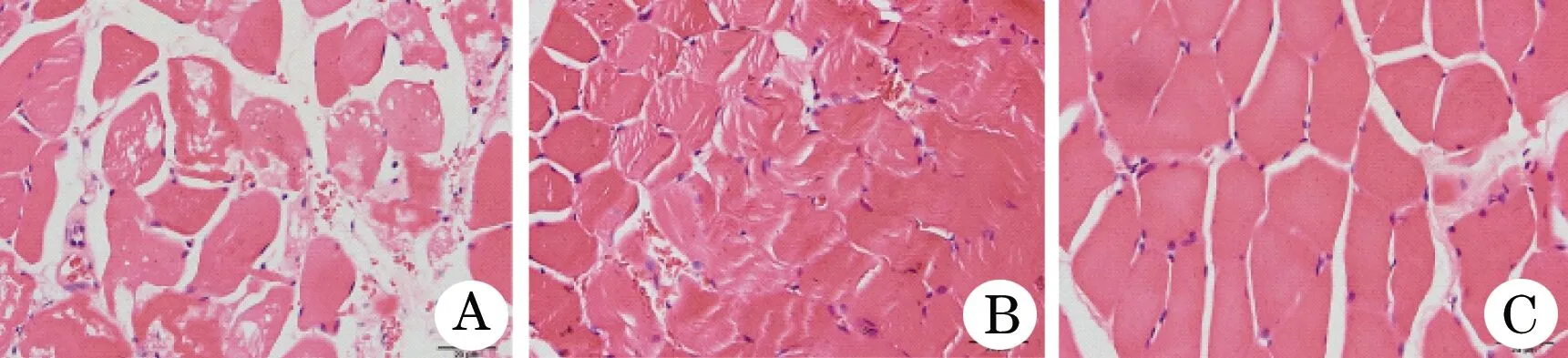
图2 犬缺血再灌注模型组织炎性细胞浸润情况(HE,×200)
2.3 组织凋亡的变化 TUNEL染色实验结果表明(图3),与对照组比较,模型组动物组织的细胞凋亡显著增加,提示缺血再灌注可诱导细胞凋亡的发生,引起局部组织损伤;经ECC法灌注的动物,其组织的细胞凋亡程度显著低于其他灌注组动物。
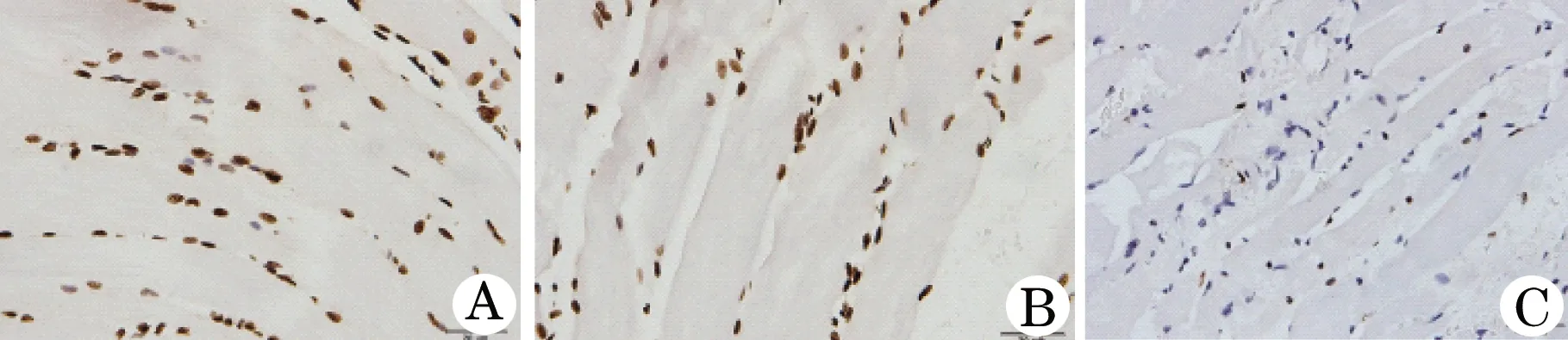
图3 TUNEL法犬骨骼肌缺血组织凋亡的变化(×200)
2.4 检测血清中指标的变化 通过特异性的试剂盒,检测血清中LD、SOD含量的变化。与对照组相比较,模型组动物血清中上述酶的含量显著增加,且差异均有统计学意义(P<0.01),提示缺血再灌注可引起局部组织损伤;经ECC法灌注的动物,其血清中上述酶低于其他灌注组动物(P<0.05)。
ELISA法检测组织中IL-10和TNF-α的变化。与对照组相比较,模型组动物血清中上述细胞因子的含量显著增加,差异也均有统计学意义(P<0.01);经ECC法灌注的动物,其血清中上述细胞因子均低于其他灌注组动物(P<0.05,表1)。
表1 犬骨骼肌缺血再灌注损伤血清指标的变化
3 讨 论
骨骼肌缺血再灌注损伤是一个复杂的病理过程,涉及氧自由基损伤、钙超载、炎性反应等机制[9]。骨骼肌缺血再灌注损伤是目前骨科创伤中常见问题,在止血带损伤、严重肢体创伤、大肢体离断伤等疾病中广泛存在,目前仍缺乏有效的手段减轻缺血再灌注损伤对骨骼肌的损害。研究表明,骨骼肌缺血再灌注损伤过程中,氧自由基起着重要的调节作用,活性氧和激活的中性粒细胞是主要的影响因素,通过激活环氧化酶和脂质过氧化酶转运金属离子的通路,增加周围组织的脂质过氧化反应,诱导细胞因子的释放,如前列腺素类、血栓素、白介素等,进而促进和加重局部组织的炎性反应。巨噬细胞释放水解蛋白酶和活性氧自由基,会加重局部炎症和组织的损伤,从而阻断一氧化氮合成酶的活性,减少了一氧化氮的合成,促进细胞的凋亡。此外,还可以促进氧自由基转变成羟基自由基,细胞膜的结构的由于膜脂质过氧化而收到损伤,加剧缺血组织的进一步受损[10,11]。进一步研究骨骼肌缺血再灌注损伤的病理机制,寻找能够缓解或阻断缺血再灌注损伤进程的干预因素,为临床工作提供更好的指导,提高骨骼肌损伤的治疗效果。
骨骼肌对缺血较为敏感,在缺血期及恢复血流后都会出现骨骼肌损伤[12]。通常情况下,骨骼肌能够耐受2 h缺血而不产生永久损伤;如果缺血持续2~4 h,会发生一些可逆性细胞损伤;但6 h及以上的缺血则会引起骨骼肌出现不可逆的组织坏死[13]。研究发现,体外循环均可影响缺血再灌注损伤的程度,但其具体作用尚未完全阐明。本研究中,首先建立犬骨骼肌缺血再灌注损伤模型,选择ECC灌注方法,观察其对缺血再灌注损伤的保护作用。通过对组织病理检测以及形态学观察发现,模型组骨骼肌组织内肌细胞水肿、肌纤维溶解断裂、结构紊乱,炎性细胞浸润明显;而ECC法再灌注处理的动物,其组织炎性反应程度显著低于其他模型组动物。
近年来,国内外诸多学者认为缺血再灌注损伤有细胞凋亡机制参与[14,15]。检测结果显示:与对照组相比较,模型组动物组织的细胞凋亡显著增加,经ECC法灌注后骨骼肌细胞凋亡有所减少。缺血再灌注损伤中自由基损伤及脂质过氧化反应是引起组织损伤的重要机制。氧自由基、钙超载等因素参与了上述病理过程,与内皮细胞损伤、组织中炎性介质的释放密切相关[16-19]。王飞等[20]发现,低温等灌注方式对于离断的肢体有延长再植时间,减少断肢代谢,减少缺血再灌注损伤的作用。蒋继亮等[21]发现,早期通血、导管灌注、防治缺血再灌注损伤等进行再植手术能提高再植成功率;术后早期功能康复训练能促进患肢功能恢复。文献[22,23]认为,在大肢体再植中应用体外循环技术可以显著降低手术中的风险,提高再植肢体的功能和成功率,是一个有用和有效的方法,值得进一步深入研究和推广。SOD是一种能有效清除自由基的特异性酶,通过歧化反应快速催化超氧阴离子转化为O2和H2O2,防止超氧阴离子在体内堆积产生毒性,进而清除自由基保护细胞[24]。检测组织的SOD活力,能够了解组织对自由基的清除能力和抗氧化能力。实验结果显示:模型组动物的血清中LD、SOD等酶的水平显著增加,而ECC法再灌注处理的动物,血清中上述酶的水平则显著降低,差异均有统计学意义。
适当的炎性反应可将细胞因子水平维持在适当的水平,有利于细胞免疫和机体恢复;如果炎性因子过度释放和调节失控,则会诱发全身炎性反应综合征。TNF-α是参与创伤后机体炎性反应的主要细胞因子之一[25]。我们推测,在缺血再灌注损伤中,ECC法可以有效减少炎性因子释放,下调炎性反应,从而减少缺血再灌注损伤引起的一系列后果。本研究结果显示,模型组动物的血清中IL-10和TNF-α等细胞因子的含量显著增加,而ECC法再灌注处理的动物,其水平则显著降低。
以上结果均表明,ECC法再灌注模式对犬骨骼肌缺血再灌注损伤具有一定的保护作用。ECC法通过减轻骨骼肌组织炎性细胞浸润程度,降低损伤骨骼肌细胞的凋亡率,降低LD、SOD等酶的活力和血清中IL-10和TNF-α等细胞因子的含量,从而达到对犬骨骼肌缺血再灌注损伤的保护作用。本研究为临床相关疾病的治疗提供了一定的实验依据和新的策略。

