剪切波弹性参数与乳腺癌免疫组化表达的相关性
曹春莉 李军 童瑾 曹玉文 董建 杜婷婷
1石河子大学医学院第一附属医院超声科(新疆石河子832008);2石河子大学医学院病理教研室(新疆石河子830000)
乳腺癌为绝大多数(83%)国家最常被诊断的癌症,其发病率远高于其他癌症[1-2]。随着乳腺癌分子生物学的发展及个体精准化治疗要求的不断提高,以乳腺癌基因特征为基础的免疫组化及分子分型越来越受到学者的关注,研究者们试图通过评估影像学的表现预测乳腺癌免疫组化表达及分子分型的作用[3-4]。声触诊组织量化成像(virtual touch tissue imaging quantification,VTIQ)技术作为较新的剪切波弹性成像技术,可瞬时获取感兴趣区域的剪切波速度值(shear wave velocity,SWV),通过剪切波速度大小反应组织的硬度[5]。大量国内外研究证实[6-7],在获得的众多剪切波弹性参数中,剪切波速度最大值(SWVmax)可重复性及诊断效能最高。本研究通过采用剪切波弹性成像技术,探讨剪切波弹性参数SWVmax 与免疫组织化学指标表达及分子分型之间的相关性,以期寻找术前无创性反映乳腺癌生物学特征的影像学指标,为乳腺癌治疗策略的选择及预后的判断提供一定的参考价值。
1 资料与方法
1.1 一般资料收集2017年6月至2019年6月在我院行乳腺癌手术且术后病理证实为乳腺癌并行免疫组织化学检查的患者110例(共114个乳腺肿块),患者年龄27~81岁;所有患者术前均接受常规超声及VTIQ技术检查;超声检查时间与手术时间的间隔不超过两周。排除标准:肿块最大直径>40 mm或<5 mm;VTIQ 剪切波弹性成像技术成像中质量模式显示为中或低的肿块;检查前接受过穿刺活检的肿块;检查前接受过治疗的肿块(放化疗、内分泌治疗);经病理证实的恶性肿块未进行免疫组织化学指标的检测。
1.2 剪切波弹性成像技术检查选用德国Siemens ACUSON S3000 彩色多普勒超声诊断仪,L9-4 线阵探头。患者取仰卧位,充分暴露双乳及腋窝区域,采用放射状连续性扫查法行常规超声检查,观察肿块的大小、形态、纵横比、钙化及血流情况等,然后启动VTIQ 模式,检测深度为4 cm,有效取样范围4.0 cm×2.5 cm,取样框两侧界包括病灶周边至少5 mm的范围,首先在“质量模式”下观察剪切波质量,病灶为均匀绿色进入“速度模式”,以病灶周围背景组织呈现均匀浅蓝色或淡绿色,病灶内部呈现红色或黄色为标准,获得最终的VTIQ 剪切波弹性成像速度模式图像。根据颜色不同,将ROI 取样框(1 mm×1 mm)分别置于病灶SWV 最高区域、最低区域、肿块边缘、中间区域和周围腺体。记录剪切波速度最大值(SWVmax),单位为m/s。所有测量均重复5次,最后取平均值。测量时保持探头与扫查部位垂直,注意避开钙化或液化坏死区域。
1.3 免疫组化、分子分型标准雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)以肿瘤细胞核出现棕黄色颗粒,着色阳性细胞数≥1%为阳性[8]。人类表皮生长因子2(human epidermal growth factor receptor-2,HER-2)以细胞膜中出现棕黄色或黄色颗粒为阳性细胞,分为四个等级:0、1+、2+、3+。3+判断为HER-2阳性,0和1+判断为HER-2阴性,2+者需进一步应用原位荧光杂交方法进行HER-2 基因扩增状态检测,基因扩增者为阳性,未扩增者为阴性[9]。Ki-67以肿瘤细胞核出现棕黄色颗粒,着色阳性细胞数<14%为低表达,≥14%为高表达[10]。
分子分型分类根据2017年St.Gallen 乳腺癌共识[11],分为以下四种亚型:(1)Luminal A型:ER(+)和(或)PR(+)、HER-2(-)、Ki-67表达<14%;(2)Luminal B型:HER-2阴性型:ER(+)和/或PR(+)、HER-2(-)、Ki-67表达≥14%;HER-2阳性型:ER(+)和(或)PR(+)、HER-2(+)、Ki-67 任何水平;(3)HER-2过表达型:ER(-)和PR(-)、HER-2(+);(4)三阴型(Triple negative breast cancer,TNBC):ER(-)、PR(-)、HER-2(-)。
1.4 统计学方法采用SPSS 22.0统计分析。计数资料以例(%)表示,采用χ2检验,对于满足正态分布的计量资料以均数±标准差表示,两组计量资料比较采用独立样本t检验;满足正态性、方差齐性的多组计量资料比较采用单因素方差分析,多重比较采用LSD-t检验。不符合正态分布的数据采用中位数(四分位数)表示。肿瘤大小、年龄与SWVmax值的相关性分析采用Pearson 相关,将所有相关及差异显著的自变量纳入多元线性回归分析,采用“逐步回归分析”的方法,确定最后进入方程的自变量,评估对SWVmax值影响的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料选取女性乳腺癌患者110例(共114个肿块),癌灶大小0.6~3.9 cm,平均大小(1.91±0.98)cm。114个乳腺癌肿块中,80个为浸润性导管癌,10个为导管原位癌,9个为导管内乳头状癌,7个为浸润性小叶癌,5个为粘液癌,3个为髓样癌。免疫组织化学标志物表达情况:ER表达阳性68个,ER表达阴性46个;PR表达阳性50个,PR表达阴性64个;HER-2表达阳性41个,HER-2表达阴性73个;Ki-67 低表达45个,Ki-67 高表达69个;分子亚型情况:Luminal A型35个,Luminal B型52个(HER-2阴性型27个,HER-2阳性型25个),HER-2过表达型16个,TNBC型11个。
2.2 乳腺癌SWVmax值与肿瘤大小、患者年龄的相关性分析114个乳腺癌肿块的SWVmax值为1.73~10.0 m/s,平均(5.74±1.87)m/s。Pearson 相关分析结果显示,SWVmax值与癌灶大小呈正相关(图1,r=0.636,P<0.05);SWVmax值与患者年龄不相关(图1,r=0.008,P>0.05)。SWVmax值与癌灶大小之间的直线方程为:y=3.443+1.203x,(R=0.636,P<0.05)。

图1 SWVmax值与癌灶大小、患者年龄的相关性散点图Fig.1 Scatter diagram of correlation between swvmax value and tumor size,patient′s age
2.3 乳腺癌不同免疫组织化学指标表达SWVmax值的比较采用独立样本t检验对乳腺癌不同免疫组织化学指标的表达SWVmax值进行比较,结果发现:HER-2阳性表达组SWVmax值高于阴性表达组,Ki-67 高表达组SWVmax值高于低表达组,且差异均有统计学意义(均P<0.05)。SWVmax值在ER表达阳性组与阴性组之间、PR 阳性表达组与阴性表达组之间差异无统计学意义(均P>0.05,表1)。
2.4 乳腺癌不同分子分型之间肿块SWVmax值的比较单因素方差分析结果显示:乳腺癌不同分子亚型的肿块间SWVmax值差异有统计学意义(F=10.208,P<0.05),其中Luminal B型中的HER-2阳性型及HER-2过表达型的SWVmax值较高,两者之间差异无统计学意义(t=1.159,P=0.071),其次是Luminal B型中的HER-2阴性型及TNBC型,Luminal A型SWVmax值最低,即SWVmax值排序为:Luminal B(HER-2阳性型)型、HER-2过表达型>Luminal B(HER-2阴性型)型、TNBC型>Luminal A型(表2、图2-4)。
2.5 各个相关指标的多元线性回归分析将上述各项指标作为自变量,以SWVmax值作为因变量,进行多元线性回归分析,结果显示SWVmax值与乳腺癌肿块大小、Ki-67表达、HER-2表达情况存在线性相关,标准化回归系数分别为:0.496、0.258、0.213(均P<0.05),表明乳腺癌肿块大小对肿块弹性硬度值SWVmax 影响最大,Ki-67表达、HER-2表达对肿块弹性硬度值SWVmax 影响次之(表3)。
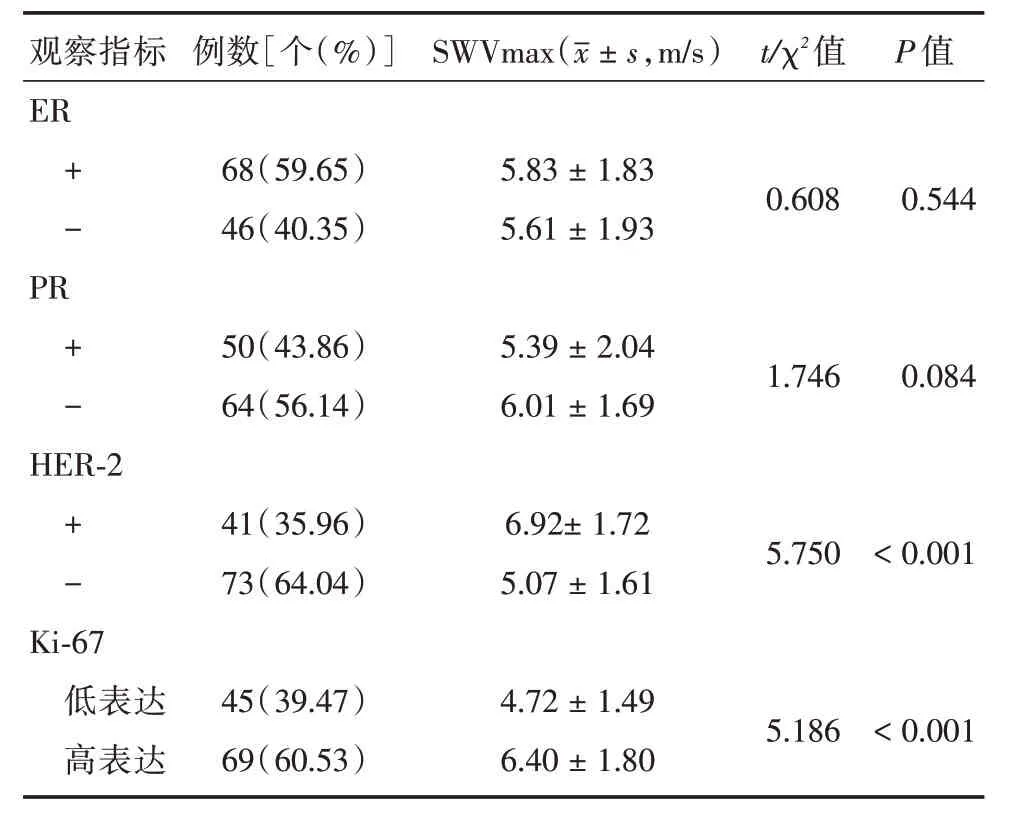
表1 乳腺癌不同免疫组织化学指标表达SWVmax值的比较Tab.1 Comparison of SWVmax values expressed by different immunohistochemistry indexes in breast cancer

表2 乳腺癌不同分子分型之间肿块SWVmax值的比较Tab.2 Comparison of SWVmax values of different molecular types of breast cancer

图2 女,62岁,SWVmax值为4.85 m/s,病理结果为乳腺浸润性导管癌,ER(+)、PR(-)、HER-2(-)、Ki-67(-),分子分型为Luminal A型Fig.2 Female,62 years old,SWVmax value is 4.85 m/s,pathological result is invasive ductal carcinoma of breast,ER(+),PR(-),HER-2(-),Ki-67(-),molecular type is Luminal A
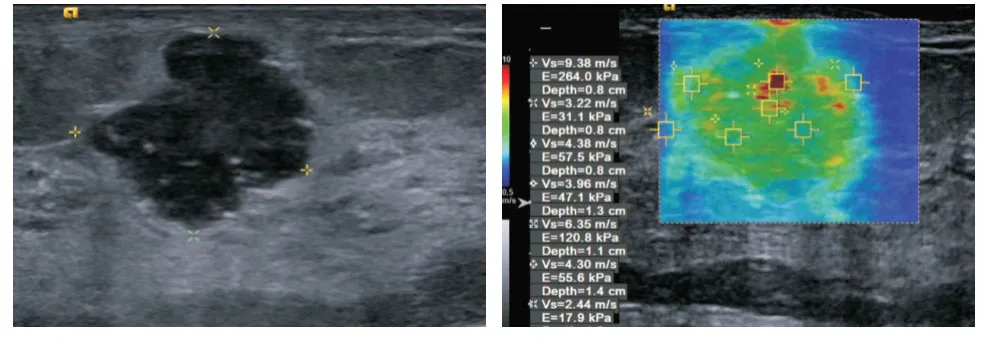
图3 女,56岁,SWVmax值为9.38 m/s,病理结果为乳腺浸润性导管癌,ER(-)、PR(-)、HER-2(+)、Ki-67(+),分子分型为HER-2过表达型Fig.3 Female,56 years old,SWVmax value is 9.38 m/s,pathological result is invasive ductal carcinoma of breast,ER(-),PR(-),HER-2(+),Ki-67(+),molecular type is HER-2 overexpression

图4 女,52岁,SWVmax值为6.67 m/s,病理结果为乳腺浸润性导管癌,ER(-)、PR(-)、HER-2(-)、Ki-67(+),分子分型为TNBC型Fig.4 Female,52 years old,SWVmax value is 6.67 m/s,pathological result is invasive ductal carcinoma of breast,ER(-),PR(-),HER-2(-),Ki-67(+),molecular type is TNBC
表3 乳腺癌肿块SWVmax值与各相关因素的多元线性回归分析Tab.3 Multiple linear regression analysis of SWVmax value and related factors of breast cancer mass
3 讨论
乳腺组织力学性质的变化与疾病进展相关,乳腺癌在发生发展的过程中,其硬度随之发生改变,在这些变化中,细胞外基质在乳腺癌组织中的异常沉积使基质逐渐变硬,对乳腺癌的侵袭生物学有重要的调节作用[12]。因此,肿瘤硬度的定量评估可以增加有用的信息,类似于异质性乳腺癌的预后特征。大量研究发现[6-7],在获得的众多剪切波弹性参数中,SWVmax值可重复性及诊断效能最高,是评价乳腺良恶性肿块的最佳定量参数。
研究结果显示SWVmax值与癌灶大小呈正相关(r=0.636,P<0.05),即随着肿块的增大,SWVmax值逐渐增大。本研究得出的多元线性回归方程中,肿块大小的标准化回归系数最大(0.496),表明肿块大小对SWVmax值的影响程度最大,与贾美红等[13]研究结果一致。随着肿瘤的生长,肿瘤细胞不断增殖,新生血管不断增加,间质水肿情况更加明显,肿瘤细胞的不断生长及浸润更易引起内部及周围结缔组织增生性反应,这些均导致肿块硬度增加。CHAMMING 等[14]尝试用剪切波弹性技术检测22例人乳腺癌肿瘤移植模型在生长过程的硬度值,并与病理结果进行相关性分析,结果显示,硬度值与肿瘤生长过程中的大小具有很好的相关性(r=0.94,P<0.000 1)。
本研究的单因素分析和多因素分析均显示HER-2及Ki-67表达对SWVmax值均有影响。HER-2过表达时,肿瘤细胞增生比较活跃,肿瘤细胞代谢所需要的氧气及能量供应相对不足,同时会导致内部钙质的分泌,致使肿瘤内部出现钙化,因此会导致硬度值的增加[15]。研究[16]证实,HER-2 与血管内皮生长因子具有显著的相关性,其可以上调血管内皮生长因子的表达,当HER-2过表达时,肿瘤内部的VEGF 活性表达增加,促进肿瘤内部新生血管的生成,促进肿瘤细胞的增殖,因此新生血管生成可能在一定程度上促进肿瘤硬度的增加。另有研究[12]认为,HER-2在细胞外胶原基质硬度与细胞内硬度间的机械力传导中有重要作用,增加细胞内硬度和对细胞外基质硬度的细胞内机械敏感性。Ki-67的表达程度也对SWVmax值有影响,随着Ki-67表达程度的增高,SWVmax值逐渐增大,与其他研究[17]结果一致。Ki-67表达增强时,处在细胞周期为活跃期的细胞明显增多,细胞增长迅速,肿瘤细胞不断向细胞外基质黏附和侵袭,细胞外基质纤维粘连蛋白结构和功能发生变化导致肿块与周围组织发生粘连,因此,肿块弹性降低导致硬度值增加。也有研究[18-19]认为,肿瘤硬度与Ki-67表达程度之间的潜在机制可能是由Ki-67 高表达的肿瘤血管特性导致的,硬度的机械特性与肿瘤细胞和微血管密度相关。在本研究中,ER、PR 阳性表达组与阴性组之间乳腺癌肿块SWVmax值差异无统计学意义。ER、PR 阳性表达与肿瘤微钙化形成呈正相关,微钙化的形成可导致肿块硬度值增加[20]。有研究[21]认为,乳腺癌ER、PR 阴性表达与HER-2表达呈正相关,上述研究已证实HER-2表达阳性的乳腺癌具有更高的硬度。因此,ER、PR 阳性表达和阴性表达都有可能在一定程度上导致肿块硬度的增加。
本研究结果显示,不同分子分型组间SWVmax值存在显著差异,其中Luminal B型中的HER-2(+)及HER-2过表达型的SWVmax值较高,Luminal A型SWVmax值最低。HER-2过度表达的乳腺癌肿瘤周边胶原结缔组织不断增生、VEGF 活性表达增加及肿瘤内部出现钙化,这些均可以导致肿块的硬度增加。此外,YANAGAWA 等[22]研究认为,Luminal B型(HER-2阳性型)、HER-2过表达型和TNBC型肿瘤比Luminal A型和Luminal B型(HER-2阴性型)型肿瘤具有更大的非整倍体和染色体不稳定性,具有这些特征的肿瘤具有更高的增殖活性和更差的预后。本研究多因素分析显示SWVmax值与不同分子分型间无统计学上的显著相关性,与GANAU 等[23]研究结果一致,而樊智颖等[17]则认为浸润性导管癌Emean 在4种分子分型中差异有统计学意义。可能与本研究纳入的病例数量相对较少有关,本研究分子分型分类有限,其中TNBC 亚型只有11例,因纳入的数量较少,很难对它们的硬度形成明确的结论,因此尚需扩大样本量进一步去证实两者之间的关系。
综上所述,剪切波弹性成像参数SWVmax值与一些乳腺癌预后相关的免疫组化表达具有相关性,剪切波弹性成像参数SWVmax值可以在一定程度上作为无创性反映乳腺癌生物学特征的影像学指标,剪切波弹性成像技术可能为乳腺癌治疗策略的选择及预后的判断提供一定的参考依据。

