替格瑞洛改善心肌缺血再灌注损伤的机制
陈佩儿 陈灿 何原 莫少门 叶文桃 钟剑锋
广东医科大学附属医院(广东湛江524001)
急性心肌梗死(acute myocardial infarction,AMI)是冠状动脉急性、持续性缺血缺氧所引起的心肌坏死,严重威胁着人类的健康[1]。随着冠状动脉介入手术(percutaneous coronary intervention,PCI)的开展与药物溶栓的应用,虽大大降低了急性心梗患者的短期病死率,但却无法明显改善患者的远期预后,其主要原因在于闭塞的冠状动脉再次开通后引起了缺血再灌注损伤(ischemiareperfusion injury,IRI)[2-3]。
再灌注后引发的氧化应激和炎症反应是导致心肌损害的重要因素[4-6]。NF-κB 通路在调控氧化应激和炎症损伤中起重要作用,在炎症及肿瘤发展中发挥关键性的调控[7-8]。NADPH 氧化酶(NOX)是人血管系统中活性氧(reactive oxygen species,ROS)的主要来源[9]。近年来研究[10]发现,血管内皮细胞产生的ROS 主要来源于NOX4。再灌注后炎症反应能够上调心肌细胞中NOX4的表达,引起ROS 升高并直接损伤细胞,而ROS 亦可促使炎症相关因子的表达提高间接地损伤细胞。
替格瑞洛(Ticagrelor)是新型P2Y12受体拮抗剂,可以在心脑血管系统中快速地发挥抗血小板作用[11-12]。替格瑞洛除了作用于P2Y12受体外,还有文献报道替格瑞洛具有减轻缺血再灌注损伤的作用,降低心肌细胞需氧量、提高心肌组织中SOD 活性、抑制中性粒细胞黏附和减少自由基,改善了缺血再灌注后的心肌损害[13],而目前其机制尚未明确。笔者预实验结果显示替格瑞洛不仅可以降低炎症因子的释放、减轻ROS的生成,还可能抑制NF-κB信号通路的活化。本实验旨在探讨替格瑞洛是否通过NOX4/ROS/NF-κB信号通路轴下调炎症因子表达及减轻氧化应激反应,从而改善缺血再灌注相关的心肌损伤,证实替格瑞洛治疗AMI较氯吡格雷的有效性。
1 材料与方法
1.1 一般材料8~10周龄250~300 g 雄性SD大鼠,由广东医科大学实验动物中心提供。细胞裂解液、BCA 蛋白浓度测定试剂盒、总抗氧化能力检测试剂盒(碧云天,中国),ELISA 试剂盒(达科为,中国),兔抗鼠NOX4 抗体、P-p65 抗体、IκB 抗体、P-IKK抗体(Abcam,美国),替格瑞洛(Sigma,美国)。
1.2 动物分组与处理利用完全随机数字法将60只250~300 g的雄性SD大鼠分为,Control(N):对照组;Sham(S):缺血再灌注损伤+生理盐水组;Clopidogrel(C):缺血再灌注损伤+氯吡格雷组;Ticagrelor(T):缺血再灌注损伤+替格瑞洛组,每组15只。其中S、C、T组大鼠通过制备心肌缺血再灌注损伤模型,C、T组大鼠在手术前灌胃强饲抗血小板药物,分别给予300 mg/kg(根据预实验药物浓度的筛选及文献报道[16])Clopidogrel、Ticagrelor预处理,连续7 d,同时Control组和Sham组大鼠给予同等量的生理盐水。
1.3 SD大鼠缺血再灌注损伤模型的建立选取约250 g的雄性SD大鼠,用5%水合氯醛麻醉,同时将自制的专用面罩套住大鼠外呼吸器官,固定好面罩后连接呼吸机,待呼吸平稳后接着在老鼠的胸部上进行刮毛备皮,用刀片小心切开大鼠胸前3-4 肋间皮肤,充分暴露大鼠心脏,视野清晰后在左侧肺动脉圆锥和左心耳交界下缘2 mm的区域进针,用U型管以压管的方式活结结扎LAD,一般可以看到心肌坏死后变色,大概30~45 min后可以解开活结开通血管,心脏缺血再灌注损伤的模型即完成。
1.4 SD大鼠内眦静脉血液采取将大鼠放置于木板平面上,用左手的大拇指和食指从上而下轻轻按住大鼠的头颈部,逐渐将大鼠的眼球突出,右手用镊子夹起酒精棉球轻轻擦拭大鼠的眼球周围,再用右手拇指和食指捏住一根已经用肝素进行过抗凝的毛细玻璃管,缓慢插入大鼠的眼睛前下方内眦处,可看到血液流入管内,然后取抗凝管在毛细管通道下接血,最后取出毛细玻璃管。
1.5 ELISA在预包被的酶标板中加入样品和标准品,37℃反应90 min,不洗;加生物素标记抗体,37℃反应60 min,0.01 mol/L TBS洗涤3次;加ABC,37℃反应30 min,0.01 mol/L TBS洗涤3次;加TMB,37℃反应25 min,0.01 mol/L TBS洗涤3次;加入TMB 终止液,波长A450 测定,根据标准曲线计算出样品中各指标的浓度。
1.6 总抗氧化能力检测试剂盒(FRAP法)在96孔板的每个检测孔中加入180 μL FRAP 工作液;空白对照孔中加入5 μL PBS;标准曲线检测孔内加入5 μL 各种浓度的FeSO4标准溶液;样品检测孔内加入5 μL 各种样品作为阳性对照,轻轻混匀;37℃孵育3~5 min后测定波长A593测定。
1.7 Western blot检测NOX4/ROS/NF-κB信号通路轴表达。提取心脏组织的蛋白质,采用BCA 试剂盒(碧云天,中国)测量蛋白浓度,计算上样量。蛋白电泳后转膜、脱脂奶粉封闭、小鼠一抗4℃孵育过夜,次日复温1 h后孵育二抗2 h后进行曝光,用α-tubulin 作为内参(稀释比例1∶1 000,武汉博士德)。采用Image J分析灰度值,以目的条带灰度值/内参条带灰度值进行统计分析。
1.8 统计学方法采用GraphPad Prism 7 对结果进行统计学分析,数据以均数±标准差表示,多组之间总体均数比较使用单因素方差分析,两组采用t检验进行数据比较。以P<0.05为差异有统计学意义。
2 结果
2.1 用ELISA法检测静脉血相关炎症指标笔者发现大鼠在心肌缺血再灌注损伤模型术前、后连续7 d 服用替格瑞洛,静脉血中的炎症因子水平(IL-1β、IL-6、TNF-α)对比各组显著减低,差异有统计学意义(图1)。
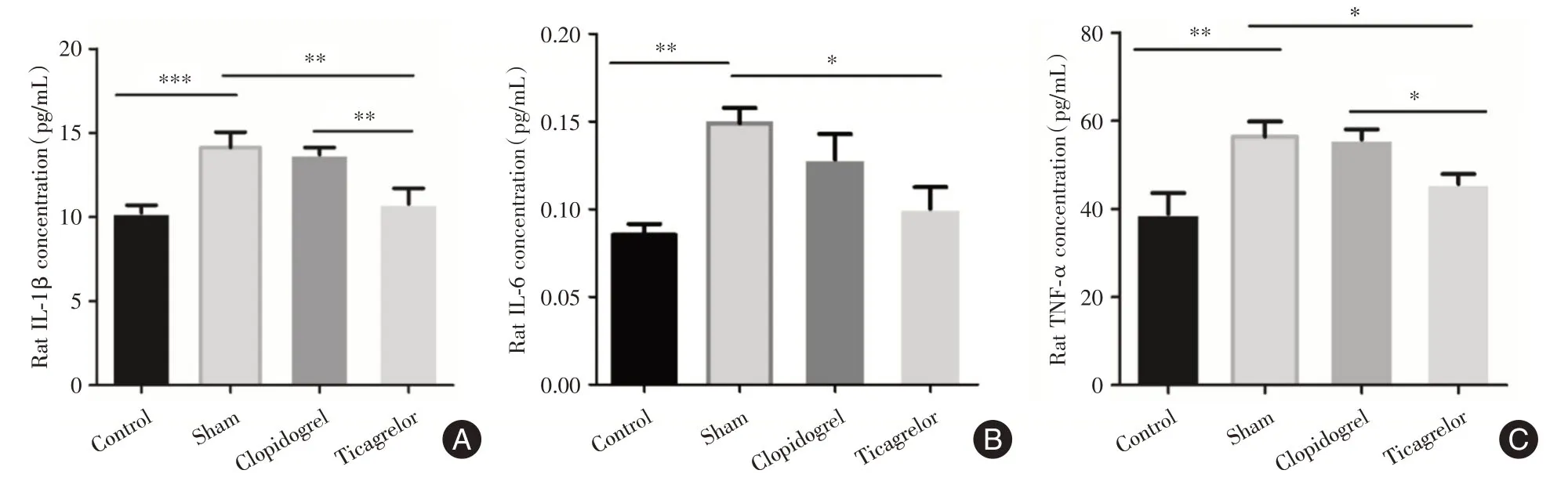
图1 替格瑞洛可降低缺血再灌注损伤后炎性因子的积累Fig.1 Ticagrelor can reduce the accumulation of inflammatory factors after ischemia-reperfusion injury
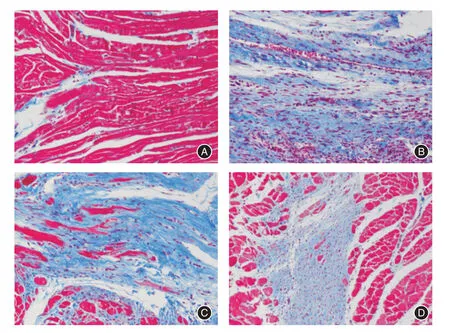
图2 替格瑞洛干预处理组纤维面积明显减少(×200)Fig.2 Ticagrelor can significantly reduce cardiac fibrosis after ischemia-reperfusion injury(×200)
2.2 在心肌缺血再灌注损伤模型后,光镜下观察不同处理组心肌组织马松染色笔者通过光镜下观察心脏Masson 染色发现(图2),与正常组(N组)心脏组织相比,生理盐水组(S组)的心肌纤维化更严重,心肌坏死范围和面积更大,而氯吡格雷组(C组)的心肌纤维化稍减轻,心肌纤维化面积稍减少,而令人振奋的是,替格瑞洛组(T组)的心肌细胞纤维化程度更低。
2.3 在心肌缺血再灌注损伤模型后,不同处理组NOX4的表达水平见图3,相对于正常组(N组),生理盐水组(S组)的NOX4表达显著升高(P<0.001),提示缺血再灌注后心肌细胞的氧化应激反应被明显激活,缺血再灌注损伤的替格瑞洛组(T组)和氯吡格雷组(C组)都可以相应地减少氧化应激相关因子NOX4的表达,但是替格瑞洛组相对于氯吡格雷组的氧化应激相关因子NOX4的表达相对更低(P<0.05)。
2.4 在心肌缺血再灌注损伤模型后,不同处理组FRAP值的水平用FRAP法测定血浆中总抗氧化能力,在心肌缺血再灌注模型中,术前连续7 d服用替格瑞洛组(T组),血浆中总抗氧化能力显著高于氯吡格雷组(C组),差异具有统计学意义(图4)。
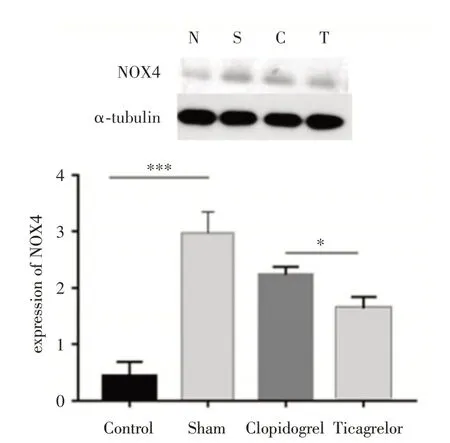
图3 不同处理组NOX4的表达水平,替格瑞洛组NOX4 明显较低Fig.3 Ticagrelor can significantly reduce the expression of NOX4

图4 不同处理组FRAP值的水平,替格瑞洛组总抗氧化水平较高Fig.4 Among the different treatment groups,Ticagrelor had the highest FRAP level
2.5 在心肌缺血再灌注损伤模型后,不同处理组NF-κB信号通路相关激活因子表达情况为了探究替格瑞洛是否通过NOX4/ROS/NF-κB信号通路下调炎症因子表达及减轻氧化应激反应,我们用Western Blot 法检测NF-κB信号通路的相关因子。P-p65 主要存在于活化的NF-κB 二聚体中,与正常组对比,生理盐水组(S组)和氯吡格雷组(C组)的P-p65表达水平显著升高(P<0.05),而替格瑞洛组与正常组差异无统计学意义,说明替格瑞洛可以抑制NF-κB信号通路的活化(图5A);如图5B所示,替格瑞洛处理组(T组)相对于生理盐水(S组)、氯吡格雷组(C组)的P-IKK表达均有明显降低(P<0.01),说明替格瑞洛可以减少IKK的激活;同时IκBα是NF-κB信号通路的抑制因子,当缺血再灌注时IκBα被迅速降解,其表达可明显降低(P<0.001),而替格瑞洛处理组相对于氯吡格雷组的IκBα表达相对降解减少(P<0.01),提示替格瑞洛可以减轻NF-κB信号通路的激活,减轻炎症反应(图5C)。

图5 Western blot 中不同组别P-p65、P-IKK、IκBα的蛋白表达水平Fig.5 The protein expression levels of P-P65、P-IKK、IκBα in different groups
3 讨论
目前的研究结果表明,心肌缺血再灌损伤的相关机制主要包括钙超载[14]、pH 快速变化[15]、线粒体功能障碍[16-17]、氧化应激反应[18]、炎症损伤[19]及细胞凋亡[20]等,并且各个机制并不是孤立发生的,而是可以相互之间调节的,其中钙超载以及ROS 产生是缺血再灌注损伤的基石。
NADPH氧化酶在各个组织中主要存在7种NOX的同功酶[9],主要包括NOX1~NOX5,DOU X1~X2,而NOX4是存在于缺血再灌注心肌细胞中的NADPH 氧化酶亚基的主要类型。当NOX4 活性显著增强时,胞内ROS水平显著升高,导致心肌受损坏死,心脏纤维化面积增大,从而提示NOX4 源性的ROS可通过诱导氧化应激和炎症反应参与心肌缺血再灌注损伤的过程[9-10]。同时,NF-κB 通路在调控氧化应激和炎症损伤中也起重要作用。NF-κB家族有5个主要成员,分别为P50、P52、P65、c-Rel和RelB。这些转录因子在非激活状态时主要位于细胞质,与其抑制蛋白IκBs(IκBα、IκBβ、IκBε)结合形成无活性的三聚体存在细胞中;当受到内外因素刺激时,可激活IκB 激酶(IKK),促使IκB 磷酸化,并被迅速降解,使NF-κB 通路被激活,并进入细胞核与靶基因中相应的DNA 结合位点结合,随后启动靶基因转录[19,21]。特别需要注意的是,NOX4/ROS/NF-κB信号通路不仅仅是单向进行的。在NOX4/ROS/NF-κB信号通路中,心肌缺血再灌注时,各种炎症刺激NOX4的表达并产生大量胞内ROS,同时促使IKK 激活,促进IκB 磷酸化降解而活化NF-κB,而NF-κB的活化将会上调表达大量炎症因子,进而又会反过来继续刺激NOX4的表达及诱发产生更多的ROS 加剧氧化应激损伤,形成NOX4/ROS/NF-κB 正反馈信号环,对心肌造成持续性、不可逆性的损害。
目前抗血小板药物主要由TXA2 抑制剂、P2Y12受体拮抗剂以及GPII b/Ⅲa 受体抑制剂、PDEs 抑制剂等组成。噻吩吡啶类如氯吡格雷等药物主要在血小板寿命期间不可逆地与P2Y12受体结合,与氯吡格雷不同,替格瑞洛可逆地与受体结合并表现出快速起效[11]。除了抗血小板作用外,目前的文献报道替格瑞洛能改善缺血再灌注后心肌的损伤[13],主要是通过调节血中的腺苷的水平而发挥作用[22-23]。张凤等[24]研究纳入125例计划接受急诊PCI的STEMI患者,随机给予替格瑞洛或氯吡格雷治疗。在PCI术前、术后等不同时间点测定Angptl 2(血清血管生成素样蛋白2)水平。分析结果提示,替格瑞洛较氯吡格雷有更强降低炎性因子Angptl 2 水平,提高动脉粥样硬化斑块的稳定性。
本研究利用大鼠构建心肌缺血再灌注损伤模型,深入探讨替格瑞洛的保护作用及相关分子机制。通过术前药物灌胃处理,术后采集内眦血和心脏标本进行检测,发现替格瑞洛更能降低IL-1β、IL-6、TNF-α炎症水平(P<0.05)以及氧化应激相关因子NOX4的表达水平(P<0.05);同时总抗氧化能力提高和心肌纤维化程度减轻,说明替格瑞洛对缺血再灌注损伤有抗氧化应激、抗炎的作用。另外,使用替格瑞洛能降低的NF-κB信号通路相关激活因子Phospho-IKK、NF-κB p65 等的表达水平(P<0.05),相反NF-κB信号通路相关抑制因子IκB的降解减少(P<0.01),由此看出缺血再灌注损伤后的氧化应激和炎症反应可以诱导NF-κB信号通路的活化,同时替格瑞洛可以通过降低NOX4的过表达,进而减少ROS 生成,抑制IKK的激活,减少IκB的降解,最终将抑制NF-κB信号通路的活化,减轻炎症反应。
受到各种因素的影响,本实验仍存在许多不足的地方。由于大鼠的动物模型机体内环境复杂,实验结果可能收到多种混杂因子和不同的刺激因素交织影响,今后需在体外实验进一步验证替格瑞洛在缺血再灌注损伤的保护机制,同时需进行大样本的临床研究,在人体中证实其抗氧化应激、抗炎、减轻缺血再灌注损伤的作用。
冠脉介入手术联合替格瑞洛能够有效抗氧化应激、抗炎、减轻缺血再灌注损伤,减少术后不良事件,这使得STEMI患者大大获益。

