高迁移率族蛋白1、乳酸及降钙素原对脓毒症患者病情及预后评估价值研究
罗钰填,吕常艳,刘振密,刘雪燕
深圳市人民医院 重症医学科,广东 深圳 518000
脓毒症是感染引起的全身炎症反应综合征,各种病原体感染致体内炎症水平失控,引起器官结构和功能的损伤,其病情进展迅速,如不及时干预会发展为严重脓毒症、脓毒性休克和多器官功能障碍综合征,甚至死亡[1]。脓毒症的病死率均较高,随着抗感染治疗及重症监护病房的规范,其病死率得以控制,但并未明显下降[2]。因此,准确评估患者病情及预后对脓毒症的治疗有重要的临床意义。目前,危重病患者病情评估主要采用急性生理学及慢性健康状况评分Ⅱ(acute physiology and chronic health status scoring system,APACHEⅡ)、序贯器官衰竭评估等[3]。有研究发现,一些炎症相关因子如降钙素原(procalcitonin,PCT)、高迁移率族蛋白1(high mobility group protein 1,HMGB1)、乳酸(lactic acid,LAC)、超敏 C 反应蛋白等在成年脓毒症患者的早期诊断中具有一定的价值[4-6],但这些指标对于患者预后评估的研究不足。因此,本研究旨在探讨血HMGB1、LAC及PCT水平对脓毒症患者病情严重程度及28 d预后的评估价值。现报道如下。
1 资料与方法
1.1 一般资料 选取深圳市人民医院重症医学科自2017年1月至2019年1月收治的86例脓毒症患者为研究对象。根据患者病情的严重程度[7]分为脓毒症组(n=65)和脓毒症休克组(n=21)。脓毒症组:男性41例,女性24例;年龄38~85岁,平均年龄(61.83±12.16)岁;体质量指数(body mass index,BMI)为(22.34±2.25)kg/m2。脓毒症休克组:男性14例,女性7例;年龄42~83岁,平均年龄(63.19±14.29)岁;BMI(22.16±1.73)kg/m2。两组患者在年龄、性别、BMI等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。根据患者入院28 d的生存结局分为存活组(n=64)与死亡组(n=22)。存活组:男性40例,女性24例;年龄41~85岁,平均年龄(62.43±10.72)岁;BMI(22.32±2.51)kg/m2。死亡组:男性15例,女性7例;年龄38~83岁,平均年龄(62.91±12.47)岁;BMI(21.39±2.28)kg/m2。两组患者在年龄、性别比例等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者及家属均签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)符合2016年美国重症医学会与欧洲重症医学会制定的脓毒症诊断标准[7];(2)年龄>18岁;(3)急诊重症医学科(intensive care unit,ICU)住院时间>3 d。排除标准:(1)确诊脓毒症至转入ICU≤24 h;(2)心源性休克;(3)合并恶性肿瘤、自身免疫性疾病等;(4)活动性大出血;(5)存在其他影响血HMGB1、LAC及PCT水平的因素;(6)妊娠、哺乳期妇女。
1.3 研究方法 HMGB1、LAC及PCT水平的检测:患者于清晨空腹抽取外周静脉血5 ml,分别分离其血浆和血清,采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测血清HMGB1、PCT水平,ELISA试剂盒购自上海恒斐生物科技有限公司,严格按照试剂盒说明书步骤进行操作。应用全自动生化分析仪(贝克曼奥林巴斯,型号:AU680)检测血浆LAC水平,试剂盒购自上海恒斐生物科技有限公司。患者入院24 h内,收集患者的一般资料(年龄、性别、病因、体温、感染部位等),采用APACHE Ⅱ评估患者疾病的危重情况[8]。随访观察患者入院28 d转归情况,每4 d随访1次,记录患者存活或死亡情况。

2 结果
2.1 不同严重程度患者血清HMGB1、PCT及血浆LAC水平的比较 脓毒症休克组患者HMGB1、LAC、PCT水平及APACHEⅡ评分均明显高于脓毒症组,两组间比较,差异有统计学意义(P<0.05)。见表1。
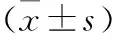
表1 不同严重程度患者血清HMGB1、PCT及血浆LAC水平的比较
2.2 血清HMGB1、PCT、血浆LAC与APACHEⅡ评分的相关性分析 Pearson相关分析显示,患者血清HMGB1、PCT及血浆LAC分别与APACHEⅡ评分呈正相关(r=0.416、0.527、0.459,P=0.011、P<0.001、P=0.006)。
2.3 不同预后患者血清HMGB1、PCT及血浆LAC水平的比较 死亡组患者HMGB1、LAC及PCT水平明显高于存活组,两组间比较,差异有统计学意义(P<0.05)。见表2。
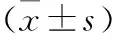
表2 不同预后患者血清HMGB1、PCT及血浆LAC水平的比较
2.4 血清HMGB1、PCT及血浆LAC对患者预后的评估价值 采用ROC分析HMGB1、LAC及PCT水平对患者28 d预后情况的评估价值,并计算AUC值。见表3、图1。HMGB1、LAC及PCT水平的AUC分别为0.759、0.800、0.764;当HMGB1≥1.12 μg/L时,灵敏度为68.20%,特异度为79.70%;当LAC≥3.27 mmol/L时,灵敏度为54.50%,特异度为93.70%;当PCT≥12.93 ng/ml时,灵敏度为72.70%,特异度为76.60%。联合上述指标检测AUC为0.954,灵敏度为86.40%,特异度为92.20%。
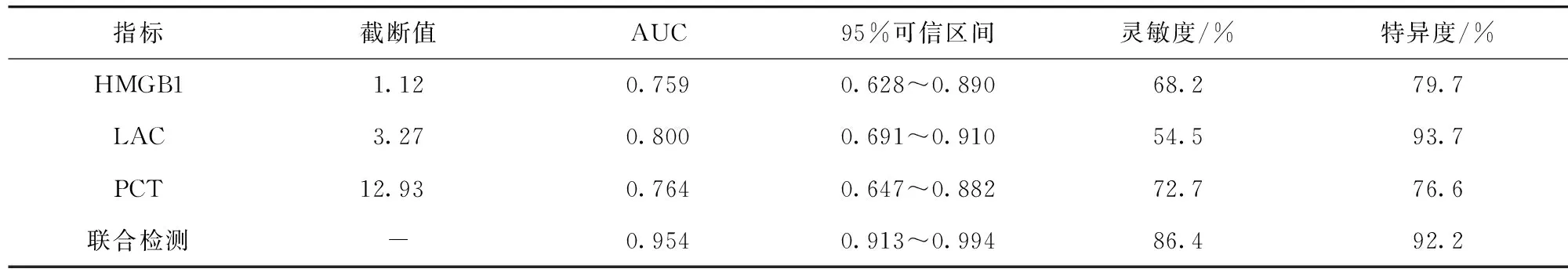
表3 血清HMGB1、PCT及血浆LAC对患者预后的评估价值
3 讨论
脓毒症的病理过程复杂,涉及大量基因、细胞及因子,但有研究表明,病原体通过过度活化天然免疫细胞,释放大量促炎因子和趋化因子,从而导致脓毒症的发生[9]。随着分子生物技术的发展,多种生物标志物被证实在脓毒症的早期诊断、病情及预后判断中有重要的临床意义,如PCT、白介素、HMGB1、LAC等[10-12]。APACHEⅡ评分是主要用于评估ICU患者疾病严重程度及生存状况的指标,同样适用于脓毒症患者,但因该评分的计算需要多项数据,在急诊脓毒症患者的应用中有一定的局限性[13]。HMGB1是一种细胞核非组蛋白,在真核细胞中广泛表达,其通过与DNA相互作用参与基因的转录、表达、修复及细胞运动等过程。当细胞受刺激时,会释放大量的HMGB1,加速炎症反应的发生;同时,促炎因子会正反馈性诱导HMGB1的分泌,从而造成机体持久、失控的全身炎性反应,促进脓毒症的发生发展[14]。崔文娟等[15]的研究发现,HMGB1在脓毒症及相关的急性肾损伤中有重要的诊断及预后评估价值。LAC是葡萄糖的无氧代谢产物,当组织出现低灌注、缺氧时,如果肝等器官无法完全代谢LAC时,其容易在体内堆积,出现高LAC血症,其水平可以反映脓毒症患者组织的灌注能力[16]。有研究发现,脓毒症患者由于有效循环不足,尤其是脓毒症休克患者,其血LAC水平大幅升高,但经改善微循环治疗后,LAC可逐渐下降,因此,LAC可用于脓毒症患者病情评估和预后预测[17]。PCT是甲状腺C细胞分泌的降钙素前肽物质,其在细菌性感染疾病中急剧升高,而在其他病原体感染中仅轻度升高,已广泛应用于脓毒症的诊断及病原体鉴别诊断。另外,有研究表明,PCT可作为脓毒症预后评估的一种生物学标志,指导抗生素的合理应用。Poddar等[18]研究发现,脓毒症患者在病发前3 d,血清PCT水平呈下降趋势,其28 d预后良好。
本研究结果显示,不同病情严重程度的脓毒症患者血清HMGB1、PCT及血浆LAC比较,差异有统计学意义(P>0.05),这提示,血HMGB1、LAC及PCT对脓毒症患者的病情有一定的判断作用,与文献报道结果相似[19]。相关性分析结果显示,血清HMGB1、PCT及血浆LAC水平分别与APACHEⅡ评分呈正相关,这进一步表明,HMGB1、LAC及PCT水平与脓毒症患者的危重程度紧密相关。另外,血HMGB1、LAC及PCT对脓毒症患者28 d预后有一定的预测价值。但单一的指标不足以准确描述脓毒症患者的预后情况,需要联合检测以增加对脓毒症预测的灵敏性。本研究结果显示,HMGB1、LAC及PCT联合检测在脓毒症患者预后评估中具有较高的应用价值,可以利用上述指标划分不同危险程度的脓毒症患者,有助于优化个体化的抗感染策略,以改善患者预后。
综上所述,血清HMGB1、PCT及血浆LAC均可评估患者脓毒症病情的严重程度及28 d预后,但联合检测的应用价值更高,这为患者的临床诊治提供新方向。但本研究尚存在一些不足之处:(1)本研究未动态监测患者入院后HMGB1、LAC及PCT水平的变化;(2)本研究为单中心研究,且纳入的样本量较少,今后的工作中还需进一步验证HMGB1、LAC及PCT的评估效果。

