短链脂肪酸对奶牛瘤胃上皮细胞促炎因子、趋化因子和紧密连接蛋白表达量的影响
邓波波,冯宝宝,詹康,霍永久,赵国琦
(扬州大学动物科学与技术学院,江苏 扬州 225009)
瘤胃是反刍动物消化系统最重要结构之一,动物食入的植物性饲料在瘤胃内发酵成短链脂肪酸(short chain fatty acid,SCFA)来调节瘤胃的多种生理功能.瘤胃生理功能的正常运行离不开健全的屏障保护作用,瘤胃保护屏障由微生物屏障、物理屏障和免疫屏障组成.微生物屏障是依据瘤胃中微生物间共生、拮抗、竞争等方式来维持菌群平衡,抑制有害菌毒素的过度分泌;物理屏障是通过上皮细胞之间的紧密连接结构,阻止毒素和病原体从瘤胃上皮进入血液;免疫屏障是由肠相关的免疫细胞及分泌的细胞免疫因子组成[1].到目前为止,从瘤胃微生态环境因素到宿主本身的生理条件,已经有很多因素被报道与这些屏障功能有关.其中短链脂肪酸最受关注,短链脂肪酸包括乙酸盐、丙酸盐和丁酸盐,瘤胃上皮细胞可吸收50%~80%的短链脂肪酸,并有报道称短链脂肪酸可影响瘤胃物理屏障和免疫屏障功能,如影响瘤胃上皮的完整性、瘤胃上皮生长、紧密连接的表达以及瘤胃上皮炎症因子的调节等[2].瘤胃内注射SCFAs可促进幼龄反刍动物瘤胃乳头的发育[3].此外,SCFAs还可以刺激交感神经系统的激活,促进机体能量的消耗,减少脂肪的合成等[4].已有研究表明,G蛋白偶联受体41(G protein-coupled receptor 41,GPR41)和G蛋白偶联受体43(G protein-coupled receptor 43,GPR43)是人体短链脂肪酸的受体[5-7].GPR41 mRNA广泛表达于胰脏、脾脏、淋巴结等组织器官中,在脂肪组织中更是尤为普遍[8].GPR41/43在胃肠道黏膜和内分泌细胞中均有表达,这表明GPR41/43可能参与免疫炎症反应的发生和发展.目前的研究中,主要是GPR41和GPR43对人和小鼠炎症反应的调控[7,15],SCFA可诱导GPR43的表达,促进小鼠骨髓中性粒细胞的趋化[9].小鼠体内注射乙醇可诱导发生结肠炎症,而小鼠在丢失了GPR41和GPR43基因的条件下,肠道白介素1β(Interleukin-1β,IL-1β)和白介素-12(Interleukin -12,IL-12)的表达量显著降低[10].以此可以得出,GPR41和GPR43的激活可以增强促炎因子的高表达.目前,GPR41和GPR43已在奶牛的不同组织中被鉴定[11].但本实验室建立的永生化奶牛瘤胃上皮细胞系不能表达GPR43,只能表达GPR41.并且,科研研究中关于SCFA用于调节瘤胃上皮先天免疫的分子机制研究较少,我们推测SCFA调节奶牛瘤胃上皮细胞炎症反应与GPR41的介导有关.
本试验在永生化的瘤胃上皮细胞中添加20 mmol/L的短链脂肪酸,观察随着吸收时间的延长瘤胃上皮细胞中GPR41、促炎因子IL-1β、趋化因子2(CXCL2)、趋化因子3(CXCL3)、趋化因子8(CXCL8)、趋化因子20(CCL20)和紧密连接蛋白ZO-1、Occludin、Claudin-1表达量的变化趋势,为系统的研究SCFAs调节瘤胃上皮免疫机制奠定基础.
1 材料与方法
1.1 试验材料

1.2 试验方法
1.2.1 试验设计 试验分为4组,在瘤胃上皮细胞中添加20 mmol/L SCFAs ,0、2、5、8 h时收集细胞,提取总RNA.试验中乙酸、丙酸和丁酸的摩尔比为15∶5∶3.20 mmol/L SCFAs由12 mmol/L乙酸钠、5 mmol/L丙酸钠和3 mmol/L丁酸钠组成.
1.2.2 总RNA提取 在奶牛瘤胃上皮细胞中添加SCFAs,分别在0、2、5、8 h后收集细胞,提取各组细胞RNA.弃掉培养基,每孔中加入1 mL的细胞裂解液,静置5 min,将裂解好的细胞液转移至无酶离心管中;在裂解液中加200 μL的三氯甲烷,闭盖,混旋10 s,静置3 min;4 ℃ 12 000 r/minm离心10 min,吸取最上层水相,将其转移到全新无酶离心管中;加入0.5倍体积的无水乙醇,混匀,将溶液全部转移至吸附柱中,4 ℃ 12 000 r/min离心45 s;弃废液;加入去蛋白液RD 500 μL,4 ℃ 12 000 r/min离心45 s,弃废液;再加入漂洗液RW 500 μL,静置2 min,4 ℃ 12 000 r/min离心45 s,弃废液;重复上述步骤;将吸附柱放回收集管,4 ℃ 12 000 r/min离心2 min;弃废液,打开盖子室温静置15 min,彻底去除残余的有机液体;将吸附柱放置新的1.5 mL无酶离心管中,加30 μL无酶水,静置2 min,4 ℃ 12 000 r/min离心2 min.测定总RNA的浓度和纯度.
1.2.3 反转录成cDNA 本试验使用Takara反转录试剂盒将样品总RNA反转录成cDNA,所有操作依据Takara反转录试剂盒说明书进行.
1.2.4 引物设计与合成 根据NCBI数据库中收录的奶牛IL-1β、CXCL8、CCL20、CXCL2、CXCL3、Claudin-1、ZO-1、Occludin、GPR41和GAPDH的mRNA序列,采用Primer Premier 6.0软件进行引物设计,引物序列及扩增产物大小见表1.引物由苏州金唯智生物科技有限公司合成.

1.3 数据处理
运用统计软件SPSS 19.0进行统计分析.One-Way ANOVA程序进行单因素方差分析,显著性检验应用LSD法.
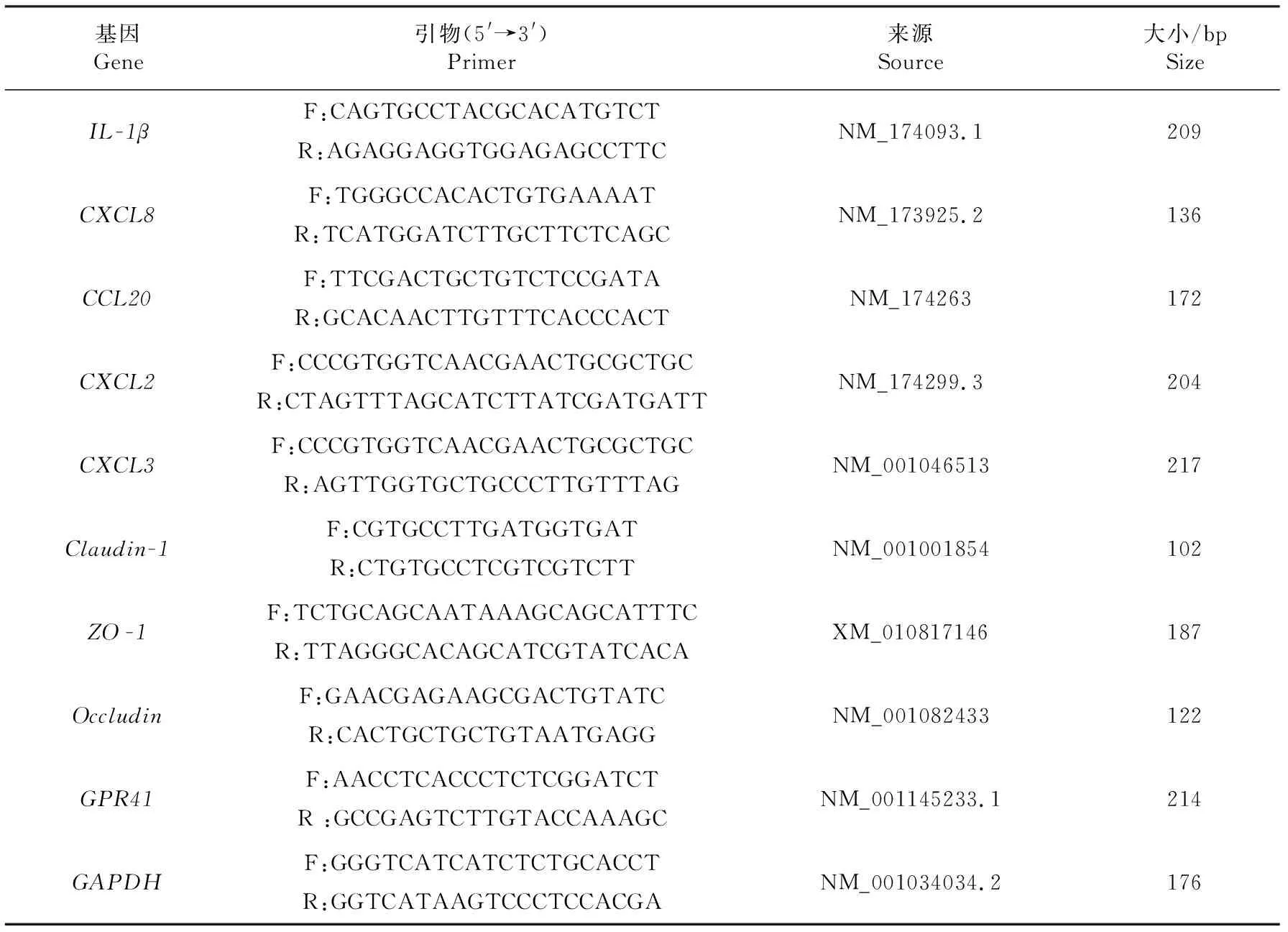
表1 荧光定量PCR引物
2 结果与分析
2.1 添加SCFAs后对奶牛瘤胃上皮细胞GPR41表达的影响
在奶牛瘤胃上皮细胞中添加20 mmol/L的SCFAs,以不同时间点收集的细胞cDNA为模板,进行qPCR分析.如图1所示,8 h后GPR41的表达量显著高于0、2、5 h时的表达量(P<0.05).

图1 SCFA对奶牛瘤胃上皮细胞GPR41表达的影响Figure 1 Effects of SCFA on expression of GPR41 in BRECs
2.2 添加SCFAs后对奶牛瘤胃上皮细胞促炎因子和趋化因子表达的影响
免疫因子和趋化因子的表达量可反映上皮细胞免疫机能的强弱,瘤胃上皮细胞中添加20 mmol/LSCFAs,不同时间点对免疫机能的影响见下图,由图2可知,添加20 mmol/L的SCFAs,2 h时IL-1β的表达量显著上升,显著高于0 h时(P<0.05),在8 h时达到最高.由图3和图5可知,添加20 mmol/L SCFAs 5 h时,CXCL2和CXCL8的表达量显著高于0 h组(P<0.05),且在整组中表达量最高;CXCL8、CCL20的表达量在5 h时最高,但到了8 h时表达量显著降低(P<0.05).由图4可知,CXCL3的表达量随着时间点的增加表达量逐渐升高,但未达到显著水平(P>0.05).

图2 SCFA对奶牛瘤胃上皮细胞IL-1β表达的影响Figure 2 Effects of SCFA on expression of IL-1β in BRECs
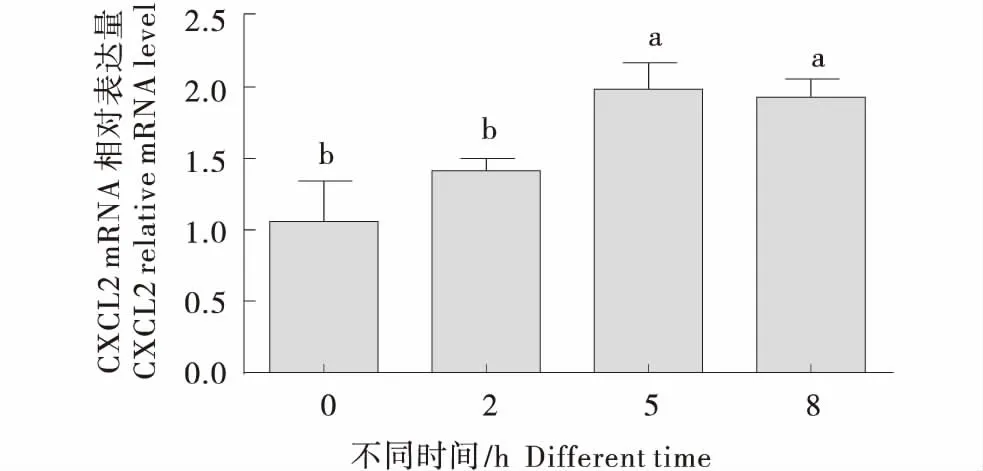
图3 SCFA对奶牛瘤胃上皮细胞CXCL2表达的影响Figure 3 Effects of SCFA on expression of CXCL2 in BRECs
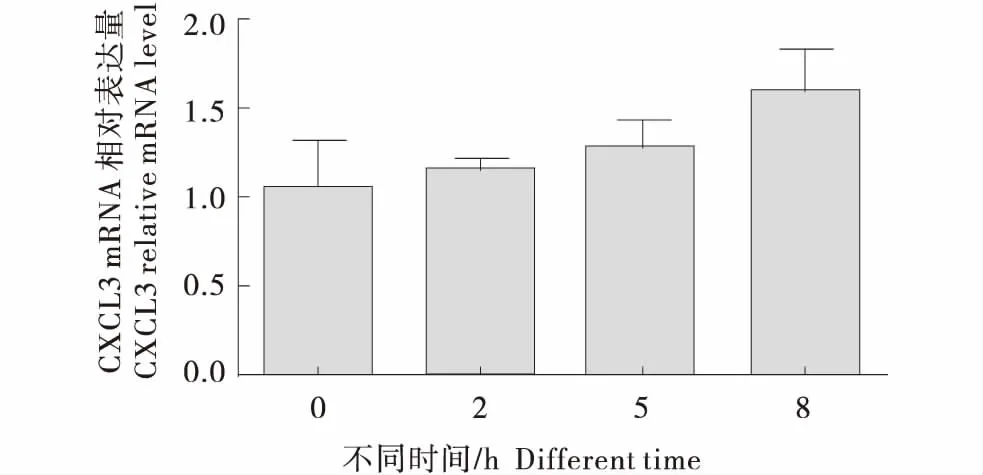
图4 SCFA对奶牛瘤胃上皮细胞CXCL3表达的影响Figure 4 Effects of SCFA on expression of CXCL3 in BRECs

图6 SCFA对奶牛瘤胃上皮细胞CCL20表达的影响Figure 6 Effects of SCFA on expression of CCL20 in BRECs
2.3 添加SCFAs后对奶牛瘤胃上皮细胞紧密连接蛋白表达的影响
瘤胃上皮细胞中添加SCFA,对紧密连接蛋白ZO-1、Claudin-1和Occludin表达量的影响见下图.由图7可知,添加20 mmol/L SCFAs ZO-1的表达量在8 h时达到最高,但没有达到显著水平(P>0.05).由图8、9可知,添加20 mmol/L SCFAs 2 h时Claudin-1和Occludin的表达量显著高于0 h时(P<0.05),而在5、8 h时,Claudin-1和Occludin的表达量逐渐降低,但均显著高于0 h(P<0.05).

图7 SCFA对奶牛瘤胃上皮细胞ZO-1表达的影响Figure 7 Effects of SCFA on expression of ZO-1 in BRECs

图8 SCFA对奶牛瘤胃上皮细胞Claudin表达的影响Figure 8 Effects of SCFA on expression of Claudin in BRECs
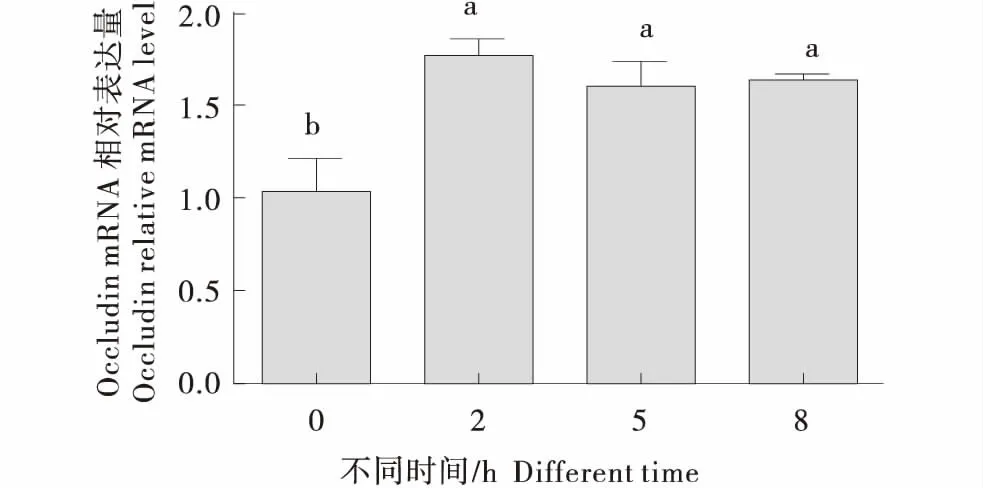
图9 SCFA对奶牛瘤胃上皮细胞Occludin表达的影响Figure 9 Effects of SCFA on expression of Occludin in BRECs
3 讨论
反刍动物瘤胃发酵的重要产物是短链脂肪酸,它可调节瘤胃发育、胰岛素和胰高血糖素分泌以及参与一些重要的生理过程[4].肠道微生物可以积极的调节免疫反应预防肠道炎症疾病的发生[12-13].患有结肠炎的病人常常伴随SCFAs的显著减少[10].短链脂肪酸是反刍动物瘤胃微生物降解日粮中碳水化合物所产生的有机酸[14].因此,我们推断肠道微生物能够积极的调节免疫反应可能与微生物发酵产生的SCFAs有关.参与免疫调节代谢产物的SCFAs可激活GPR41受体.前人已证明,GPR41和GPR43是短链脂肪酸的受体[5-6],这表明GPR41和GPR43作为受体可能同样介导SCFAs调控瘤胃上皮炎症的反应.有研究显示,瘤胃上皮中GPR41表达量下降,会导致瘤胃上皮屏障的损伤和炎症反应的发生[15].一旦瘤胃上皮通透性增加,瘤胃内的脂多糖和细菌裂解物就有机会转移到血液中,导致全身出现炎症反应[16].本试验在奶牛瘤胃上皮细胞中添加了20 mmol/L的SCFAs,8 h后GPR41的表达量显著升高,再次验证了SCFAs和GPR41之间的相互作用关系.并且本研究发现加入SCFAs 8 h后GPR41表达量显著升高,同时IL-1β的表达量也在添加SCFAs 8 h后达到了最高水平,IL-1β在促进中性粒细胞的招募和抵抗金黄色葡萄球菌的感染中扮演十分重要的作用.有研究报道称,小鼠体内GPR41表达量降低可导致促炎因子IL-1β、IL-6、IL-11的表达量降低,并且缺乏GPR41会下调小鼠肠道炎症介质相关基因的表达[17].细胞中的趋化因子同样是瘤胃上皮免疫屏障的重要组成部分,趋化因子可以趋化免疫细胞如巨噬细胞和中性粒细胞到达组织受感染的部位,进行免疫应答来处理异物产生的抗原.奶牛在饲喂高精料的日粮时,可有效提高奶牛的产奶量.于此同时,瘤胃微生物对日粮纤维进行发酵产生大量有机酸,降低了瘤胃中的pH,破坏革兰氏阴性菌并释放游离脂多糖,从而引发瘤胃上皮组织的炎症反应,导致反刍动物出现拉稀的症状.饲喂高精料日粮虽会产生大量SCFAs,但也会增强瘤胃上皮GPR41的表达量,CCL型和CXCL型趋化因子表达量上调,促使更多的免疫细胞到达瘤胃上皮层,对瘤胃上皮形成保护性免疫应答.有研究表明,机体组织GPR41的表达量与CCL20、CXCL2、CXCL3、CXCL8以及CXCL14 mRNA的表达量始终呈正相关[15].在敲除了GPR41基因的小鼠中,肠组织中CCL和CXCL型趋化因子的基因表达量显著降低,并导致中性粒细胞浸润异常减少[17].本试验中添加了20 mmol/L 的SCFAs 8 h时,GPR41的表达量显著高于0 h,并且CXCL2、CXCL3和CXCL8的表达量也显著升高,说明添加短链脂肪酸通过GPR41的介导可在一定程度上可以增强瘤胃上皮细胞的免疫机能.
瘤胃上皮细胞的连接方式主要分为紧密连接、桥粒连接、黏着连接和间隙连接,而紧密连接形式是细胞间最重要的连接方式[18],它是防止有害物质跨越上皮组织转运的关键结构.胃肠中的这种紧密连接形式主要位于颗粒层细胞之间,是形成胃肠黏膜保护屏障的基础结构,也是决定细胞间通透性大小的主要因素.大量的研究表明,紧密连接蛋白基因的表达和分布与多种上皮疾病有关[19].病理状态下,紧密连接屏障被破坏,细胞间隙增大,细菌、病毒等大分子物质趁机进入,黏膜的屏障功能减弱甚至消失.当上皮组织紧密连接结构发生变异、减少或缺失时,该组织的紧密连接再分配和基因表达便会下调,致使上皮细胞受损,屏障功能丧失,进而使上皮细胞通透性增加[20],如在肠炎时,屏障功能受损过多的水分进入肠腔,造成腹泻或更严重后果,这都是基于上皮组织紧密连接结构的改变和紧密连接蛋白复杂性的降低造成的[21].本试验在瘤胃上皮细胞中添加20 mmol/L的短链脂肪酸,2 h后Claudin-1和Occludin的表达量显著高于0 h时,而在5 h后Claudin-1和Occludin的表达量有所降低,但表达量仍显著高于0 h时,说明在瘤胃上皮细胞中添加短链脂肪酸短时间内便可以增加紧密连接蛋白的表达量.Tong等研究发现,丙酸和丁酸等可以增加肠上皮细胞紧密连接蛋白ZO-1和Occludin蛋白的表达量,或通过增加AMP-激活蛋白激酶的活性,加速紧密连接组装,从而加强细胞间的紧密连接结构,抑制肠道通透性,增强屏障防御机能[22-23].Claudin蛋白是上皮细胞紧密连接结构中最主要的功能分子,它维持着紧密连接特有的屏障特性,严格控制微生物和毒性大分子通过,以此来保持组织内部的稳态.Occludin蛋白是构成紧密连接结构的功能分子之一,但它不是此结构必需的蛋白[24],它的存在影响Clauddin蛋白的表达,使其更好的形成完整的紧密连接,来履行紧密连接特有的栅栏功能和屏障功能.所以从试验结果看短链脂肪酸是可以增强瘤胃上皮细胞紧密连接蛋白的表达量,对瘤胃上皮免疫屏障的形成起着积极促进作用.
4 结论
瘤胃上皮细胞吸收短链脂肪酸后,可以上调GPR41的表达量,提高促炎因子IL-1β和趋化因子的表达量,并且瘤胃上皮细胞中紧密连接蛋白的表达量也显著升高.炎症因子、趋化因子、紧密连接蛋白表达量都有所上调,说明短链脂肪酸能够增强瘤胃上皮的免疫屏障功能.

