紫檀芪对胃癌细胞增殖和凋亡的影响及机制研究
何鹏展, 马静静, 刘颖慧, 邓 欢, 董卫国
武汉大学人民医院 1.消化内科; 2.中心实验室; 3.老年病科,湖北 武汉 430060
胃癌是最常见的胃肠道恶性肿瘤之一,也是全球癌症患者死亡的第三大原因。2018年全球新发胃癌病例估计超过100万例,居全球恶性肿瘤发病率第五位;死亡率仅次于肺癌和肝癌[1]。在我国,胃癌的发病率和死亡率有所下降,但它仍是严重危害人民健康的重要因素[2]。目前,手术、放化疗是胃癌的主要治疗方法[3]。约70%的胃癌患者确诊时已处于晚期,这明显限制了手术和放化疗的疗效[4]。传统的化疗药物,如顺铂和5-氟尿嘧啶,由于耐药性和细胞毒性而临床疗效不佳。因此,有必要寻找低毒、高效的天然抗癌药物。
紫檀芪是白藜芦醇的天然二甲基化类似物,主要存在于蓝莓和葡萄中。紫檀芪与白藜芦醇具有相似的药理作用,如抗癌、抗氧化、降血脂、降血糖及对中枢神经系统和心血管疾病的有益作用[5]。且由于有两个甲氧基,紫檀芪比白藜芦醇生物利用度更高,半衰期更长[6]。以往研究发现,紫檀芪对多种肿瘤均有一定的治疗作用,如乳腺癌、前列腺癌、结肠癌等[7-9],但对胃癌作用尚不十分明确。因此,本研究探讨了紫檀芪对胃癌细胞增殖和凋亡的影响及其相关机制。
1 材料与方法
1.1 实验材料人胃癌细胞株HGC-27、SGC-7901、MGC-803和胃黏膜上皮细胞GES-1(中国典型培养物保藏中心CCTCC);紫檀芪(美国Selleck公司);胎牛血清(美国Gibco公司);DMEM/F12培养基(美国HyClone公司);青霉素、链霉素、CCK-8试剂盒、Hoechst 33258染色试剂盒、活性氧(ROS)检测试剂盒、BCA蛋白定量试剂盒(上海碧云天公司);Transwell小室(美国Corning公司);基质胶、Annexin V-PE/7-AAD细胞凋亡检测试剂盒(美国BD公司);AIF、Bax、Bcl-2、CytC、Survivin、cleaved caspase-3、cleaved caspase-9、MMP-9、MMP-2兔单克隆抗体(美国Cell Signaling Technology公司)。
1.2 实验方法
1.2.1 细胞培养和分组:人胃癌细胞株(HGC-27、SGC-7901、MGC-803)和胃黏膜上皮细胞(GES-1)在质量浓度为100 g/L胎牛血清、1%抗生素溶液(青霉素100 U/ml和链霉素100 g/ml)的DMEM/F12培养基,37 ℃、体积分数为5%的CO2加湿培养箱中培养。均选用处于对数生长期的细胞进行实验。分为紫檀芪处理组和阴性对照组,阴性对照组加入同浓度的DMSO。
1.2.2 细胞增殖实验:用CCK-8试剂盒检测细胞活力。将细胞(5×103个/孔)接种在96孔培养板中,第2天更换上清液,在含有紫檀芪(0、20、40、60、80、120、160 μmol/L)的新鲜培养基中培养12、24、48 h。每孔加入CCK-8溶液10 μl,再孵育2 h,用酶标仪测定450 nm处的吸光度。以质量浓度为100 g/L的CCK-8 DMEM/F12为对照。
1.2.3 细胞划痕实验:将胃癌细胞接种于含新鲜培养基的6孔板(1×105个/孔),培养24 h,待细胞密度为80%~90%时,用200 μl吸管尖端直尺划痕,用PBS冲洗细胞,去掉漂浮细胞,加入无血清培养基,立即拍摄照片(0 h)。随后,细胞在添加质量浓度为30 g/L胎牛血清和不同浓度的紫檀芪(0、20、40、80 μmol/L)的DMEM/F12培养基中培养,并在24 h和48 h拍摄照片。
1.2.4 Transwell实验:胰酶消化胃癌细胞,用质量浓度为100 g/L胎牛血清的培养基重悬后将100 μl的细胞悬液(约1×104)接种于Transwell小室的上层,预先在小室上层铺有基质胶(按1∶6稀释)。下层加入质量浓度为250 g/L胎牛血清的600 μl培养基。次日,更换含有紫檀芪(0、20、40、80 μmol/L)的下层培养基再培养24 h后,将小室用4%多聚甲醛溶液固定15 min,用质量浓度为10 g/L结晶紫染色。
1.2.5 Hoechst 33258荧光染色法:将指数生长的胃癌细胞种植于6孔板,培养24 h。用含有紫檀芪(0、20、40、80 μmol/L)的新鲜培养基培养24 h,然后固定细胞,用PBS冲洗3次,按照说明书用Hoechst 33258染色液染色。在荧光显微镜下观察和捕捉细胞凋亡的形态学特征,如染色质凝集和核碎裂。
1.2.6 Annexin V-PE/7-AAD双染流式细胞术:将细胞接种到6孔板中,培养24 h,并暴露于上述不同浓度紫檀芪中。收集贴壁细胞,用PBS洗涤2次,最后将细胞重悬于结合缓冲液中,5 μl Annexin V-PE和10 μl 7-AAD在黑暗中共染色15 min,然后用流式细胞仪分析。
1.2.7 DCFH-DA荧光探针测定ROS:将细胞接种于6孔培养板,培养24 h后用上述不同浓度的紫檀芪再培养24 h。胃癌细胞在含10 μmol/L DCFH-DA的1 ml培养基中37 ℃培养30 min,用PBS洗涤3次。然后用荧光显微镜观测。
1.2.8 Western blotting实验:经上述紫檀芪处理后,提取细胞总蛋白,测定蛋白浓度。蛋白质经SDS-PAGE电泳分离后,转膜,含质量浓度为50 g/L的脱脂牛奶TBST中室温封闭1 h,TBST清洗3次。随后一抗4 ℃下孵育过夜,TBST清洗3次后,在室温黑暗中二抗孵育1 h,再用TBST洗涤3次,最后用Odyssey红外荧光扫描成像系统扫描。

2 结果
2.1 紫檀芪抑制胃癌细胞的增殖CCK-8实验结果显示,紫檀芪能抑制胃癌细胞的增殖,且呈时间和剂量依赖性。而在正常胃黏膜上皮细胞GES-1中,紫檀芪对其增殖的抑制作用较弱(见图1)。此外,可观察到在3株胃癌细胞系中,HGC-27对紫檀芪最敏感,因此选HGC-27进行以下的实验。
2.2 紫檀芪抑制胃癌细胞的迁移与侵袭划痕实验和Transwell实验结果表明,紫檀芪对胃癌细胞的迁移与侵袭均有抑制作用,呈剂量依赖性,与对照组比较,差异有统计学意义(P<0.05)(见图2)。同时,与肿瘤侵袭性相关蛋白MMP-2、MMP-9在紫檀芪作用下明显减少(P<0.05)(见图3)。
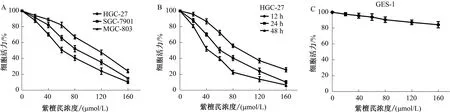
图1 紫檀芪对胃癌细胞和GES-1细胞增殖的影响 A:不同浓度的紫檀芪处理胃癌细胞(HGC-27、SGC-7901、MGC-803)24 h;B:不同浓度的紫檀芪处理HGC-27细胞12、24和48 h;C:不同浓度的紫檀芪对GES-1细胞的影响
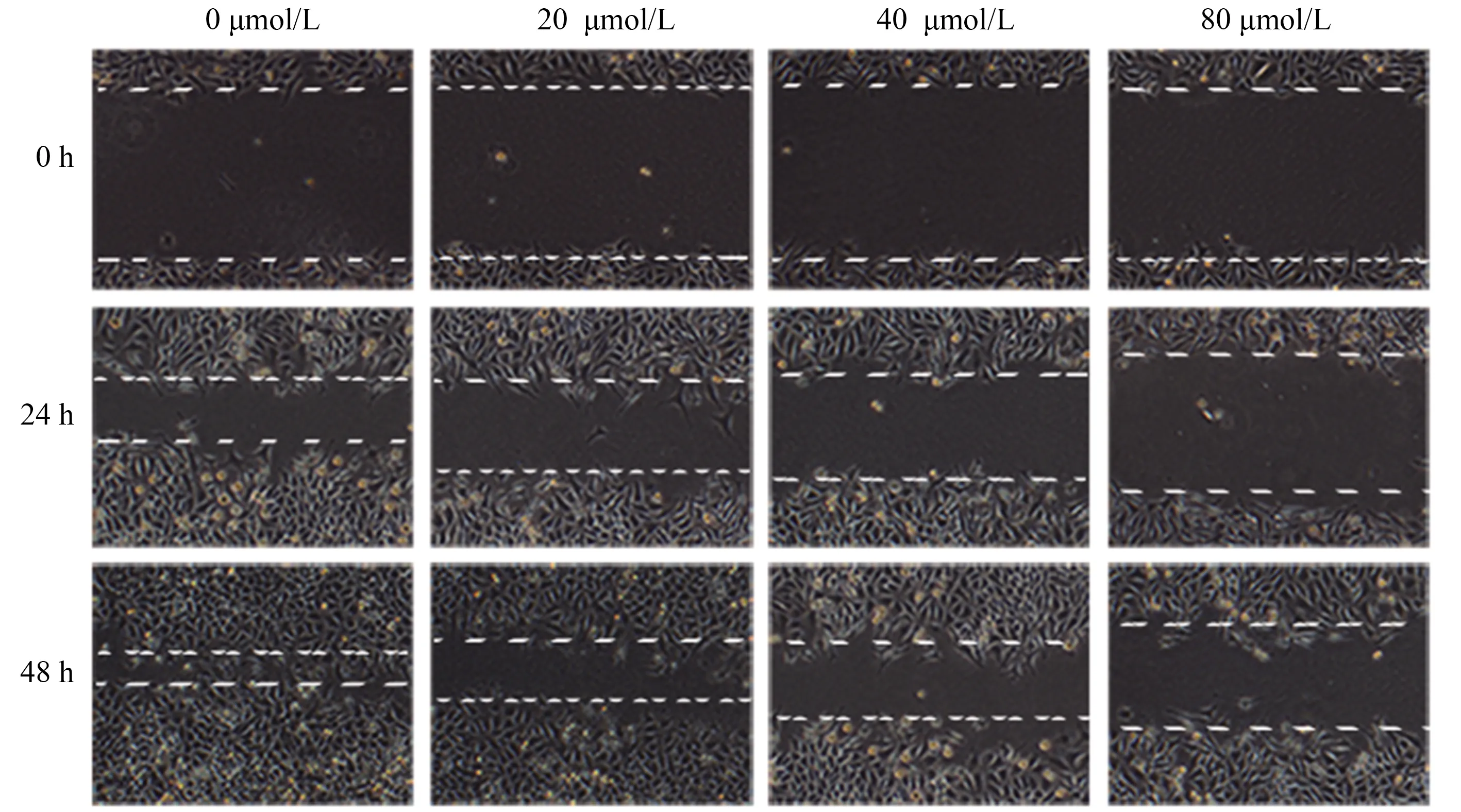
图2 紫檀芪抑制胃癌细胞迁移能力Fig 2 Inhibition of migration of gastric cancer cells by Pterostilbene

注:与对照组相比,#P<0.05。
2.3 紫檀芪诱导胃癌细胞的凋亡与对照组相比,不同浓度紫檀芪处理胃癌细胞后,胃癌细胞凋亡水平明显增加,且随浓度升高而升高。流式结果显示,0、20、40、80 μmol/L的紫檀芪干预24 h后,胃癌细胞的凋亡率分别为(6.13±0.16)%、(13.97±2.03)%、(38.27±2.40)%和(64.30±2.92)%,差异有统计学意义(P<0.05)(见图4)。
2.4 紫檀芪诱导细胞内ROS产生DCFH-DA测定胞内ROS,结果表明,随着紫檀芪浓度增加,绿色荧光强度明显增强,即胞内ROS水平升高。这提示紫檀芪可能通过增加ROS、激活线粒体途径,从而抑制胃癌细胞增殖,诱导胃癌细胞凋亡(见图5)。
2.5 紫檀芪通过线粒体途径促进胃癌细胞凋亡为了进一步研究紫檀芪诱导胃癌细胞凋亡的机制,Western blotting检测线粒体途径相关蛋白。结果显示,0、20、40、80 μmol/L的紫檀芪干预24 h后,随着紫檀芪浓度增加,Bax、AIF、CytC、cleaved caspase-3和cleaved caspase-9蛋白表达量也逐渐增加,Bcl-2、Survivin表达量逐渐减少(见图6)。

注:与对照组相比,#P<0.05。 图4 紫檀芪对胃癌细胞凋亡的影响 A:Hoechst 33258染色观察凋亡细胞(放大100倍);B:流式细胞术检测凋亡率Fig 4 Effect of Pterostilbene on apoptosis of gastric cancer cells A: Hoechst 33258 staining for apoptotic cells; B: flow cytometry for apoptosis rate
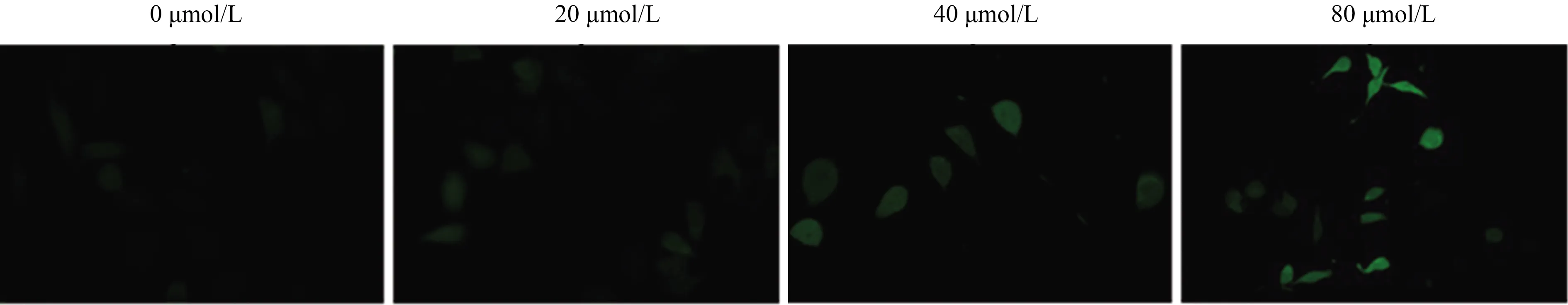
图5 紫檀芪对胃癌细胞内ROS的影响(放大200倍)Fig 5 Effect of Pterostilbene on ROS in gastric cancer cells
3 讨论
胃癌是一种常见的恶性肿瘤,尤其是在一些亚洲国家。在中国,2015年胃癌死亡率在癌症相关死亡中排第二位[2]。如今胃癌的筛查和监测计划及现有的治疗方法远不能令人满意[10]。临床过程中会出现肿瘤复发、药物不良反应、耐药等情况,导致预后不良。因此,寻找高效安全的天然抗癌药物刻不容缓。
细胞凋亡是抗癌药物发挥抗癌作用的重要机制,主要分为三条途径:死亡受体途径、线粒体途径和内质网应激途径[11-13]。线粒体途径又称内源性途径,是一种进化上高度保守的细胞死亡形式,对多细胞生物体的发育和稳态至关重要。线粒体凋亡途径的一个中心事件为线粒体通透性改变,通过线粒体通透性转换孔(mitochondrial permeablity transition pore,MPTP)来实
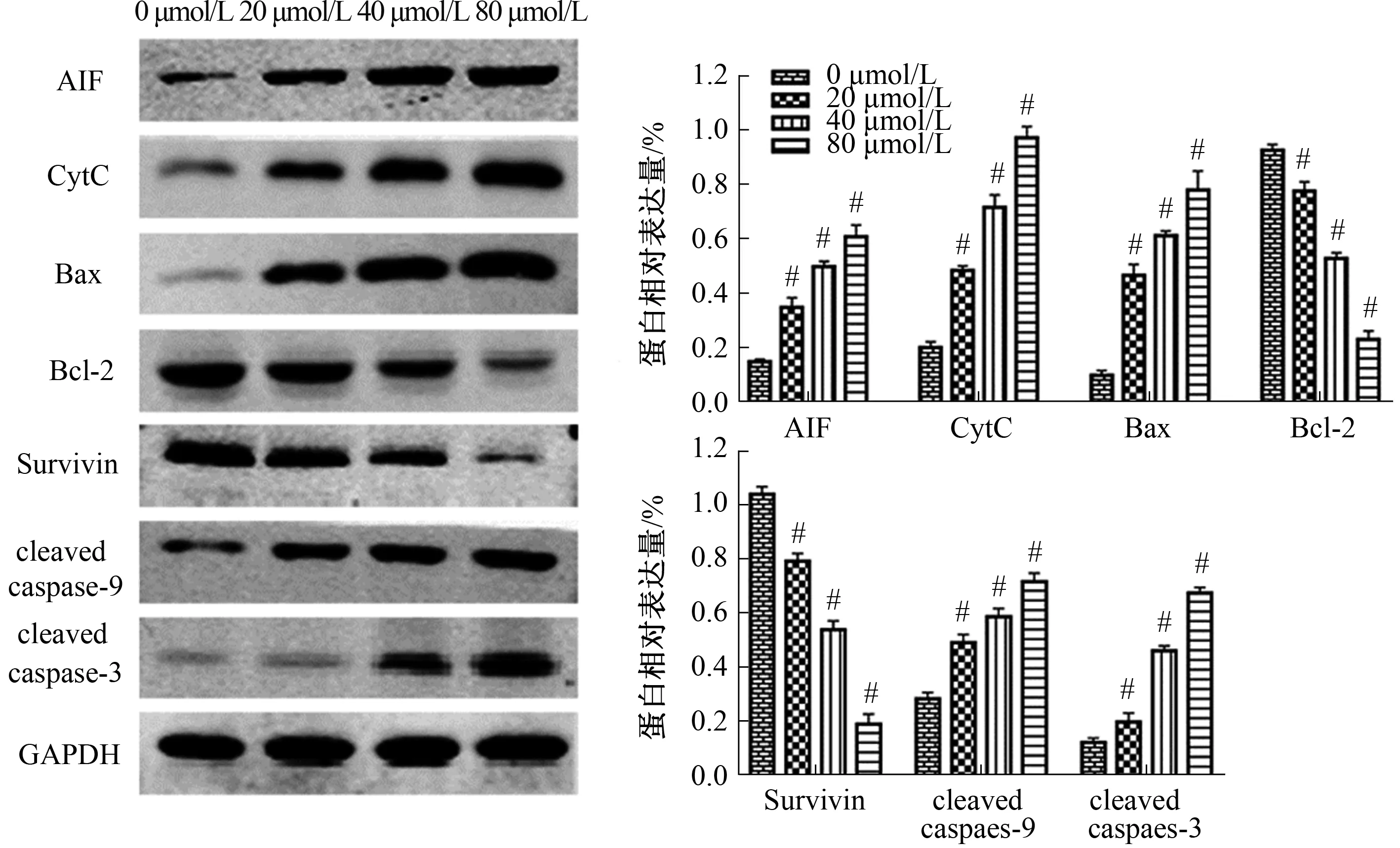
注:与对照组相比,#P<0.05。 图6 紫檀芪对胃癌细胞线粒体途径的影响Fig 6 Effect of Pterostilbene on the mitochondrial pathway in gastric cancer cells
现[14]。线粒体是ROS的主要来源,也是ROS损伤的目标。短暂的、可逆的MPTP开放与ROS的释放有关,通过及时从线粒体释放潜在的毒性ROS,帮助机体适应氧化还原应激。但在较高的ROS水平下,长时间和持续的MPTP开放可能发生ROS爆发性释放,导致线粒体损伤[15]。随着线粒体膜的受损,CytC和AIF从线粒体释放到细胞质中,进而激活caspase-9、caspase-3和caspase-7,最终诱导细胞凋亡。
紫檀芪作为白藜芦醇结构类似物,具有抗炎、抗氧化、抗肿瘤、神经保护等多种生物活性。截至目前,已在体内外多种癌症细胞中表现出抗癌能力。据报道,线粒体途径参与紫檀芪对肝细胞癌凋亡的诱导作用[16]。然而,目前其对胃癌的作用仍不十分清楚。本研究探讨了紫檀芪对胃癌细胞增殖凋亡的影响及相关机制。
用不同浓度的紫檀芪处理胃癌细胞后,发现紫檀芪对胃癌细胞的增殖有明显抑制作用,且呈时间和剂量依赖性,而对胃黏膜上皮细胞增殖抑制作用较弱。这提示紫檀芪的抗胃癌作用具有高效、低毒的特征。肿瘤发生转移主要是通过细胞的迁移和侵袭实现,细胞划痕和Transwell实验证明紫檀芪能够明显抑制胃癌细胞的迁移和侵袭,且抑制作用随着浓度的增高而增强。同时,Western blotting实验发现MMP-2、MMP-9表达也随着紫檀芪浓度增高而减少,提示紫檀芪可能是通过降低MMP-2、MMP-9表达来发挥抗迁移和抗侵袭作用的。此外,Hoechst 33258染色和流式细胞术结果均表明紫檀芪能够显著促进胃癌细胞凋亡。Bcl-2家族蛋白是MPTP的重要组成部分,分为抗凋亡(Bcl-2、Bcl-xl等)和促凋亡(Bax、Bcl-xs等)两类。Bcl-2/Bax比值的降低能改变MPTP的通透性和结构,导致线粒体断裂和CytC的释放[17-18]。此外,线粒体释放AIF进入细胞质,然后移位到细胞核,介导染色质凝聚,导致细胞死亡[19]。因此,我们进一步检测了线粒体途径相关蛋白的水平,结果显示,紫檀芪处理胃癌细胞后,Bax、AIF、CytC、cleaved caspase-3和cleaved caspase-9的水平显著升高,Bcl-2和Survivin的水平显著降低。
综上所述,紫檀芪能够明显抑制胃癌细胞增殖、迁移和侵袭,并诱导细胞凋亡,其机制可能与增加细胞内ROS激活线粒体途径有关。本研究提示,紫檀芪在胃癌治疗中具有潜在的应用价值。

