凋落物物理阻隔对格氏栲种子萌发及胚根生长的影响
朱 静,刘金福,*,何中声,邢 聪,王雪琳,江 蓝
1 福建农林大学林学院,福州 350002 2 福建农林大学海峡自然保护区研究中心, 福州 350002 3 生态与资源统计福建省高校重点实验室, 福州 350002
凋落物是由森林生态系统中生物组分产生并归还到地面的有机物质总称,包括乔灌木的枯枝落叶、落皮、繁殖器官和枯死的草本植物等[1- 3]。在森林更新早期阶段,凋落物存在使种子萌发及胚根生长的土壤水分及温度等微环境条件发生变化。凋落物覆盖对种子萌发及胚根生长产生促进作用[4- 5],通过截留降水,减小地表水分蒸发和改善土壤结构,增加土壤保水能力等途径来提高土壤含水量,提高种子发芽率和幼苗成活率[6]。凋落物分解能释放养分归还土壤,增大土壤孔隙率,提高土壤含水量,改善土壤物理性质等,有利于幼苗根系和种子呼吸以及养分在土壤中的运输,促进了植物种子萌发与幼苗生长[1]。凋落物提高了土壤含水量,影响种子发芽率、发芽开始时间和发芽持续时间[7]。土壤孔隙度增大有效促进氧化还原酶活性和根系代谢,增强根系营养吸收并加速幼苗生长。考虑到凋落物覆盖有利于降低种子发芽期间温湿度及光照波动幅度,降低对种子或幼苗的损伤[2,8- 10],也为胚根生长提供遮荫效果,使胚根生长在全黑暗条件下生长速度快[11]。然而凋落物具有消光作用,且凋落层消光作用随着其厚度增加而增强,导致光合光量子流密度(Photosynthetic Photon Flux Density,PPFD)与红光与远红光密度比值(Phytochrome Red Light/Far-red Light, Pfr)下降,抑制种子萌发与幼苗生长[2];凋落物通过机械阻碍,动物侵害和微生物致病等因素影响种子萌发和幼苗生长,尤其凋落物产生阻断种子与土壤接触机制,增加机械阻碍,减少种子萌发可能性和幼苗定居机会[12];种子萌发过程中,凋落物覆盖增加种子发生霉变,虫蛀等死亡的几率,降低了种子萌发率,影响其自然更新。而凋落物对种子萌发影响与种子本身大小也有关联:张建国等认为辽东栎(Quercusliaotungensis)种子大,自身储藏了丰富的营养物质供其萌发,凋落物覆盖对种子萌发无显著影响[4];赵冲等认为凋落物覆盖厚2 cm可促进杉木(Cunninghamialanceolata)种子萌发及幼苗生长[13]。可见,探讨凋落物对种子萌发的影响不仅揭示凋落物对森林更新的影响,也为森林可持续发展提供理论依据。
格氏栲(Castanopsiskawakamii),是中国中亚热带南缘特有的壳斗科常绿阔叶高大珍稀濒危乔木,受种源、幼苗建成限制及人为干扰等原因,更新能力差,种群年龄结构呈“倒金字塔”型[14]。格氏栲林内凋落物层厚[15],种子可能受到林下地被层或地表凋落物的机械阻碍而限制萌发;或者种子虽能萌发,胚根无法与土壤接触造成格氏栲幼苗死亡率高,导致林内落种更新的实生幼苗少,多以萌生苗形式分布在母树周围[16]。目前关于格氏栲研究主要集中于格氏栲生态学特性[14]、格氏栲树木叶片碳氮磷化学计量[17],格氏栲林土壤微生物多样性等方面[18],而有关于格氏栲天然林凋落物覆盖方式及厚度对格氏栲种子萌发及胚根生长的影响尚未报道,限制了对格氏栲更新能力的深入了解。为此,提出假设:(1)凋落物覆盖方式及厚度是否影响格氏栲种子萌发?(2)凋落物是否限制了格氏栲林下更新?即以格氏栲种子为研究对象,通过模拟野外凋落物覆盖方式及厚度对格氏栲种子萌发及胚根生长的影响,探讨凋落物物理阻隔对种子萌发的影响过程,为格氏栲林天然更新及恢复提供理论依据。
1 研究区概况
三明格氏栲自然保护区位于福建省三明市郊西南部,中心坐标为26°07′—26°12′ N、117°24′—117°29′ E,面积近700 hm2,海拔180—640 m,属福建武夷山东伸支脉地带。格氏栲自然保护区属中亚热带季风型气候,受地势、强对流天气及暴雨影响,局部小气候复杂多样。年平均温度19.5℃,极端最低气温- 5.5℃,最高气温40℃,年平均降雨量1500 mm。土壤表现出典型的地带性土壤特征,以红壤与暗红壤为主,凋落物层较厚,土层腐殖质丰富,水肥条件良好[16]。格氏栲自然保护区植物种类丰富,群落类型多样,郁闭度高达0.8左右。群落以格氏栲群为优势种,树冠常年浓绿,冠幅庞大,树形优美通直,树皮呈灰褐色,林相整齐,形成中亚热带常绿阔叶林所特有的外貌特征[19]。林内乔木层主要树种有格氏栲、桂北木姜子(Litseasubcoriacea)、木荷(Schimasuperba)等,灌木层主要有狗骨柴(Diplosporadubia)、山黄皮(Clausenadentata)和杜茎山(Measajaponica)等;草本植物主要有狗脊蕨(Woodwardiajaponica)、华山姜(Alpiniajaponica)和芒萁(Dicranopterisdichotoma)等[20]。
2 研究方法
2.1 供试材料的收集与处理2.1.1 种子收集与处理
种子来源于三明格氏栲自然保护区。于2018年10月种子成熟季节,收集饱满,品质良好的格氏栲种子。预备2个通气良好的储藏箱和含水量饱和的细沙(含水量约60%),在箱底部放置10 cm厚细沙,喷洒1.25 g/L敌百虫,沙藏种子并盖约10 cm细沙,室内温度控制在5℃,沙藏时间为60—80 d。种子发芽实验开始时,取出沙藏格氏栲种子用蒸馏水洗净,静置3 h,去除漂浮、劣质种子,将沉于水下的饱满种子捞出,用0.5% KMnO4浸种消毒30 min后,蒸馏水再反复冲洗3次,晾干表面水分,然后挑出生长饱满、均匀一致的格氏栲种子(一般每粒大于2 g)备用。
2.1.2凋落物收集与处理
2018年3月于三明格氏栲自然保护区设置3个大林窗(≥200 m2)、3个中林窗(50—100 m2)与3个小林窗(≤50 m2)作为固定样地,以1个非林窗样地(4个10×10 m样方)作为对照。为了减少因凋落物类型造成的实验误差,在每个林窗东、西、南、北和中央5个方向各设置一个1 m×1 m凋落物收集框,每月月初收集凋落物框中样品,并在种子掉落高峰期收集林窗内格氏栲种子。将凋落物带回实验室混合均匀,于80℃烘箱中烘干至恒重,供模拟凋落物覆盖种子萌发实验使用。
2.1.3土壤选择
萌发实验基质为灭菌后的天然林土壤。供试土壤为三明格氏栲自然保护区林内10—40 cm土层土壤,去除土壤中原有植物碎屑、死根等杂质,放置高压灭菌锅灭菌,灭菌后土壤风干过5 mm土筛,过筛后土壤作为萌发实验基质供后期凋落物覆盖种子萌发实验使用。
2.2 凋落物覆盖方式及厚度下的试验方法
采用室内实验方法于2018年12月在福建农林大学林学院实验大棚内开始,选用38.5 cm×27.5 cm×14 cm规格的萌发盆,依据萌发盆体积,计算相应加入的凋落物重量。实验设计7个凋落物厚度梯度,种子上层覆盖凋落物播种与种子底层铺垫凋落物播种等两种实验方案,其中5个梯度种子与土壤有机质直接接触,覆盖0 cm(CK),2 cm(约40 g/m2,D2),4 cm(约80 g/m2,D4),6 cm(约120 g/m2,D6),8 cm(约160 g/m2,D8)凋落物(图1a—d),在种子与凋落物之间覆盖一层孔径为5 mm的尼龙网;另外2个梯度先铺2 cm(约40 g/m2,U2),4 cm(约80 g/m2,U4)厚(图1e—f)凋落物再播种,其中每个处理设置3个重复。将处理过的种子分别掩埋于萌发盆土壤表面,每个重复播种50粒颗粒饱满、大小一致的格氏栲种子,选取干燥均匀的凋落物作覆盖物,采用称重法控制凋落物厚度,覆盖时尽量保持各部位均匀一致。播种后,每个萌发盆定期浇水,每隔2天每次浇水200 mL[21]以保证种子萌发和胚根生长的水分供给。实验中种子与凋落物之间铺垫孔径5 mm的尼龙网,便于提起凋落物以观测种子萌发及胚根生长情况,减少因拨开凋落物对种子胚根伸长的伤害[22]。
2.3 各种指标测定2.3.1 含水量测定
含水量测定采用烘干法。先称量烘干后的铝盒重。将种子播种后,于浇水(200 mL)48 h后取表层土壤(0—4 cm)10 g,放入空铝盒内称重(原土重)。称重后,密封迅速带回实验室,放入提前设定105℃烘箱中,烘干至恒重(烘干土重)。
土壤含水量(%)= (原土重-烘干土重)/烘干土重×100%[23]
2.3.2种子萌发指标测定
以胚根露出种皮2 mm作为种子萌发标准[24],统计时将凋落物提起,每3 d统计发芽数,游标卡尺测量胚根长度并记录。当连续7 d发芽粒数平均不足供试种子总数的1%时视为发芽结束[25]。发芽实验结束,计算种子发芽率、发芽势、发芽指数、平均发芽速度,萌发抑制率等发芽指标;胚根生长量基本不变时,胚根实验结束,计算胚根生长情况。
发芽率(%)=发芽的种子数/供试种子总数×100%;
发芽势(%)=日平均发芽数达到最高那一天为止正常发芽的种子数/供试种子总数×100%;
发芽指数=∑(Gt/Dt)[26];
平均发芽速度=∑(Gt×Dt)/∑Gt;
式中,Gt指在第t天的种子发芽数,Dt指相应种子发芽所用天数;
萌发抑制率(%)=(对照萌发数-各处理萌发数)/对照萌发数×100%[27]。
2.4 数据统计
采用Excel 绘制图表;利用单因素方差分析凋落物覆盖方式及厚度对格氏栲种子发芽率、发芽势、发芽指数、平均发芽速度及胚根生长的影响,以最小显著差异法(LSD)进行组内差异比较(α=0.05)。
3 结果分析
3.1 凋落物覆盖方式及厚度对基质含水量的影响

图2 凋落物覆盖方式及厚度对基质含水量的影响 Fig.2 Effects of litter cover and thickness on water content of substrates图中不同小写字母表示各处理基质含水量间差异显著(P<0.05)
凋落物覆盖方式及厚度对格氏栲种子萌发基质(土壤)含水量的影响为D4>U2>D6>D2>D8>U4>CK(图2)。上层凋落物覆盖处理(D)的土壤含水量随覆盖厚度增加呈先升高后降低趋势,在D4处达到最高值,含水量为33.57%;D8处最低(28.63%)。U2处理的含水量高于U4,且均与CK存在显著差异性(P<0.05)。底层铺垫凋落物处理(U)与D处理土壤含水量相比较,与D4处理存在显著差异性(P<0.05)。
3.2 凋落物覆盖方式及厚度对格氏栲种子萌发的影响
不同处理对格氏栲种子萌发进程的影响随时间推移呈先增加后平稳的趋势(图3)。CK处理的种子从开始萌发到结束持续55 d,萌发持续时间长,结束时间滞后。D2处理的种子在第52天结束萌发,萌发结束时间迟缓,早于CK。D6处理前期种子萌发数高,在第43天结束萌发,萌发结束时间早。U处理在播种后第16天开始萌发,U2处理萌发持续时间39 d,U4处理萌发持续36 d,萌发时间比其他处理显著滞后,发芽种子数最少,发芽周期短,即凋落物存在抑制格氏栲种子萌发。
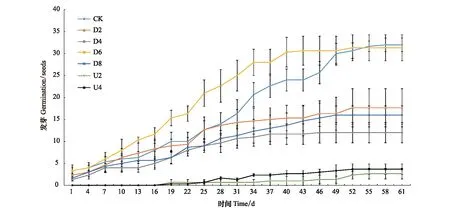
图3 凋落物覆盖方式及厚度对格氏栲种子萌发进程的影响Fig.3 Effects of litter cover and thickness on the germination process of C. kawakamii
凋落物覆盖方式及厚度对格氏栲种子发芽率的影响为CK>D6>D2>D8>D4>U4>U2(表1)。CK发芽率最高,为64%,显著高于U2处理(P<0.05)。上层覆盖处理D内,D6处理的发芽势(56%)、发芽指数(18.09)最高,其次为D2处理;D4处理的发芽势与发芽指数最低。底层铺垫处理U内,U2处理的发芽势(1.33%)、发芽指数(0.47)低于U4处理 。平均发芽速度的变化趋势为U2>U4>CK>D8>D6>D4>D2,种子上层覆盖凋落物促使格氏栲种子发芽更快。与CK(无凋落物覆盖)相比,萌发抑制率为U2>U4>D4>D8>D2>D6>CK。U处理的种子萌发抑制率最高,分别高达92.67%和88.54%,即U处理对格氏栲种子的萌发抑制性更大。
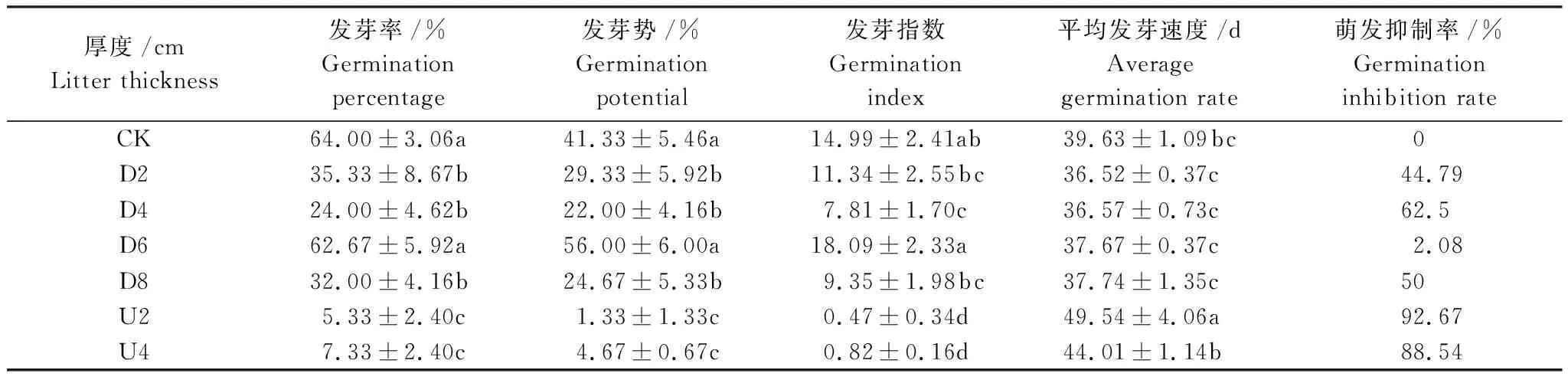
表1 凋落物覆盖方式及厚度对格氏栲种子萌发的影响
3.3 凋落物覆盖方式及厚度对格氏栲种子胚根生长的影响
凋落物覆盖方式及厚度对格氏栲胚根生长影响表现为D6>D8>D4>D2>U4>U2>CK(图4)。两者与CK比,上层覆盖处理D内,胚根生长规律随凋落物厚度增加呈先上升后下降趋势,D6处理促进作用最为明显(P<0.05);底层铺垫处理U内,U2处理在胚根生长初期,抑制作用强,第27天转为促进作用。D处理与U处理比,种子胚根长度高于U处理(第15天)。可见D处理更有利于格氏栲种子胚根生长,U处理前期抑制格氏栲种子胚根生长,后期起促进作用。
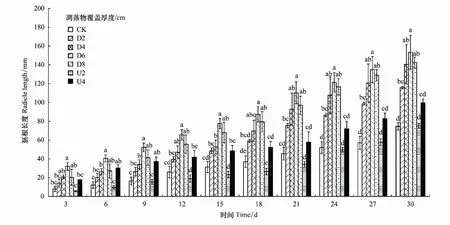
图4 凋落物覆盖方式及厚度对格氏栲种子胚根生长的影响Fig.4 Effects of litter cover and thickness on the seed radicle growth of C. kawakamii图中不同小写字母表示同一天各处理胚根长度间差异显著(P<0.05)
4 讨论4.1 凋落物覆盖方式及厚度对格氏栲种子萌发进程的影响
凋落物是种子落地后接触到的最初物理环境,对种子萌发及胚根生长具有重要影响。凋落物覆盖显著影响了格氏栲种子萌发的开始时间与持续时间(图3),影响结果与韩文娟等一致[27],产生差异性原因可能是凋落物改变了土壤水分,影响种子萌发进程。无凋落物覆盖处理(CK)的种子发芽数最高,上层覆盖处理(D)前期萌发快,发芽持续时间短;底层铺垫处理(U)的种子由于裸露在空气中,播种后第16天开始萌发,萌发开始时间滞后,持续时间显著缩短。凋落物覆盖通过改善种子萌发微环境、降低土壤水分蒸发等途径提高土壤含水量,且凋落物具有一定持水性能,渗水性能好[28]。当向种子上层覆盖凋落物浇一定量水后,凋落叶吸水饱和,多余水分下渗,水分大多保留在凋落叶内,无法为土壤中种子提供充足水分而限制种子萌发。当下层铺垫凋落物时,凋落物表层水分蒸发快,上层种子因吸收不到充足水分而无法萌发,种子发芽率显著降低。而无放置凋落物处理的土壤含水量低,当水分胁迫解除后种子恢复萌发,萌发持续时间从而显著延长。
4.2 凋落物覆盖方式及厚度对格氏栲种子萌发的影响
凋落物覆盖方式及厚度对格氏栲种子萌发产生阻碍作用,CK处理的种子发芽率高于D处理、U处理,可能与凋落物对土壤种子库的影响有关。凋落物覆盖过厚或密度太大使掉落高峰期的格氏栲种子大多分布在枯枝落叶层表面,腐殖质层和心土层种子少[29],即通过物理阻隔作用阻止种子与土壤接触,降低种子萌发率。凋落物对土壤温度的改变也可能影响种子萌发及胚根生长。凋落物可降低太阳辐射,阻隔凋落物覆盖下土壤与外界空气的热交换起到保温作用,使格氏栲种子在单一温度下种子萌发率、萌发速率系数,萌发指数均受到抑制[30-31]。由表1可知D处理、U处理的格氏栲种子萌发率与CK比较均显著降低,也证实了凋落物减少了空气日温差,使种子萌发缺少变温条件,通过互逆的动态平衡机制,抑制格氏栲种子萌发。凋落物覆盖降低土壤水分蒸发速度,保持种子萌发所需土壤湿度,U处理的种子表面水分蒸发快,降低种子萌发和幼苗生长实际利用所需的水分含量,导致U处理的种子因吸收不到充足水分限制其萌发,萌发率显著低于D处理,与周艳等结论相同[5]。凋落物存在抑制格氏栲种子萌发,可能与凋落物产生遮光效应降低地表和表层土的光合光量子流密度和红光与远红光密度比值(Pfr值)有关[8,27]。在光照强度一致条件下,凋落物层消光作用导致种子萌发所需的光照降低,凋落物越厚,降低幅度越大,对种子萌发的抑制率越高,使D处理、U处理的种子萌发率显著降低。
4.3 凋落物覆盖方式及厚度对格氏栲胚根生长的影响
凋落物对植物幼苗形态建成起到关键作用,凋落物覆盖方式及厚度对格氏栲种子胚根生长的影响存在显著差异。D处理的种子胚根长度随凋落物厚度增加呈先上升后下降趋势,均显著高于CK(图4),可能原因是凋落物覆盖过厚产生阻碍作用,种子为了突破林下地被层或地表凋落物的机械阻碍,需要分配更多物质与能量用于胚根生长,以促进幼苗建成[28]。其次,凋落物通过改变种子生存温度,影响到种子体内酶活性,对胚根也产生影响[28]。低温对种子的吸水能力和酶活性等生理生化进程产生抑制作用,温度过高使种子体内酶变性影响种子胚根生长。适宜温度使酶促过程中呼吸作用加强,种子体内贮存的养分快速变成胚根可利用的可溶性状态,提高了胚根生长速度[32]。种子上层覆盖凋落物降低了空气与土壤温度变化幅度,维持土壤含水量,降低土壤水分蒸发,使D处理的种子在萌发过程中吸收充足水分去溶解一些贮藏物质成为胚根生长能够利用的养料[7],延长胚根生长期,促进D处理的胚根生长。适宜的凋落物覆盖也降低太阳对胚根的直接照射,减少胚根灼伤,为格氏栲种子胚根生长提供了良好的微环境条件,加速胚根生长[33]。U处理的胚根生长前期暴露于空气中,受太阳直接照射的影响,水分蒸发快,生长速度慢;待胚根向下生长,凋落物的遮光效果促使胚根在全黑暗环境下快速生长,胚根长度高于CK。凋落物覆盖能提高土壤孔隙度,增加种子萌发的土壤通气性,使D处理的格氏栲根系快速生长[34-35],胚根长度显著高于U处理与CK。
5 结论
凋落物存在改变了地表光照水平、土壤水分等微生境条件,对种子萌发基质含水量及种子萌发指标都存在显著影响。结果表明,无凋落物覆盖处理(CK)提高了种子萌发率,降低胚根生长速度。凋落物覆盖显著降低了种子萌发率,尤其种子底层铺垫凋落物处理(U)对种子萌发及胚根生长的抑制作用,在一定程度上解释了格氏栲天然林更新能力差可能由于较厚的凋落物形成物理阻隔作用抑制种子萌发。建议种子雨掉落高峰期来临之前,清理林内凋落物,保证种子与土壤接触,为种子萌发提供良好的萌发环境。

