月桂酰丙氨酸的胶束行为研究
葛 赞,徐坤华,耿二欢,毛雪彬,李伏益,雷小英
(赞宇科技集团股份有限公司,浙江杭州 310030)
月桂酰丙氨酸(LA)是近年来研究较多的氨基酸表面活性剂,是由月桂酰氯与丙氨酸反应制得,具有润湿、发泡、去污、乳化、杀菌、缓蚀、低刺激、生物可降解等特点,主要应用于日用洗发香波、洗面奶、沐浴露等日用化工产品中,还可用于农药、金属清洗、印染、润滑油添加剂等工业领域[1-7]。国内外已经有很多关于LA 合成及应用性能的研究报道[1,8-9]。表面活性剂在溶液中超过一定浓度时,单个分子会聚集形成胶束,此浓度为临界胶束浓度;表面活性剂的胶束化过程受温度、pH、离子强度等条件的影响[10-11]。国内外已经有很多关于表面活性剂溶液胶束行为的研究[12-14],但关于LA 胶束行为的研究鲜有报道。
本研究测定了LA 的表面张力,计算了临界胶束浓度(cmc)、最低表面张力(γcmc)及相关物理学和热力学参数,通过这些参数表征LA 的聚集行为,并探究了pH、温度及离子强度对聚集行为的影响。
1 实验
1.1 试剂与仪器
试剂:LA(质量分数99%,赞宇科技集团股份有限公司),氯化钠、氢氧化钠(质量分数99.5%,化学纯,广东省化学试剂工程技术开发中心)。仪器:K100全自动表面张力仪(德国KRUSS 公司),THCD-15 循环恒温水浴锅(宁波天恒仪器厂),FE28 型pH 计[梅特勒-托利多仪器(上海)有限公司]。
1.2 测试
1.2.1 中和点
使用去离子水将LA 配制成质量分数为2%的溶液,并用氢氧化钠溶液调节pH 到12 左右,然后在25 ℃下用0.1 mol/L 盐酸滴定,并监测pH 变化,以pH为纵坐标,滴加的盐酸体积为横坐标作图,根据pH突跃点求得LA 的中和点。
1.2.2 表面张力
将LA 配制成不同浓度、不同pH、不同氯化钠浓度的系列溶液,在不同温度下用吊片法测定表面张力。以表面张力为纵坐标,LA 浓度为横坐标作图,求出cmc和γcmc。
2 结果与讨论
2.1 pH 对LA 胶束行为的影响
由图1 可知,LA 的中和点为7.8。当pH 大于7.8时,LA 的羧基被完全中和,呈现阴离子性;当pH 小于7.8时,羧基没有被完全中和,在溶液中以离子及分子形式呈现。

图1 LA 的pH 滴定曲线
由图2 可知,表面张力随着LA 浓度的增大先减小后增大最后保持不变,呈现出最低表面张力现象。随着溶液表面张力的降低,表面活性剂分子吸附在气液界面上,当表面张力保持不变时,吸附达到饱和,表面张力最低处对应的浓度即为cmc,对应的表面张力为γcmc。

图2 不同pH 时LA 的表面张力曲线
由表1 可知,在pH 为7~11 时,随着pH 升高,cmc与γcmc增大,这是因为pH 升高,溶液中离子成分增多,分子间斥力增加,较难形成胶束,pH 低时LA 呈现较高的表面活性。
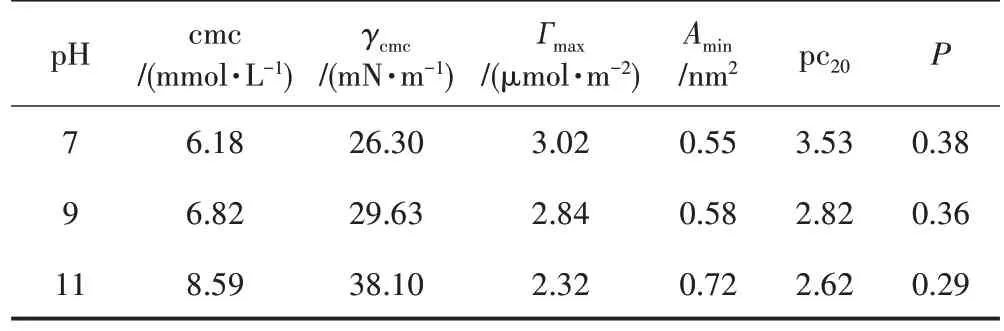
表1 不同pH 时LA 的表面活性参数
分子在气液界面上的饱和吸附量Гmax和最小截面积Amin可以按下式[10-11]计算:

其中,γ为表面张力;R为气体常数;T为绝对温度;NA为阿伏伽德罗常数;c为表面活性剂浓度。由表1 可知,随着pH 升高,LA 的Гmax降低,Amin升高,表面活性剂在气液界面上的排列变稀疏。
pc20代表使水表面张力降低20 mN/m 所需表面活性剂浓度的负对数[11,15]。由表1 可知,pH 升高,pc20降低,LA 分子降低表面张力的效率降低。
表征表面活性剂分子形成胶团形状的几何排列参数P[16-17]按下式计算:

其中,Vc是疏水基体积;lc为疏水基碳氢链长度;A0为亲水基在紧密排列的单层中平均占有面积。若疏水链为直链烷基,则Vc和lc可以根据Tanford 公式[18-19]进行计算:
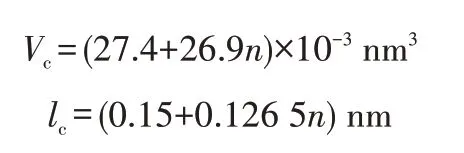
其中,n为疏水链碳原子数。
由表1 可以看出,当P小于1/3 时,体系形成球形胶团;当1/3<P≤1/2 时,形成不对称形状的胶团,如椭球、扁球、棒状;当1/2<P≤1 时,体系形成具有不同弯曲程度的双分子层,即囊泡结构[11,17]。由表1 还可以看出,当pH 等于7 或9 时,P分别为0.38、0.36,LA 形成不对称形状的胶团;当pH 等于11 时,P为0.29,LA形成球形胶团。
2.2 温度对LA 胶束行为的影响
由图3、表2 可知,LA 水溶液的cmc 随着温度的升高而降低;γcmc呈现出相同的变化趋势。这是因为温度升高会破坏亲水基与水的结合力,易形成胶束。

图3 不同温度时LA 的表面张力曲线

表2 不同温度时LA 的表面活性参数及热力学参数
非离子与两性表面活性剂的胶束化标准吉布斯自由能(ΔGmic)、胶束化标准焓变(ΔHmic)以及胶束化标准熵变(ΔSmic)可以根据下式[18]计算:
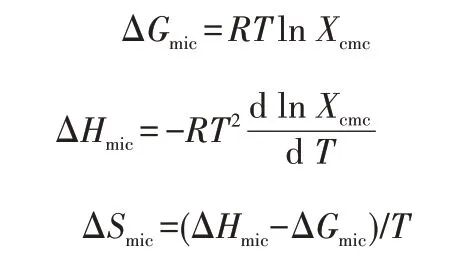
其中,R为气体常数;T为绝对温度;Xcmc为换算成体积分数的cmc,即Xcmc=cmc/55.4。由表2 可知,25~45 ℃时,ΔGmic均为负值,说明LA 在各个温度下的胶束化过程都是自发进行的,随着温度的升高,ΔGmic的绝对值变大,说明LA 在较高温度下更容易形成胶束;ΔHmic均为正值,说明胶束形成过程为吸热过程;ΔSmic均为正值,说明胶束形成过程为熵驱动过程[17]。
2.3 离子强度对LA 聚集行为的影响
由表3、图4 可知,随着NaCl 浓度的升高,LA 的cmc 降低,γcmc未发生明显变化。NaCl 的加入使胶团的表面电荷密度减小,电性排斥作用变弱,且表面活性剂分子疏水基产生盐析,从而更容易形成胶团[11]。随着NaCl 浓度升高,Гmax值降低,Amin值升高,说明LA 在气液界面的排列变得松散。这是因为NaCl 的加入导致亲水基体积增大,使LA 分子之间的位阻[17]增大。
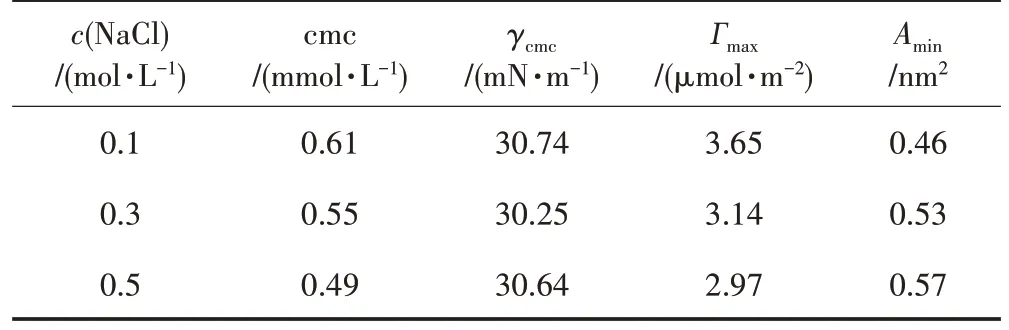
表3 不同NaCl浓度时LA 的表面活性参数

图4 不同NaCl 浓度时LA 的表面张力曲线
3 结论
(1)pH 为7~11 时,随着pH 的升高,LA 的cmc 与γcmc升高;LA 在pH 低时具有较高的表面活性;pH 为7、9 时,LA 形成不对称形状的胶团;pH 为11 时形成球形胶团。
(2)LA 水溶液的cmc 及γcmc随着温度的升高而降低;在各个温度下的胶束化过程是自发进行的熵驱动吸热过程;在较高温度下更容易形成胶束。
(3)随着NaCl浓度的升高,LA 的cmc降低,γcmc变化不明显。

