添加氧化石墨烯对义齿基托树脂细胞毒性及抗菌性能影响的研究*
吴雨宸 刘 凯 苏俭生
长期佩戴义齿往往会影响口腔微生态平衡,沉积于义齿基托表面上的菌斑及其毒素产物可导致基牙龋病、牙周病及义齿性口炎等口腔疾病,且与细菌性心内膜炎、吸入性肺炎和胃肠道感染等多种全身疾病相关[1],提高义齿的抗菌性一直是国内外学者关注的热点。向基托中添加抗菌剂是提高义齿抗菌性能的常用方法之一[2-4],近年来,随着纳米材料的发展,纳米抗菌剂高效、长效、安全性高等独特性能引起了学者们的关注[5]。氧化石墨烯(Grapheneoxide,GO)作为一种新型纳米材料,是石墨烯功能化后的衍生物。2010年我国中科院Hu等[6]首次报道了GO具有抗菌作用,此后关于GO抗菌性能的研究不断深入[7-9],这些研究为GO成为新一代纳米抗菌剂提供了理论依据[10]。目前,少有将GO作为抗菌剂添加到义齿基托树脂聚甲基丙烯酸甲酯(Polymethylmethacrylate,PMMA)中的研究报道。
本研究将不同浓度的GO添加PMMA中,以小鼠成纤维细胞L929为代表,探究其细胞毒性;并以龋病、牙周病、义齿性口炎的主要致病菌变形链球菌、伴放线放线杆菌、白色念珠菌为代表,探究其体外抗菌效果,从而为临床抗菌义齿基托树脂的选择提供参考。
1.材料和方法
1.1 材料和试剂PMMA热凝义齿基托粉(Ⅰ型Ⅰ类)及基托液(天津登士柏牙科有限公司);单层氧化石墨烯粉末(片径500 nm-5 μm,厚度0.8-
1.2 nm,单层率~99%,纯度~99%)(南京先丰纳米材料科技有限公司);小鼠成纤维细胞L929细胞株(上海拜力生物科技有限公司);变形链球菌(Streptococcusmutans,ATCC25175)、伴放线放线杆菌(Actinobacillusactinomycetemcomitans,ATCC43717)(北京北纳创联生物技术研究院);白色念珠菌(Candidaalbicans,SC5314)(同济大学医学院抗感染药物研究实验室安毛毛教授惠赠);脑心浸液肉汤琼脂培养基、培养液(BHI)、哥伦比亚血琼脂平板培养基(CBA)、沙氏培养基(SDA)、RPMI1640培养液(环凯微生物科技公司);CCK-8细胞毒性/增殖检测试剂盒(Dojindo,日本);厌氧产气袋、厌氧密封罐(日本三菱化学株式会社);LIVE/DEAD细胞活性检测试剂盒(ThermosFisher,美国);胎牛血清FBS、DMED培养液(Gibco,美国);0.25%胰蛋白酶(Sigma,美国);荧光倒置显微镜(Zeiss,德国);场发射扫描电子显微镜(Hitachi,FE-SEM,SU8010,日本);多功能酶标仪(BioTek,美国);傅里叶变换红外光谱仪(ThermoScientific,NicoletiS5,美国)。
1.2 添加不同浓度GO的PMMA样品制备 分别按照GO/PMMA 质量比为0wt.%、0.25wt.%、0.5wt.%、1.0wt.%的比例称取适量GO置于去离子水中,超声搅拌30分钟后加入纯PMMA干燥粉末并继续搅拌1小时,将混合悬液置于烘箱中干燥后得到混合粉末,将粉末分别装入微型球磨仪中球磨100分钟,得到不同浓度GO与PMMA均匀混合粉末。根据QB/T2591-2003标准[11],参照热凝义齿基托树脂制作工艺,制备出规格为2.0cm×2.0cm×2.0mm的样品每个浓度组各30个,所有样品在实验前进行灭菌。
1.3 实验样品表征检测 每个浓度组各取1个样品表面喷金处理后,使用扫描电子显微镜(SEM)进行表面形貌观察,并通过傅里叶变换红外光谱仪对样品材料的官能团进行检测。
1.4 细胞毒性检测
1.4.1 样品浸提液制备 根据GB/T16886.5-2017标准[12],按1.2 cm2/mL的浸提比例,从每个浓度组各取15个样品放入120mL含10%FBS的DMEM培养液,置于37 ℃培养箱分别浸提24h、48h后取出样品,过滤浸提液后调整PH至7.4获得样品浸提液。以含10% FBS的DMEM培养液作为阴性对照(空白对照),不添加GO的PMMA样品浸提液作为阳性对照,分别添加0.25wt.%、0.5wt.%、1.0wt.%GO的PMMA样品浸提液为实验组。
1.4.2 CCK-8 法细胞增殖实验及细胞毒性评级取对数生长期的L929细胞配置成浓度为5x104/mL的细胞悬液,接种于3块96孔培养板,每组8孔、每孔100μL,在37 ℃、5%CO2条件下细胞贴壁培养24h后,吸弃原液,PBS 洗涤2次后分别加入各组浸提液100μL。在第1、3、5d 末各取一培养板,每孔加入10μLCCK-8检测液,于37 ℃恒温箱内孵育2h后用酶标仪于450 nm处测定吸光度值(OD450Value),计算细胞相对增殖率(RelativeGrowthRate,RGR),RGR=样本组吸光光度平均值/空白对照组吸光光度平均值×100%,根据GB/T16886.5-2017中6级毒性评级标准对材料进行细胞毒性分级(cytoxicityscale,CTS)(表1)。以上实验重复3次。

表1 细胞毒性分级标准
1.4.3 活/死细胞双染色法细胞活性检测 取5x104/mL的L929细胞悬液500μL接种于24孔板,培养方法同1.4.2,培养2d后制备浓度为1×105/mL的各组细胞悬液。将5μL钙黄绿素-AM(组分A)和20μL乙锭二聚体-1(组分B)加入到10mLPBS中配置双染色液。取各组细胞悬液200μL置于EP管中,每管加入100μL染色液,25 ℃避光孵育30 min。然后将染色后的各组细胞悬液分别滴加于载玻片上,置于荧光显微镜下进行观察,ImageJ软件分析,细胞存活率=活细胞数/细胞总数。
1.5 抗菌性能检测
1.5.1 实验菌液制备 分别复苏变形链球菌、伴放线放线杆菌、白色念珠菌冻干菌株得到菌悬液。采用平板划线法进行转接活化,采用连续转接2次之后的新鲜菌液培养物,挑取变形链球菌和伴放线放线杆菌单菌落混悬于BHI培养液中,37 ℃厌氧培养24h;挑取白色念珠菌单菌落混悬于RPMI1640培养液中,30 ℃需氧培养12h。血球计数板分别配置密度为1×105CFU/mL的3种菌液为实验菌液,备用。
1.5.2 抗菌率测定 根据QB/T2591-2003标准,采用薄膜密贴法进行抗菌性能测试。每个浓度组各取3个样品分别置于12个灭菌平皿中,分别取200μL变形链球菌/伴放线放线杆菌/白色念珠菌实验菌液滴加在各样品表面,用聚丙烯薄膜铺平覆盖样品表面,使菌液均匀接触样品。在37 ℃下厌氧培养(变形链球菌和伴放线放线杆菌)48h/30 ℃下需氧培养(白色念珠菌)24h。而后在每个平皿中加入20mL 无菌生理盐水洗脱液,反复清洗样品及聚丙烯薄膜,充分混匀洗脱液并进行倍比稀释,每个浓度各取100μL分别接种至BHI琼脂培养基(变形链球菌)/CBA培养基(伴放线放线杆菌)/SDA培养基(白色念珠菌)上,厌氧培养48h(变形链球菌和伴放线放线杆菌)/需氧培养24h(白色念珠菌)。以上实验重复3次。
进行菌落计数并计算抗菌率。抗菌率R%=(A-B)/A×100,式中R抗菌率(%),A:对照样品平均回收菌数(CFU/片),B:抗菌样品平均回收菌数(CFU/片),参照QB/T2591-2003,抗菌率r≥99%的抗菌树脂可以报告有强抗菌作用,r≥90%的抗菌树脂可以报告有抗菌作用。
1.5.3 样品表面细菌形态观察 样品表面细菌培养方法同1.5.2,培养结束后弃去菌液及覆盖膜,每个浓度组各取1个样品,表面用PBS液轻柔漂洗3次后加入5 ml2.5 %戊二醛于4 ℃过夜固定,再次PBS液轻柔漂洗3次,乙腈梯度脱水、真空干燥、喷金、扫描电镜下观察细菌形态,随机选取视野并拍照。
1.6 统计学分析 使用SPSS24.0对结果进行统计学分析,各组数据经正态分布及方差齐性检验后使用,数据以均数±标准差(±s)表示,采用单因素方差分析和LSD-t检验比较各组间差异,P<0. 05表示差异具有统计学意义。
2.结果
2.1 表征检测
2.1.1 样品表面形貌 通过扫描电镜SEM观察样品表面形貌,不添加GO的PMMA表面光滑平坦(图1a);添加0.25wt.%GO的PMMA表面略粗糙,未见明显颗粒或团块(图1b);添加0.5wt.%GO的PMMA表面观察到少量类似玻璃颗粒状形貌(图1c);添加1.0wt.%GO的PMMA表面呈现团块聚集现象,局部出现褶皱和凹坑(图1d)。

图1 添加不同浓度GO的PMMA样品表面SEM形貌(x1000)
2.1.2 傅里叶变换红外光谱分析 将添加不同浓度GO的PMMA样品进行傅里叶变换红外光谱分析,可检测到PMMA 和GO 官能团 如-CH2(2948 cm-1)、C=O(1717 cm-1)、C-H(1452 cm-1)、C-O-C(1179 cm-1)和C-O(1084 cm-1)的特征峰值,且四组波形未见明显差异(图2)。
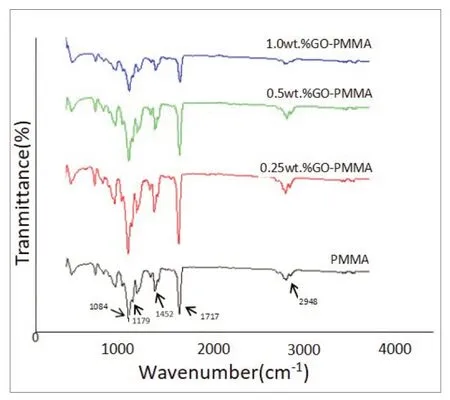
图2 添加不同浓度GO的PMMA样品傅里叶变换红外光谱图
表2 各组样品的24h、48h浸提液培养L929细胞1、3、5天后的CCK-8测试OD450值(±s)
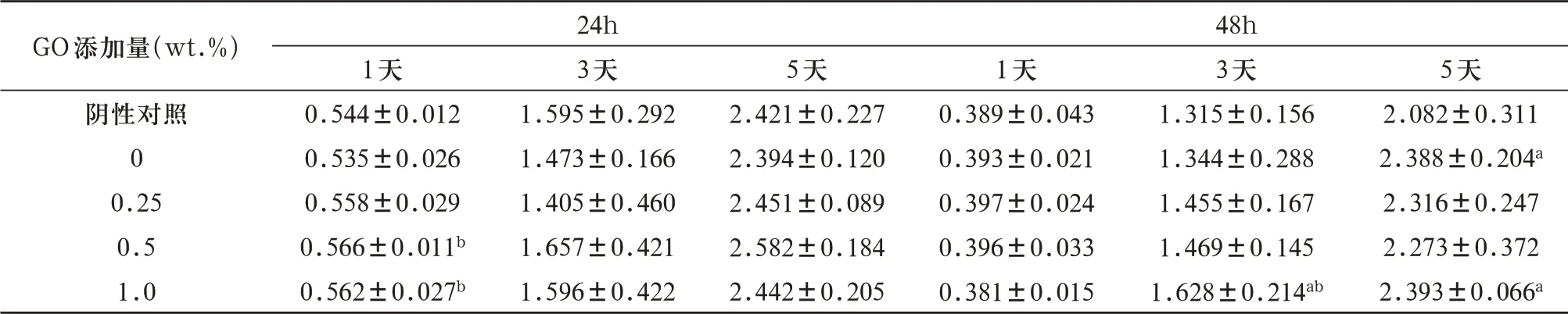
表2 各组样品的24h、48h浸提液培养L929细胞1、3、5天后的CCK-8测试OD450值(±s)
注:a:与阴性对照组相比,P<0.05;b:与阳性对照组相比,P<0.05
GO添加量(wt.%)阴性对照0 0.25 0.5 1.0 24h 3天1.595±0.292 1.473±0.166 1.405±0.460 1.657±0.421 1.596±0.422 48h 3天1.315±0.156 1.344±0.288 1.455±0.167 1.469±0.145 1.628±0.214ab 5天2.082±0.311 2.388±0.204a 2.316±0.247 2.273±0.372 2.393±0.066a 1天0.544±0.012 0.535±0.026 0.558±0.029 0.566±0.011b 0.562±0.027b 5天2.421±0.227 2.394±0.120 2.451±0.089 2.582±0.184 2.442±0.205 1天0.389±0.043 0.393±0.021 0.397±0.024 0.396±0.033 0.381±0.015
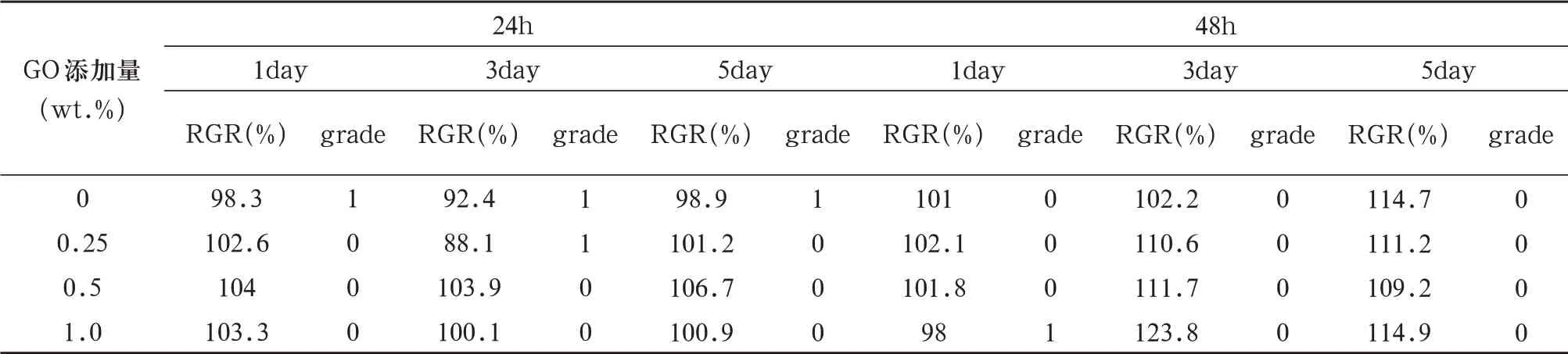
表3 各组样品的24h、48h浸提液培养L929细胞1、3、5天后的细胞相对增殖度和毒性反应分级
2.2 细胞毒性
2.2.1 CCK-8检测结果 用阴性对照组、阳性对照组(0wt.%)和各实验组样品的24h、48h浸提液培养L929细胞1、3和5天后进行CCK-8检测,OD450结果表明:样品在24h浸提液作用下,第1天观察期末各组OD450为0.535-0.566,其中0.5wt.%和1.0wt.%两组OD450值均显著高于阳性对照组(P<0.05);第3天、5天观察期末各组OD450为1.405-1.657和2.394-2.582,组间无显著差异(P>0.05)。样品在48h浸提液作用下,1天观察期末各组OD450为0.381-0.397,组间无显著差异(P>0.05);3天观察期末各组OD450为1.315-1.628,其中1.0wt.%组OD450显著高于阴性对照组和阳性对照组(P<0.05);5天观察期末各组OD450为2.082-2.393,其中0wt.%组和1.0wt.%组OD450显著高于阴性对照组(P<0.05), 见表2。
2.2.2 细胞毒性分级24h 浸提液作用1 天后,0wt.%组细胞毒性分级为1级,其余各组为0级;作用3天后,0wt.%组和0.25wt.%组细胞毒性分级为1级,其余组为0级;作用5天后,0wt.%组细胞毒性分级为1级,其余各组为0级。48h浸提液作用1天后,1.0wt.%组细胞毒性分级为1级,其余各组为0级;作用3天和5天后,各组细胞毒性分级均为0级。
2.2.3 活/死细胞双染色结果 通过荧光显微镜观察,活细胞被标记为绿色,死细胞被标记为红色(图3)。空白对照组、0wt.%、0.25wt.%、0.5wt.%、1.0wt.%组的L929细胞存活率分别为98.76%、98.85%、98.70%、98.73%、98.83%(图4),各组间无显著差异(P>0.05)。
图3 各组样品浸提液培养L929细胞2天后活/死细胞双染色观察(荧光显微镜,x100)
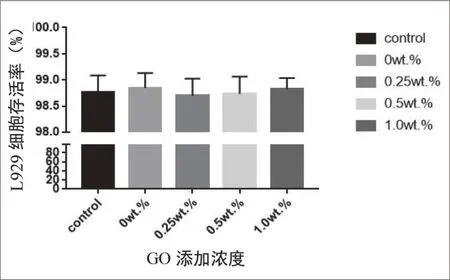
图4 各组样品浸提液培养L929细胞2天后细胞存活率
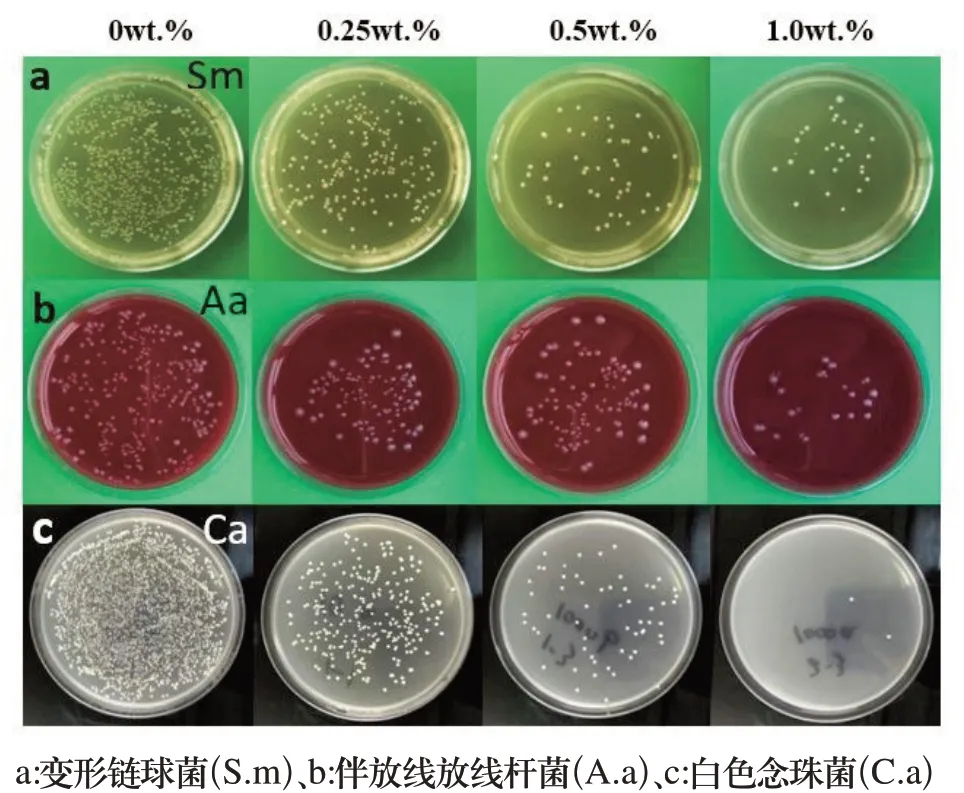
图5 各组样品对口腔3种常见致病菌的抗菌效果
2.3 抗菌性能
2.3.1 菌落计数和抗菌率 各组样品对口腔3种常见致病菌的抗菌效果显示,对照组菌落多且密集,实验组菌落少且稀疏(图5)。计算各组样品对3种菌的抗菌率,与对照组相比,实验组变形链球菌、伴放线放线杆菌和白色念珠菌的菌落数均显著降低(P<0.05),且随着GO添加浓度的依次增加,各实验组菌落数依次降低,组间有显著差异(P<0.05)。0.5wt.%组对变形链球菌、伴放线放线杆菌和白色念珠菌的抗菌率分别为92.48%、96.04%、94.01%,具有抗菌作用;1.0wt.%组对变形链球菌、伴放线放线杆菌和白色念珠菌的抗菌率分别为99.13%、99.62%、99.05%,具有强抗菌作用(表4)。
表4 各组样品对口腔3种常见致病菌的抗菌率(菌落数单位:105CFU/mL,±s)
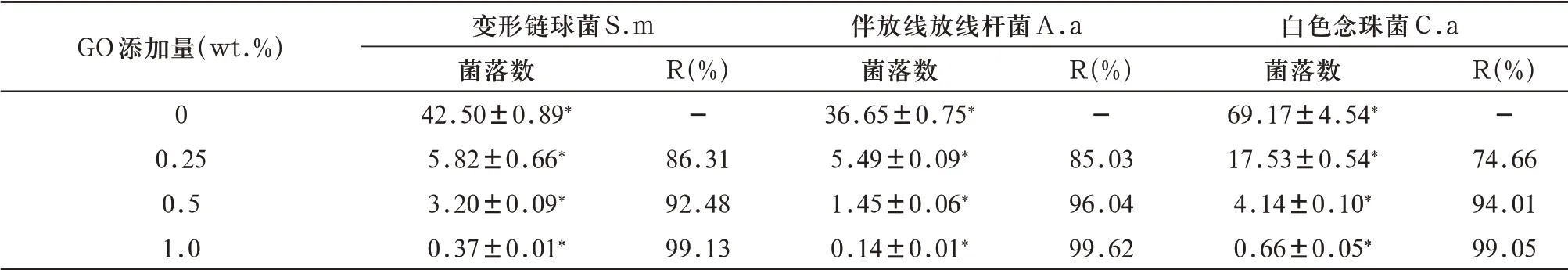
表4 各组样品对口腔3种常见致病菌的抗菌率(菌落数单位:105CFU/mL,±s)
注:*:与其他各组相比,P<0.05
GO添加量(wt.%)0 0.25 0.5 1.0变形链球菌S.m菌落数42.50±0.89*5.82±0.66*3.20±0.09*0.37±0.01*R(%)-86.31 92.48 99.13伴放线放线杆菌A.a菌落数36.65±0.75*5.49±0.09*1.45±0.06*0.14±0.01*R(%)-85.03 96.04 99.62白色念珠菌C.a菌落数69.17±4.54*17.53±0.54*4.14±0.10*0.66±0.05*R(%)-74.66 94.01 99.05
2.3.2 样品表面菌形貌 通过扫描电镜SEM观察样品表面菌形貌,变形链球菌在对照组样品表面生长良好,细菌光滑饱满呈链球状(图6a黄色箭头),而在实验组样品表细菌膜出现破裂,部分菌体被完全切割分裂(图6a红色箭头);伴放线放线杆菌在对照组样品表面生长良好,细菌呈短杆状,表面菌毛呈放射状(图6b黄色箭头),而在实验组样品表面细菌菌体变形,菌膜破裂,菌内容物外泄,呈死亡状态(图6b红色箭头);白色念珠菌在对照组样品表面生长良好,伸出真菌菌丝(图6c黄色箭头),而在对照组样品表面菌体形状畸变,菌膜凹陷破损(图6c红色箭头)。
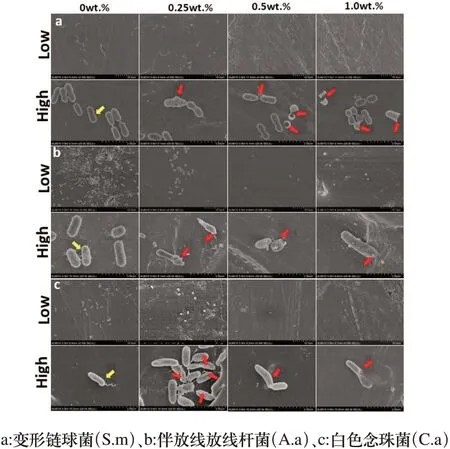
图6 各组样品表面口腔3种常见致病菌SEM形貌(Lowx3000;Highx25000)
3.讨论
义齿的清洁和抗菌是影响其使用效果的重要因素,化学法、机械法、等传统清洁方法存在刺激口腔粘膜、腐蚀金属部件、改变树脂颜色等诸多弊端[13-15]。通过向义齿基托中添加银类和光催化类(二氧化钛、氧化锌等)无机抗菌剂的方法可使其抗菌性能得到显著提升,但同时存在着细胞毒性以及对义齿机械性能产生负面影响的可能[2-4,16]。目前,兼顾生物安全性、机械性等综合性能较佳的抗菌义齿基托仍是广大学者研究的热点。
近年来研究发现,石墨烯基纳米材料(graphenebasednanomaterials,GBNs)可以通过多种机制对革兰氏阳性菌和革兰氏阴性菌[17,18]甚至真菌病原体[19]产生广谱抗菌活性。在各类GBNs 中,氧化石墨烯(Grapheneoxide,GO)因具有边缘切割效应、细胞包埋能力和氧化应激反应等多重抗菌机制[20-23],而被认为是目前最有效的新兴纳米抗菌材料[10]。本实验通过扫描电镜观察发现,实验组样品表面细菌和真菌多呈现出菌体变形、菌膜破裂等死亡状态,尤其是实验组变形链球菌出现了菌体被整齐切割分裂的现象,故猜测,本实验中GO的抗菌机制主要在于其锐利的边缘直接接触菌体并对菌膜造成物理切割损伤从而达到杀菌作用,但若要确切阐述其抗菌原理尚需日后进行更深入的机制研究。
GO片层表面和边缘富含大量含氧基团,使得其在水溶液及有机溶剂中的溶解性增大、在基体中的分散性增强,从而更易于与聚合物制备成复合材料[24],且常作为增强剂来改善材料的机械性能。但高浓度的GO分散性变差,会在聚合物基体中形成大片状类似“团聚”的现象,反而对其机械性能产生负面影响[25,26]。Paz等人[27]将GO添加至自固化PMMA中,检测结果表明,当GO 浓度为0.25wt.%时,GO-PMMA 的机械性能达到最强,而1.0wt.%GO-PMMA的机械性能出现减弱。本实验将GO添加到PMMA 中,通过扫描电镜观察到浓度低于1.0wt.%的GO可在PMMA中均匀分散,而浓度达到1.0wt.%时则出现明显团聚现象,该现象与以上研究结果相符。傅里叶光谱分析显示,添加了不同浓度GO后各组样品波形无明显改变,说明本实验采用球磨混匀法将GO添加到PMMA中属于物理性添加,二者并未产生化学键结合反应。
多数抗菌剂在产生抗菌作用的同时难免对正常细胞有毒副作用,GO也不例外[28,29]。然而有学者认为,将GO添加到到聚合物中并使其被包裹于基质内不易溶出时,GO与细胞的直接接触作用减弱,从而能降低其细胞毒性[30]。Pinto等人[31]将GO添加到聚乳酸(PLA)中制备GO/PLA复合薄膜,其上小鼠胚胎成纤维细胞的粘附和增殖甚至高于PLA薄膜。本实验通过制备各组样品24h和48h两个时间段浸提液来模拟义齿佩戴后的口腔唾液环境。CCK-8细胞增殖实验结果显示,各实验组对L929细胞增殖无抑制作用,细胞毒性评价为无毒性;活/死细胞双染色结果显示,各实验组对L929细胞活性无影响。分析其原因,可能是因为GO被包裹于PMMA基质中不易溶出,各组样品浸提液中GO含量较少从而没有产生明显的细胞毒性。
本实验采用薄膜密贴法将实验菌液与基托表面直接接触,模拟了临床中细菌菌斑沉积于义齿基托表面的情景。抗菌检测结果显示,与对照组相比,各实验组对变形链球菌、伴放线放线杆菌和白色念珠菌均具有显著抗菌作用,且随着GO添加浓度的增加,抗菌作用得到增强。同样的,Lee 等人[32]实验证明,将GO 添加到树脂基质中可表现出对白色念珠菌生长和粘附的显著抑制作用;Bregnocchi 等人[33]研究发现添加GO 的树脂粘结剂对变形链球菌的粘附、生长及生物膜的形成均具有显著的抑制作用;He 等人[17]研究发现,GO 可显著抑制变形链球菌、牙龈普林单胞菌和具核杆菌的生长,且GO 浓度越高,抗菌作用越强。在本实验中,0.5wt.%组可报告为“具有抗菌作用”,1.0wt.%组可报告为“具有强抗菌作用”。结合GO 添加浓度为0.5wt.%时尚未出现团聚现象,将有利于PMMA 机械性能的提升,且GO 添加浓度越高对PMMA 树脂颜色影响越大,综合抗菌性能、机械性能以及颜色美观考虑,本研究认为GO 添加量为0.5wt.%时最合适。
本实验结果表明,添加0.5wt.%GO的PMMA义齿基托树脂对口腔常见致病菌具有显著抗菌作用并且无细胞毒性,这在指导抗菌义齿的研发方面具有很大的研究意义,相信随着该研究技术的成熟与改进,添加GO的PMMA有望应用于临床成为新型抗菌义齿基托材料。未来添加GO的义齿基托颜色的改善、抗菌长效性的检验、抗菌机制的研究以及一系列生物安全性评价等仍需进一步深入。

