重组改构人肿瘤坏死因子雾化吸入联合化疗治疗非小细胞肺癌的疗效研究
江泷,何健行
广州医科大学附属第一医院胸外科,广州 510120
原发性肺癌是临床最常见的胸部恶性肿瘤之一,据2018年的统计资料显示,中国2014年肺癌新发病例和死亡病例分别高达78.2万、62.6万,在发病率方面,居恶性肿瘤前位(男性首位,女性第二位,仅次于乳腺癌),而不论男性还是女性,病死率均居首位[1]。根据病理类型,肺癌可分为小细胞肺癌(small cell lung cance,SCLC)与非小细胞肺癌(non-small cell lung cancer,NSCLC),其 中 以NSCLC最常见,占80%~85%。由于肺癌早期症状不明显且无特异性,故而在初诊时大多数患者已进展至中晚期,化疗作为全身治疗手段是此类患者的主要治疗选择。在中国,一线化疗方案以吉西他滨、紫杉醇等联合铂类的含铂双药方案最常见[2]。重组改构人肿瘤坏死因子(recombinant mutant human tumor necrosis factor,rmhTNF)属广谱抗肿瘤药物,自2004年获批在中国上市,单药或联合化疗治疗NSCLC[3]。Kuehl等[4]报道显示,雾化吸入是一种低不良反应、高效、无创的给药方式,在肺癌治疗中的应用效果优于静脉给药,可作为肺癌靶向给药的重要方式。为此本研究以NSCLC患者为研究对象,探讨NSCLC应用rmhTNF雾化吸入联合一线化疗方案治疗的临床效果,现报道如下。
1 对象与方法
1.1 研究对象
选取2016年5月至2018年5月广州医科大学附属第一医院收治的118例NSCLC患者为研究对象。纳入标准:①符合NSCLC诊断标准[5],TNM分期为ⅢB、Ⅳ期;②年龄18~75岁;③无药物过敏史;④具有一定文化程度,能独立完成癌症治疗性功能评价量表-肺癌(FACT-L)调查;⑤预期生存期>3个月;⑥无第二原发肿瘤;⑦入组前未经任何抗癌治疗或距上次放化疗、抗血管生成药物等相关抗癌治疗结束>3个月。排除标准:①卡氏功能状态(Karnofsky performance status,KPS)评分<60分;②过敏体质;③无法耐受全身化疗;④孕妇或哺乳期妇女;⑤伴有感染、带状疱疹等其他不宜使用卡铂治疗的疾病;⑥合并恶病质、骨髓抑制、肝肾功能不全或心肺功能异常;⑦有智力或意识障碍;⑧有胃肠道出血倾向或穿孔倾向;⑨合并恶性胸腹腔积液。118例NSCLC患者中,男77例,女41例;年龄28~75岁,平均(58.65±7.57)岁;组织学分型:大细胞癌15例,鳞状细胞癌37例,腺癌66例;体表面积1.3~2.1 m2,平均(1.68±0.17)m2。采用随机数字表法将118例NSCLC患者分为观察组(n=59)和对照组(n=59)。观察组中,男37例,女22例;年龄29~75岁,平均(59.32±7.64)岁;组织学分型:大细胞癌6例,鳞状细胞癌17例,腺癌36例;体表面积1.3~2.1 m2,平均(1.64±0.18)m2。对照组中,男 40例,女19例;年龄28~75岁,平均(58.10±7.22)岁;组织学分型:大细胞癌9例,鳞状细胞癌20例,腺癌30例;体表面积1.3~2.0 m2,平均(1.69±0.15)m2。两组患者基线特征比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过。
1.2 治疗方法
对照组采取吉西他滨+卡铂(GP)化疗方案治疗;盐酸吉西他滨1000 mg/m2静脉滴注0.5 h,d 1、d 8;卡铂400 mg静脉滴注1 h,d 1;每21天为一个疗程,共进行4个疗程。观察组在对照组基础上联合rmhTNF雾化吸入治疗,每次将100万U rmhTNF+20 ml生理盐水均匀混合后,采取医用超声雾化器雾化吸入给药,每天2次,d 3~7;每21天为一个疗程,共进行4个疗程。每次雾化吸入后均应立即漱口、洗脸。连用4个化疗周期后观察两组疗效。围治疗期常规监测患者的生命体征,并采取相同的化疗不良反应防治、营养支持、重要脏器保护及健康教育(如饮食指导、生活方式调整)等基础治疗。
1.3 观察指标
①疗效评价标准[6]:完全缓解(CR),连续4周无任何可见肿瘤病灶;部分缓解(PR),全部肿瘤病灶连续4周缩小≥30%,但无新病灶产生;疾病稳定(SD),非PR/疾病进展(PD);PD,有新病灶,或原肿瘤病灶增大≥20%。客观缓解率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,临床获益率(clinical benefit rate,CBR)=(CR+PR+SD)例数/总例数×100%。②肿瘤标志物水平测定:分别于治疗前及治疗4个周期后采取患者两管静脉血,每管3 ml,其中一管血液样本用于制备血清标本,以检测相关肿瘤标志物[糖类抗原15-3(car-bohydrate antigen 15-3,CA15-3)、癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)]血清浓度,另一管血液样本用于分析调节性T细胞(regulatory T cell,Treg)和辅助性T细胞(helper T cell,Th)17的表达情况;CA15-3、CEA、CA125均使用化学发光法测定,仪器为化学发光免疫分析仪,操作按说明书进行。③Treg、Th17水平检测:将收集的静脉血样本用于常规制备外周血单个核细胞(peripheral blood mononuclear cell,PBMC)标本,经洗涤后再用RPMI1640培养液将PBMC浓度调整为2×106/ml,流式细胞仪检测,利用配套软件NovoExpress对实验数据进行分析,外周血中Treg(即CD4+CD25+Foxp3+细胞占CD4+细胞的百分比)、Th17(即CD3+CD8-IL-17A+细胞占CD3+CD8-细胞的百分比)的检测结果由数据分析软件自动生成,最后计算Treg/Th17比值。④癌症治疗性功能评价量表-肺癌(functional assessment of cancer therapy-lung cancer,FACT-L)[7]:本量表共包括5个领域(36个条目),即生理状况(7个条目)、情感状况(6个条目)、社会/家庭状况(7个条目)、功能状况(7个条目)、肺癌附加的关注(9个条目),每个条目均采用5级评分(0~4分),得分越高说明患者此方面的状况越佳,FACT-L总分为各领域评分之和。⑤不良反应评价[8]:根据国立癌症研究所通用毒性标准3.0版(the National Cancer Institute’s-the common toxicity criteria 3.0,NCICTC 3.0)对患者用药期间产生的不良反应(消化道反应、骨髓抑制、肝肾功能损害等)进行详细评估与记录。
1.4 统计学分析
采用SPSS 18.0统计软件进行数据处理,计数资料以例数及率(%)表示,组间比较采用χ2检验,等级资料的比较采用Wilcoxon秩和检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组患者的ORR、CBR分别为52.5%(31/59)、81.4%(48/59),均高于对照组的 33.9%(20/59)、64.4%(38/59),差异均有统计学意义(χ2=4.179、4.288,P<0.05)。(表1)
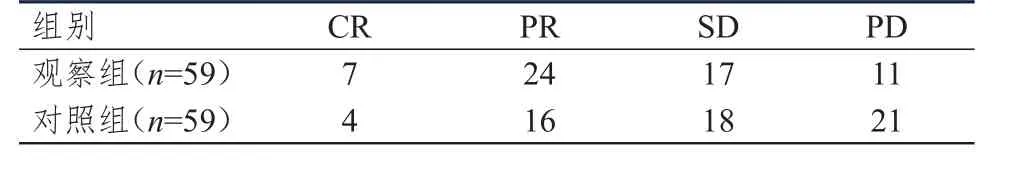
表1 两组患者的临床疗效
2.2 肿瘤标志物水平的比较
治疗前,两组患者CA15-3、CEA、CA125水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者CA15-3、CEA、CA125水平均较治疗前明显下降,且观察组患者CA15-3、CEA、CA125水平均明显低于对照组,差异均有统计学意义(P<0.01)。(表2)

表2 两组患者肿瘤标志物水平的比较
2.3 外周血中Th17和Treg 细胞水平的比较
治疗前,两组患者Treg、Th17、Treg/Th17水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者Treg、Th17、Treg/Th17水平均较治疗前下降,且观察组患者Treg、Th17、Treg/Th17水平均低于对照组,差异均有统计学意义(P<0.05)。(表3)

表3 两组患者外周血中Treg和Th17细胞水平的比较
2.4 FACT-L评分的比较
治疗前,两组患者FACT-L中各领域(生理状况、情感状况、社会/家庭状况、功能状况、肺癌附加的关注)评分及总分比较,差异均无统计学意义(P>0.05);治疗后,两组患者生理状况、情感状况、社会/家庭状况、功能状况、肺癌附加的关注评分及总分均较治疗前上升,且观察组患者均高于对照组,差异均有统计学意义(P<0.05)。(表4)
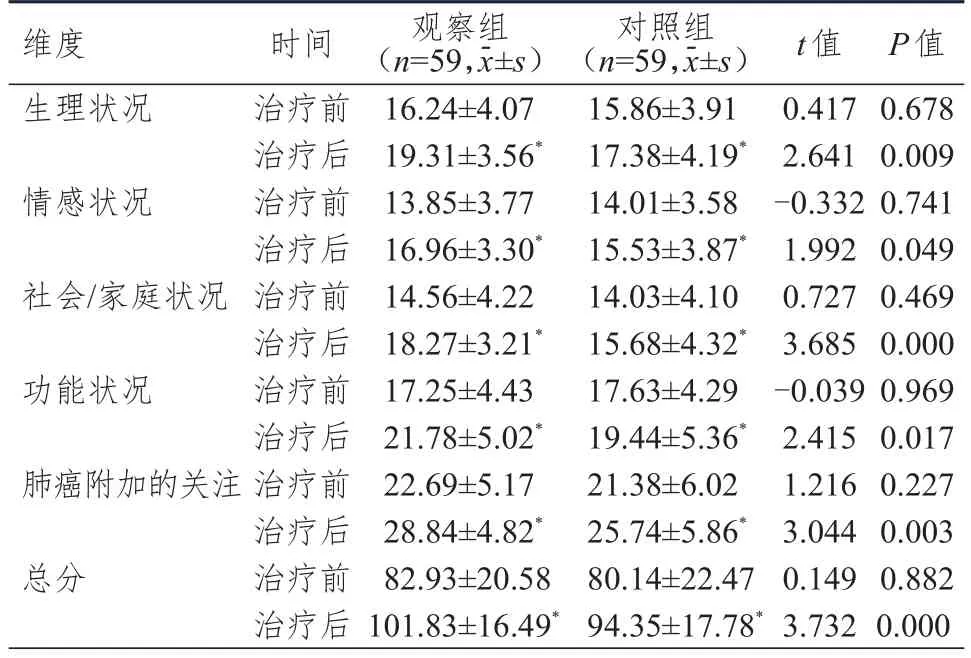
表4 两组患者FACT-L评分的比较
2.5 不良反应发生情况的比较
两组患者消化道反应、骨髓抑制、肝肾功能损害、过敏反应、口腔溃疡不良反应发生情况比较,差异均无统计学意义(P>0.05)。(表5)
3 讨论
肺癌是中国最常见的恶性肿瘤之一,其病因较多,现代医学认为肺癌的发生与吸烟、电离辐射、驱动基因[间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合基因、表皮生长因子受体(epidermal growth factor receptor,EGFR)突变基因等]、职业和环境接触、既往肺部慢性感染、大气污染等有关。其中NSCLC是肺癌最常见的病理类型,本病早期一般无明显症状,随病情逐渐发展,患者可出现刺激性干咳、胸痛、气促、痰中带血或血痰、骨痛等症状[9]。化疗已成为NSCLC临床治疗的重要选择,其应用的基本共识为早期NSCLC可考虑辅助化疗,局部晚期NSCLC宜采取辅助化疗、新辅助化疗或同步放化疗,而晚期NSCLC可采取姑息化疗。吉西他滨联合卡铂作为标准双药联合含铂方案现已普遍应用于治疗NSCLC,前者属细胞周期特异性抗肿瘤药,能通过阻断脱氧核糖核酸(DNA)合成的G1期向S期过渡进程、杀伤处于S期的细胞等多种途径,发挥细胞毒活性作用;后者为周期非特异性抗肿瘤药,主要可通过直接作用于DNA,对分裂旺盛的肿瘤细胞进行抑制[10]。
rmhTNF为肿瘤生物免疫治疗药物,其抗肿瘤作用机制主要有:①与受体TNF-R结合,从而可诱导并加速肿瘤细胞凋亡;②通过增强机体免疫功能(包括体液免疫及细胞免疫等),促进自然杀伤(natural killer,NK)细胞、T细胞等免疫效应细胞对肿瘤细胞的杀伤;③可逆转肿瘤细胞多药耐药,使其化疗敏感性增加;④能特异性地直接抑制肿瘤细胞增殖或将其杀死;⑤抗肿瘤血管生成;⑥通过作用于肿瘤血管内皮细胞(vascular endothelial cell,VEC),引起VEC损伤,并可造成血管功能紊乱,进而破坏肿瘤血管,诱导血栓形成,最终使肿瘤组织因局部血流障碍而发生缺氧、出血坏死[11]。目前rmhTNF在临床上主要是采用单药或联合化疗的方案用于治疗晚期NSCLC,且以静脉滴注和肌内注射给药为主。而患者即使短疗程静脉滴注或肌内注射rmhTNF,近期不良反应仍较多,主要表现为发热、注射局部疼痛、骨肌肉样疼痛、感冒样症状、局部红肿硬结等。一项系统评价显示晚期NSCLC应用rmhTNF联合常规化疗治疗有利于改善患者生活质量及一般状况,在疗效方面是值得肯定的[12]。既往研究证实雾化吸入给药方式具有用药剂量少、全身药物浓度低但病灶局部浓度高(符合精准医疗的理念)、作用直接、起效快及不良反应少且轻微等诸多优势[13]。为此本研究考虑通过超声雾化吸入法将rmhTNF与一线化疗方案联合用于治疗NSCLC,以期尽可能提高治疗效果,并最大限度地减轻药物不良反应。
CA15-3、CA125均属于糖类抗原,广泛存在于肺癌、肝癌等各类肿瘤组织中;CEA属非器官特异性肿瘤相关抗原,是一种来源于胚胎黏膜和结肠、直肠癌细胞膜上的广谱肿瘤标志物,约45%的中晚期肺癌患者血中CEA会明显升高。因此CA15-3、CA125、CEA可作为监测NSCLC治疗反应的重要辅助指标,其联合检测有助于提高患者预后评估的特异度及灵敏度[14]。随着医学模式的转变、健康观念的更新及疾病谱的改变,近年来,对肿瘤患者生活质量的评估已成为医学界的焦点,能否提高肿瘤患者的生活质量是其治疗方案选择须重点考虑的因素之一。FACT-L是一个自评式量表,潘雁等[7]研究表明FACT-L中文版具有较好的重测信度(γ>0.8)、反应度、内部一致性(Cronbach’s α系数>0.6)与结构效度,能较为准确地反映中国肺癌患者放化疗前后的生活质量状况变化。本研究中观察组治疗后ORR(52.5%)、CBR(81.4%)均明显高于对照组(33.9%、64.4%),且治疗后血清相关肿瘤标志物水平较对照组同期均显著更低,而FACT-L中各领域评分及总分均显著更高;提示NSCLC采取rmhTNF雾化吸入辅助治疗能明显控制患者病情,提高治疗效果。从用药安全性的角度分析,本研究中两组患者各项药物不良反应在分级上差异不明显,rmhTNF雾化吸入相关的不良反应主要表现为口腔溃疡,且仅有3例患者(5.1%),皆为Ⅰ级,无需特殊处理,亦不影响化疗进度。说明雾化吸入rmhTNF在增效的同时,并不明显增加NSCLC患者治疗的不良反应,是一种安全、有效的辅助治疗手段。
Treg、Th17细胞是一对在功能上相互制衡的免疫细胞,正常生理状态下,两者以一定的比例动态维持着机体免疫稳态,而在NSCLC肿瘤微环境下这种平衡被打破,患者呈现出外周血中Treg、Th17细胞水平虽均上升,但以Treg细胞更占优势,从而造成体内免疫耐受增强,营造出利于肿瘤生长、侵袭及转移的免疫微环境,可见Treg/Th17失衡可能是NSCLC重要的发病机制之一[15]。本研究中观察组患者治疗后外周血Treg和Th17细胞比例及Treg/Th17比值较对照组同期均显著更优,提示加用rmhTNF雾化吸入治疗NSCLC在调控机体免疫稳态方面优势突出。分析原因可能与rmhTNF具有诱导树突状细胞成熟、激活T细胞等免疫调节作用有关,但其具体作用机制有待进一步探讨。
综上所述,NSCLC应用rmhTNF雾化吸入辅助治疗可明显控制患者病情,纠正体内Treg/Th17免疫失衡,提高生活质量,效果切实,且患者耐受性好,值得临床推广应用。

