白蛋白紫杉醇治疗复发性广泛期小细胞肺癌的疗效观察*
徐朝久,赵景胜,陈超英,龙 剑,梁 静
(湘西自治州人民医院肿瘤科,湖南 吉首 416000)
小细胞肺癌(small-cell lung cancer,SCLC)为肺癌中恶性程度最高、预后最差的病理类型.小细胞肺癌对一线化疗敏感,但多数患者会在短期内复发或转移,2年生存率为20%左右.二线化疗用药的疗效较差,单药有效率在10%~30%之间,联合化疗的有效率也不足40%,且缓解期较短,中位总生存时间不足4个月.因此,筛选高效低毒的化疗新药尤为重要.白蛋白结合型紫杉醇(nab-Pacilitaxel, Abraxane)是一种新型的紫杉醇制剂,无需蓖麻油作为助溶剂,因此可以减少传统紫杉醇常见的毒性反应,同时其特殊结构可以通过内源性白蛋白通路使得更多的紫杉醇进入到肿瘤组织,从而发挥抗肿瘤作用[1].III期临床研究显示,其疗效明显优于传统的紫杉醇制剂[2].紫杉醇先后于2012年被美国FDA、2015年被欧洲批准用于非小细胞肺癌(non-small-cell lung cancer,NSCLC)的治疗.另外,也有相关研究显示白蛋白结合型紫杉醇单药对小细胞肺癌的二线治疗有一定的临床疗效[3].本研究中,笔者拟对24例使用白蛋白结合型紫杉醇治疗的复发性小细胞肺癌病例进行回顾性分析,以探讨白蛋白结合型紫杉醇治疗复发难治性小细胞肺癌的临床疗效及毒副反应,为进一步临床应用和研究提供参考.
1 患者资料
1.1 基线特征
2017年6月至2019年6月在湘西自治州人民医院经细胞学或组织学确诊的复发性广泛期小细胞肺癌患者24例.其中:患者年龄45~77岁,中位年龄65岁;男性18例,女性6例;患者ECOG行为状态PS评分0~1分13例, 2分7例, 3分4例.一线治疗后无进展生存时间(progression-free survival)PFS≥3个月16例,PFS<3个月8例;治疗后复发转移1~2个部位15例,转移3~5个部位9例.患者的基线特征详见表1.

表1 患者基线特征 (n=24)Table 1 Baseline Characteristics of Patients (n=24)
1.2 入组标准
(1)年龄不小于18岁的组织学或细胞学确诊为小细胞肺癌患者,影像学检查证实为广泛期,即病变超出同一侧胸腔,包括恶性胸腔、心包积液及远处转移.病灶可测量或不可测量.(2)ECOG行为状态(PS)评分0~3 分.(3)接受过一线化疗,且一线治疗PFS<6个月.(4)具有良好的骨髓造血功能和肝肾功能,ANC≥1.5×109/L,PLT≥100×109/L,Hb≥90 g/L, ALT,AST≤2.5 倍正常值上限(无肝转移病例),或ALT,AST≤5倍正常值上限(肝转移病例),肌酐≤1.5 倍正常值上限、总胆红素正常.(5)预计生存时间≥3个月.(6)签署肿瘤化疗同意书.
2 治疗方法
2.1 一线治疗方案
依托泊苷+顺铂12例(50.0%),具体剂量:顺铂60~75 mg/m2d1,依托泊苷120 mg/m2,d1—3.依托泊苷+卡铂7例(29.2%),具体剂量:依托泊苷120 mg/m2,d1—3,卡铂AUC 5~6 d1.伊立替康+顺铂3例(12.5%),具体剂量:伊立替康60 mg/m2d1,8,15,顺铂60 mg/m2d1或伊立替康65 mg/m2d1,8,顺铂30 mg/m2d1,8.伊立替康+卡铂2例(16.7%),具体剂量:伊立替康50mg/m2d1,8,15,卡铂 AUC 5 d1.
一线治疗PFS≥3个月的16例(66.7%),PFS<3个月的8例(33.3%).当一线治疗出现进展时,改用静脉注射白蛋白紫杉醇(130 mg/m2d1,8,15),28天为1个疗程,直至出现肿瘤进展.当出现不良事件时,允许暂停给药或减量给药.
2.2 观察指标
无进展生存时间(progression-free survival,PFS),即开始二线治疗至疾病出现进展或末次随访时间;中位无进展生存时间(median progression-free survival, mPFS),即累及疾病进展率为0.5时所对应的时间;总生存时间( overall survival, OS),即指开始二线治疗至死亡或末次随访时间;中位总存时间(median overall survival,mOS),即累及疾病死亡率为0.5时所对应的时间.
2.3 疗效及不良反应评价
所有患者均行基线评估检查,包括体查和胸部X线或CT、全腹部彩超或增强CT、脑MRI及全身骨扫描等影像学检查.每周期化疗前,均需行体查、血常规、肝肾功能、电解质及心电图等检查.
按WHO 实体瘤疗效评价标准(RECIST标准)[4], 每2个疗程评价1次疗效.疗效分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD).客观缓解率(objective response rate)ORR=(CR+PR)/(CR+PR+SD+PD),疾病控制率(disease control rate)DCR=(CR+PR+SD)/ (CR+PR+SD+PD).根据不良事件通用术语标准(CTCAE 3.0)评价不良反应.
2.4 统计学分析
采用SPSS 24.0软件进行统计学分析,通过独立样本非参数检验计算一般资料对疗效的影响,采用Kaplan-Meier 法计算mPFS和mOS.
3 结果
3.1 治疗结果
表2列出使用白蛋白紫杉醇治疗复发性广泛期小细胞肺癌的治疗结果,可评价疗效患者24例,其中CR 0例,PR 8例(33.3%),SD 7例(29.2%),PD 9例(37.5%),ORR 33.3%,DCR 62.5%.
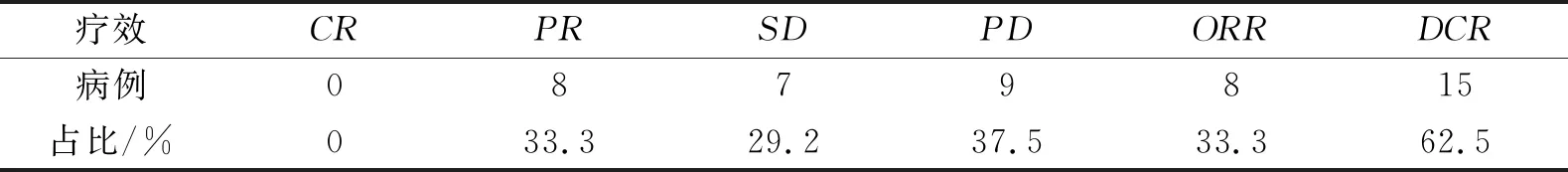
表2 治疗结果Table 2 Results of Treatment
3.2 疗效评价
表3列出复发性广泛期小细胞肺癌的疗效评价.

表3 治疗效果评价(n=24例)Table 3 Evaluation of Treatment Effect (n=24)
由表3统计结果可知:患者的性别、年龄、PS评分、转移部位数对治疗疗效无显著显著影响,差异不具统计学意义(P>0.05);一线化疗的FPS时间对疗效有显著影响,差异具有统计学意义(P<0.05).
3.3 mPFS和mOS
白蛋白紫杉醇治疗复发性广泛期小细胞肺癌患者的中位无进展生存时间(mPFS)和中位总生存时间(mOS)分别如图1和图2所示.由图1和图2可知,24例患者的mPFS为3.6个月,mOS为8.3个月.
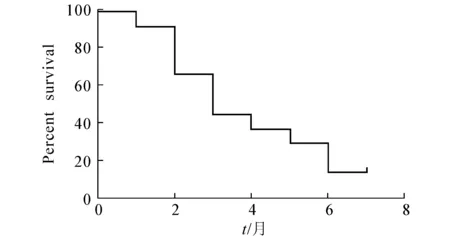
图1 中位无进展生存时间Fig. 1 Median Progression-Free Survival (mPFS)
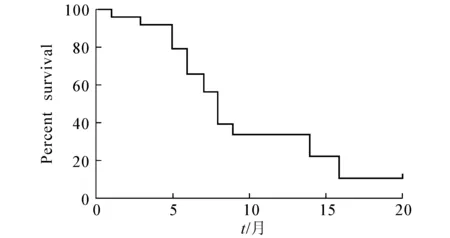
图2 中位总生存时间Fig. 2 Median Overall Survival (mOS)
3.4 不良反应
表4列出白蛋白紫杉醇治疗复发性广泛期小细胞肺癌的不良反应结果.
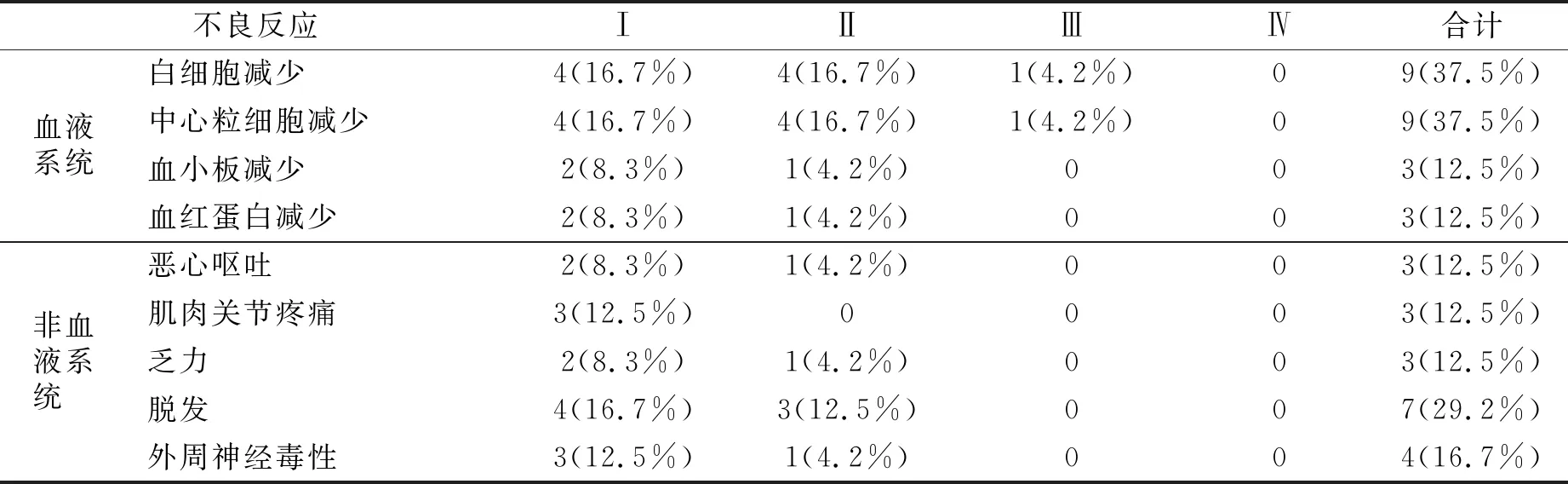
表4 患者的不良反应(n=24)Table 4 Adverse Reactions of Patients (n=24)
由表4可知:白蛋白紫杉醇治疗复发性广泛期小细胞肺癌引起的血液系统毒性不良反应主要为白细胞减少和中性粒细胞减少.24例患者中,白细胞减少9例,占比37.5%;中性粒细胞减少9例,占比37.5%.其中出现Ⅲ度骨髓抑制1例,占比4.17%,未出现Ⅳ度骨髓抑制.非血液系统不良反应主要表现为脱发和外周神经毒性.24例患者中,脱发9例,占比29.2%;外周神经毒性4例,占比16.7%.经对症治疗后,不良反应均有所好转,达到化疗前指标,未出现严重的不良事件.
4 讨论
小细胞肺癌(SCLC)是对放化疗高度敏感的恶性肿瘤,一线化疗缓解率高,但容易产生耐药性,导致缓解期短,预后差.目前临床上对SCLC特别是复发性广泛期SCLC的二线化疗方案及其疗效和安全性的研究报道较少.多数观点认为,SCLC一线化疗失败后采用二线化疗方案能为患者带来有限的生存获益.有报道使用拓扑替康、氨柔比星、依托泊苷、伊立替康和吉西他滨等药物进行复发性SCLC的二线治疗,但其中ORR仅为20%左右,mPFS 2~3.5个月,mOS 4~6个月[5-8].笔者曾使用伊立替康联合顺铂治疗复发性SCLC,有效率达38.5%,但毒副反应较重[9].
白蛋白结合型紫杉醇是一种无需助溶剂的新型紫杉醇制剂.III期研究显示,与传统的紫杉醇制剂比较,白蛋白紫杉醇可以明显提高多种恶性肿瘤的ORR,也是局部晚期NSCLC的一线治疗选择之一.国内外一些回顾性分析显示,白蛋白结合型紫杉醇二线治疗NSCLC的ORR可以达到20%~30%,明显高于标准二线化疗药物多西紫杉醇[10],即使对多线治疗的患者,也能获得18.8%的有效率[11].一项来自日本的研究显示,对于二线治疗失败的难治或复发的SCLC,应用白蛋白紫杉醇单药治疗,ORR能达到33%[12].另一项同样是日本的研究显示,用白蛋白紫杉醇治疗复发性SCLC的,其RR,DCR,mOS分别为36%,64%和7.8个月[13].在本研究中,用白蛋白紫杉醇二线治疗复发性广泛期SCLC患者24例,结果显示ORR为33.3%,DCR为62.5%,mPFS为3.6个月,mOS为8.3个月,与国外报道的结果相似,优于传统的二线化疗疗效.患者未出现IV度血液系统毒性,仅1例出现III度血液系统毒性不良反应,脱发、外周神经毒性及消化道反应均能耐受.
Mu等[14]研究指出,不同的SCLC复发类型对一线化疗失败后接受二线化疗患者的生存期产生影响,敏感型复发患者较接受相同二线化疗治疗的、难治及耐药性复发患者生存期延长0.4~0.8个月. 本研究按PFS 3个月将病例分为2组.PFS≥3个月组PR 8例,SD 5例,PD 3例;PFS<3个月组PR 0例,SD 2例,PD 6例.2组差异具有统计学意义.但由于本研究属于小样本研究,误差较大,故未进行OS比较,有待在下一步研究中明确.

