七氟醚对C57小鼠海马基因表达的影响
韩晓丹, 孙敏莉
复旦大学附属中山医院麻醉科,上海 200032
七氟醚是目前麻醉中应用最广泛的吸入性麻醉药,具备血气分配系数低、肝肾损害小和体内代谢程度低等优点,多年来一直用于小儿麻醉的诱导和维持[1]。2017年FDA发布了一项药物安全性通告:即警告3岁以下婴幼儿接受手术或医疗操作期间,重复或长时间使用七氟醚可能会影响小儿脑发育[2]。本课题组前期研究发现:新生小鼠(P7)多次暴露于七氟醚,其成年后空间学习记忆能力受损,明确七氟醚影响记忆的形成[3]。多项研究表明,早期暴露于七氟醚会导致发育期的海马神经元发生凋亡,同时出现持续的学习能力下降和记忆缺失[4-7],但是目前细胞和分子机制尚未完全阐明。
基因组微阵列技术的快速发展,使得我们能够广泛地分析细胞和组织中基因表达的变化。最近的研究表明,七氟醚可调节全脑和其他器官(如血液、心脏、肺)中多种基因的表达[8-10]。为了探讨七氟醚神经毒性的机制,需要研究与学习记忆过程相关的海马区基因表达的变化。本研究旨在通过微阵列分析来探讨七氟醚对小鼠海马基因组表达的影响。
1 材料与方法
1.1 动物和七氟醚麻醉 12只出生第7天(P7)雄性C57BL/6小鼠(体质量3~5 g,中山医院动物实验中心)随机分为重复七氟醚麻醉组(RS组,n=6)和空气对照组(C组,n=6)。将小鼠置于塑料容器中,连续5 d暴露于2.5%七氟醚(日本大阪Maruishi制药公司)或空气2 h/d,气体流速为2 L/min。实验过程中用加热垫将容器加热至37℃,使用气体监测仪(Datex CardiocapⅡ,Datex Ohmeda,Madison,WI,USA)监测容器中七氟醚、氧气和二氧化碳的浓度。实验后小鼠回到母鼠的笼子里,保持12 h的光/暗循环,且可以获得足够的食物和水。第5天暴露2 h后处死小鼠,提取海马组织并立即冷冻在-80℃为RNA分离做准备。
1.2 7 d龄小鼠海马的提取 实验中使用带倒刺的眼科镊撕开小鼠脑外皮,进而撕开头骨,取出大脑。剥开大脑,寻找外表面脑沟中间大概海马伞位置,用手术剪取出海马体,用PBS冲洗2遍后,洗去血液至澄清。剪出一部分海马组织进行RNA抽提,剩下组织放入冻存管中,于-80℃冰箱中冻存。
1.3 RNA分离与微阵列分析 实验中用Trizol法提取每个海马组织的总RNA,用紫外分光光度法测定总RNA含量,用1%琼脂糖凝胶电泳确定RNA质量。对抽提的RNA进行OD260/OD280检测,结果表明小鼠海马对照组以及实验组的RNA OD260/OD280比值均在1.85~2.0。我们进而在QIAxcel仪器中进行RNA质检,发现上述RNA的18S和28S均有峰值(图1),表明上述RNA质量良好,符合下一步基因芯片实验。
实验中利用Affymetrix小鼠基因组230 2.0阵列(天津生物芯片公司,中国天津)进行基因表达分析。基因微阵列在单个阵列上提供了转录小鼠基因组的全面覆盖,包含31 000多个探针集,可以分析30 000多个转录基因和28 000多个经证实的变异基因。应用Affymetrix微阵列Syite软件(MAS version 5.0)对每个探针组的信号进行可靠性分析。收集6只RS组和6只C组小鼠的RNA,分别与微阵列杂交3次。根据Affymetrix协议,使用推荐的设备进行标记杂交和扫描。用链霉亲和素-藻红蛋白染色法检测杂交RNA。使用3000 7G/4C扫描仪扫描微阵列,使用微阵列套件软件(5.0版)处理数字化图像数据。利用Affymetrix基因芯片3000-TG系统对微阵列数据进行质量控制试验,最终获得基因表达谱。根据这些变化计算RS组和C组小鼠海马差异表达基因的比率概率,P<0.05的基因被认为是差异表达的基因,同时进行差异基因的功能分类和信号通路分析。
1.4 反转录聚合酶链反应(RT-PCR) 对用于微阵列分析的RS组和C组小鼠的总RNA进行以下处理。在反转录之前,利用DNase(TaKaRa,Shiga,Japan)清除可能被污染的残余基因组DNA。1 μg RNA提取物在37℃下于20 μL反应混合物中逆转录15 min,该反应混合物包含小鼠Meloney白血病病毒反转录酶、2.5 μmol/L六核苷酸随机引物和2.5 μmol/L寡糖(dT)18,使用了primescript RT试剂盒(TaKaRa,Shiga,日本)。
相对定量PCR(real-time PCR)可以在不同条件下对大多数差异基因的表达进行鉴定和研究,PCR反应每20 μL包含2 μL cDNA模板、0.4 μmol/L前向引物、0.4 μmol/L反向引物,使用Platinum SYBR Green qPCR superMixUDG试剂盒(Invitrogen,Carlsbad,CA,USA)。PCR条件为:50℃扩增2 min,95℃扩增10 min,95℃扩增15 s,60℃扩增30 s,70℃扩增20 s,所有的基因特异性引物见表2。
以甘油醛-3-磷酸脱氢酶(GAPDH)cDNA扩增为内对照,未知样品和内控样品一式三份,该分析使用了能够实时测量荧光的仪器(Thermo Fisher Scientific,Waltham,MA,USA)。PCR的结果表示为阈值周期(Ct)值,其中Ct是一个无单位值,定义为样本荧光信号在基线以上通过固定阈值的分数周期数。所有mRNAs的相对微分比通过比较Ct法(Thermo Fisher Scientific,Waltham,MA,USA)计算,使用方程2-ΔΔCt(其中ΔCt为未知样本与GAPDH对照组的Ct值之差,而ΔΔCt为配对样本之差,即ΔΔCt=C组样本ΔCt值-RS组样本的ΔCt值)。由于操作不准确,三份结果中明显不同的值会被省略。在实际操作中,如果Ct值与其他两个值不同,并且两者的平均值相差1.00或以上,则省略该值。
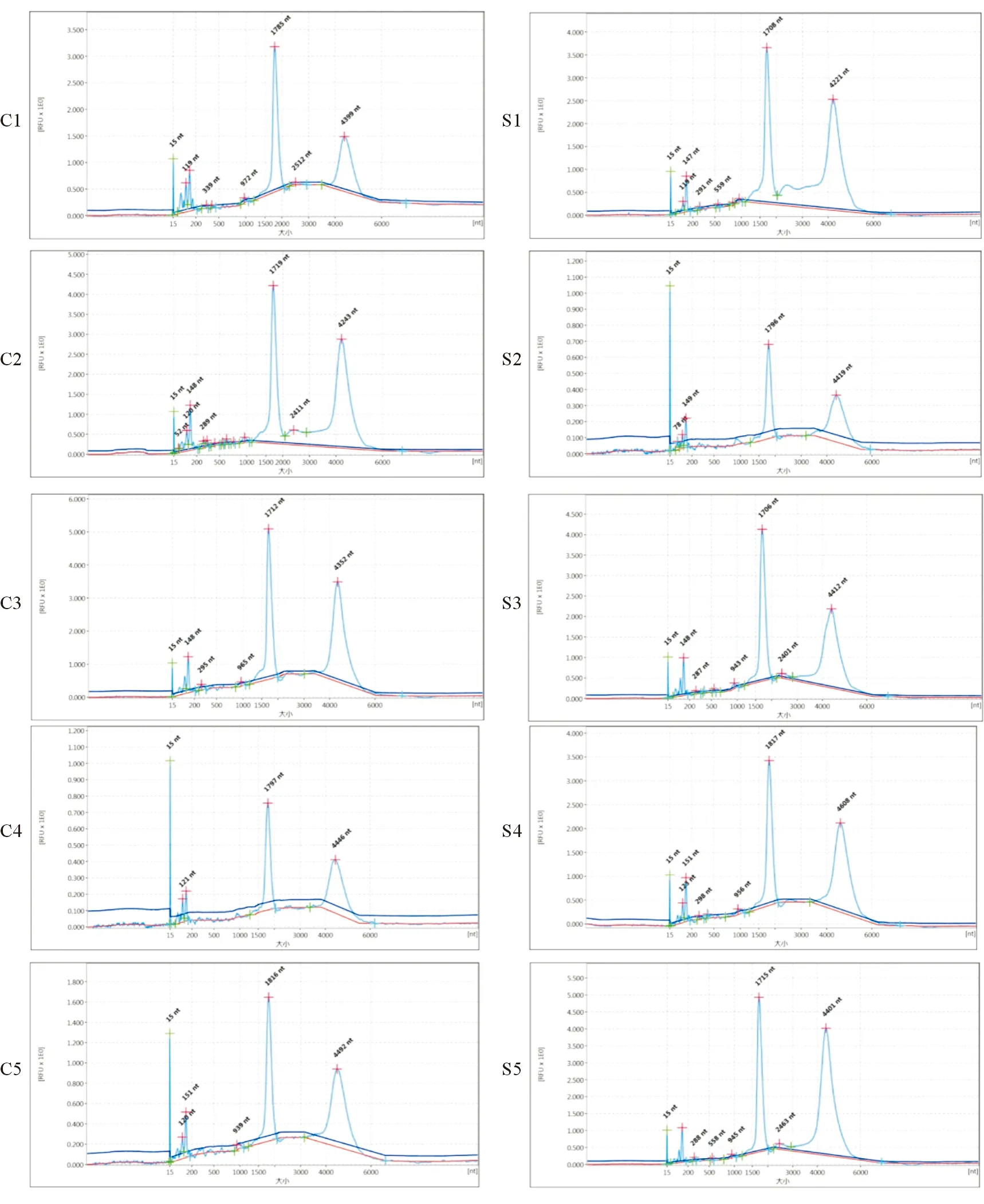
图1 对照组以及实验组小鼠海马组织RNA质检结果
2 结 果
2.1 差异表达基因(DEG)检测的微阵列分析 差异表达基因的鉴定标准是两个微阵列分析的表达水平的平均变化倍数(log2比值)大于1.5或小于-1.5(RS组/C组)。本研究结果显示,与C组相比较,RS组有上调的16个基因和下调的14个基因发生了显著变化(P<0.05,表1)。为了全面了解基因表达的差异状况,使用火山图来呈现配对样本间差异表达的基因(图2),然后用相同方法得到差异表达基因的热图(图3),同时对差异表达的基因(包括上调的16个基因和下调的14个基因)进行了功能分析和信号通路分析(图4)。这些基因是七氟醚调控的靶点,与学习记忆、认知、细胞代谢、信号转导和通讯、结构和囊泡过程、生命物质结合和定位有关,可能参与cAMP信号通路、昼夜节律、多巴胺能突触、催产素通路等多个信号通路。

表1 重复七氟醚暴露后小鼠海马上调和下调的已知基因
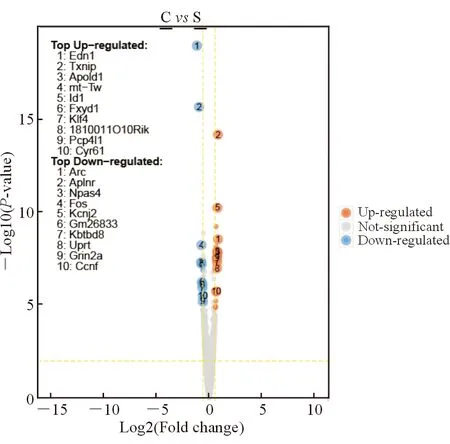
图2 差异表达基因的火山图
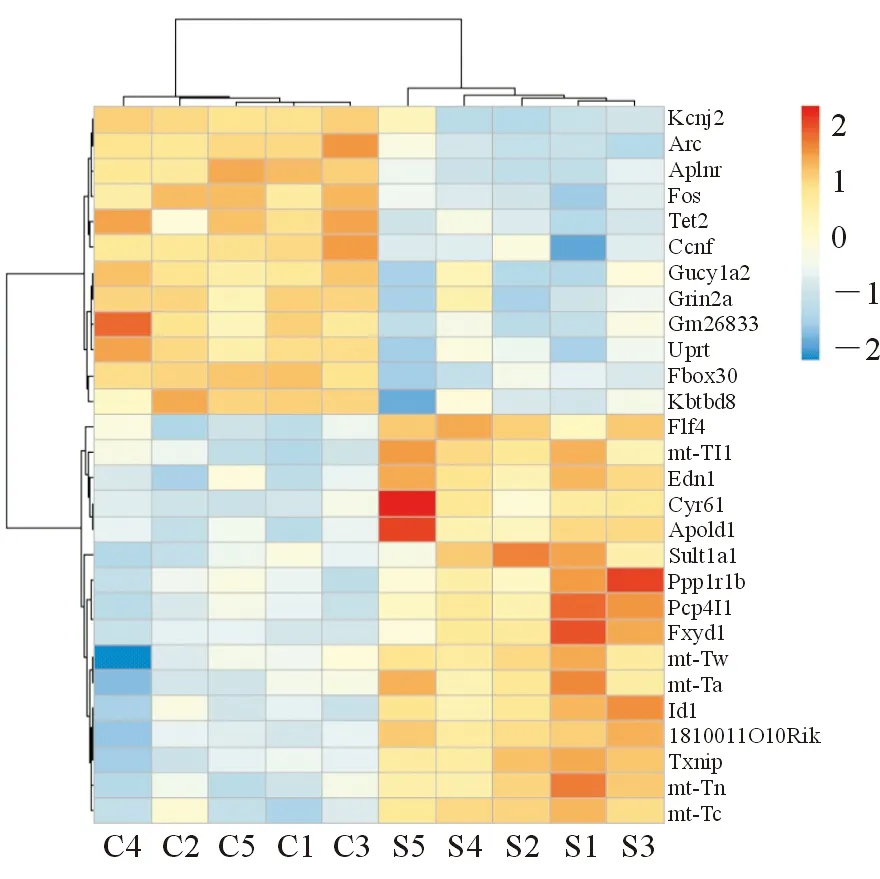
图3 差异表达基因的热图
2.2 反转录聚合酶链反应(RT-PCR)验证差异表达基因 在mRNA逆转录后,以GAPDH为内参,利用设计的引物进行RT-PCR分析以验证微阵列结果(表2)。随机选择9个差异表达基因,与C组相比较,RS组有3个上调基因(Ppp1r1b、Id1和Txnip)和5个下调基因(Arc、c-Fos、Npas4、Grin2a和Kcnj2,P<0.05)。基因Tet2在RS组和C组之间没有差异表达。RT-PCR的相对定量结果(图5)与微阵列结果一致。
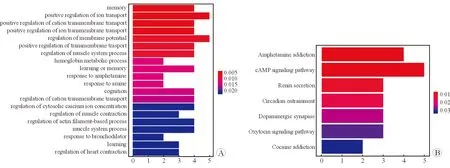
图4 七氟醚处理后海马差异表达基因功能分析和信号通路分析

表2 RT-PCR 基因特异性引物
3 讨 论
近年来,七氟醚的神经毒副作用,尤其是对认知功能障碍的影响受到人们广泛地关注,临床研究显示,患儿接受七氟醚全身麻醉后可发生较长时间的行为学改变和认知能力的下降;动物研究表明,发育期大鼠暴露于七氟醚会导致广泛的海马神经元凋亡和空间学习能力严重缺陷[11-13]。另有研究证明,七氟醚对大鼠神经干细胞的潜在毒性机制可能是通过DNA甲基化[14]。此外,Hu等[15]还报道了抑制转移相关肺腺癌转录本1(MALAT1)的mRNA表达可以减少由七氟醚诱导的海马神经元凋亡。然而目前七氟醚神经毒性的具体分子机制尚未明确,特别是在差异基因的转录表达方面少有研究。
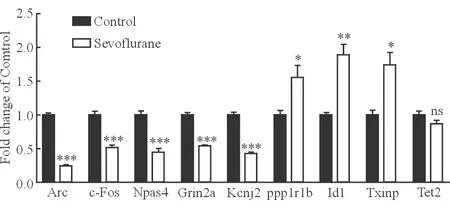
图5 RT-PCR验证差异表达基因
微阵列分析被认为是发现细胞发育、内环境稳态和疾病中基因表达变化的有效工具。本研究分析了7 d龄小鼠的基因表达谱,发现重复七氟醚麻醉后,海马中有16个基因表达上调,14个基因表达下调。值得注意的是,这些差异表达基因与学习记忆、认知、细胞代谢、信号转导和通讯、结构和囊泡过程、生命物质结合和定位有关。这些差异表达的基因可能参与了七氟醚引起的认知功能障碍过程。一项微阵列研究[9]发现,幼年大鼠重复暴露于4.5%七氟醚后取全脑组织,有42个基因显著改变,其中调节脑内苯丙胺及昼夜节律的相关基因与本研究相符。Liu等[16]报道将幼年猴暴露于2.5%七氟醚中9 h,采集额叶皮质组织进行微阵列分析,发现差异表达的基因与神经系统的发育、功能和神经细胞的活性有关。另一项研究发现成年大鼠暴露于2.5%七氟醚4 h,采集海马组织进行全基因组的微阵列分析,结果显示差异表达的基因与记忆功能障碍相关,其中催产素信号通路与本研究一致[10]。然而,这些研究中差异表达的基因与本研究中改变的基因并不相同,这可能与动物的类型、麻醉药物的剂量和作用时间、所取脑内的部位等不同相关。
在30个差异表达基因中,Arc和Fos与小鼠学习记忆能力呈高度相关。Arc编码活性调节的细胞骨架相关蛋白,在记忆、抑郁、神经发生、突触可塑性和药物成瘾等方面发挥重要作用。Guzowski等[17]首次报道了海马内注入Arc反义基因,发现Arc基因敲除后会损害长时程增强(LTP)的巩固和长期空间记忆能力。类似的证据显示,在小鼠背侧海马中注入Arc反义基因抑制Arc的合成,会导致抑制性回避记忆的发生[18]。此外,在恐惧条件反射中,Arc的表达增加且依赖于ERK基因,Arc是外侧杏仁核长期记忆构建的重要条件之一[19]。综上所述,这些研究均说明了Arc在啮齿类动物长期记忆形成中的重要性。在我们的研究中,通过微阵列检测和RT-PCR验证的Arc基因下调可能是七氟醚致幼鼠学习记忆能力下降的关键因素。在小鼠重复吸入七氟醚的模型中,我们还发现了Fos基因表达下调。Fos又称c-Fos,编码亮氨酸拉链蛋白,可使JUN家族蛋白发生二聚,从而形成转录因子复合物AP-1,在DNA水平下控制基因表达。Fos属于即刻早期基因(IEGs),其表达的增加通常代表神经元的激活。Guzowski在大鼠模型中使用反义寡核苷酸(ASO),发现c-Fos-ASO的输注会导致长期空间记忆的缺陷[20]。阻断海马中c-Fos的表达也可能导致长期记忆储存出现持续性的缺陷[21]。另有研究表明,c-Fos可以与组蛋白脱乙酰基酶-3(HDAC3)相互作用,以防止HDAC3神经毒性[22]。这些研究不仅突出了c-Fos在记忆储存和神经元保护中的关键作用,而且为重复七氟醚麻醉小鼠模型提供了可能的分子机制。本研究中其他的下调基因也与神经发育与认知功能障碍相关,如神经元PAS结构域蛋白4(Npas4)可调控神经元之间的突触连接[23-25],其基因敲除小鼠呈现出认知功能障碍和癫痫症状[26];Grin2a可编码N-甲基-d-天冬氨酸受体(NMDAR)亚单位GluN2A,它的改变与一系列具有显著言语相关特征的神经发育障碍和癫痫有关[27]。七氟醚在多个层面上影响认知功能,包括受体、离子通道、第二信使系统、酶以及细胞骨架成分,本研究中差异表达的基因Txnip、Ppp1r1b、Id1和Kcnj2可能分别从细胞代谢、第二信使系统、转录调控和离子通道这些方面来影响认知功能[28-31]。研究表明认知功能是一个复杂的过程,一个基因可以影响多个过程,而多个基因可以影响一个过程,多个认知过程是相互关联的[32]。因此,推测七氟醚引起的认知功能障碍可能是多种基因改变的结果,这些结果提示还需进一步深入研究。
总之,本研究利用微阵列技术发现了七氟醚麻醉后幼鼠海马基因转录的改变。重要的是,我们发现了一部分基因在七氟醚的作用下明显失调。Arc、c-Fos和Npas4等基因的差异表达可能在幼鼠七氟醚神经毒性中起着关键的作用,为阐释七氟醚引起神经毒性的作用机制提供新的理论依据。

