眼子菜茎的组织培养及快速繁殖体系建立
宋 伦,洪开文,宋 泽,郑 重,刘 晶,扶长杰
(1.安顺职业技术学院,贵州 安顺 561000; 2.黔中民族药(苗药)资源开发与产业化协同创新中心, 贵州 安顺 561000; 3.贵州大学 农学院,贵州 贵阳 550000)
眼子菜(PotamogetondistinctusA. Bennett J. Bot.)是眼子菜科(Potamogetonaceae)眼子菜属 (Potamogeton)多年生水生草本植物。广布于我国南北大多数省区,生于池塘、水田和水沟等静水中,水体多呈微酸性至中性,是一种常见的稻田杂草,有时甚至是恶性杂草[1]。眼子菜属植物入药最早记载于明初期,朱橚编撰的《救荒本草》一书中载有菹草(PotamogetoncrispusLinnaeus Sp. Pl.),即水藻,生于池塘及水泊中,茎如麄线,长100~133 cm,叶形似柳叶而狭长,故名柳叶菹;其叶似篷子叶,根麄如钗股而色白,味微咸性微寒。明代兰茂《滇南本草》中记载牙齿草,又名牙拾草。生于田中,味苦、涩,性寒。止赤白痢疾,大肠下血、妇人红崩漏下,恶血。其中的牙齿草即为眼子菜。在《中药大辞典》中记载眼子菜具有清热利水、止血消肿、驱蛔的功效。主治痢疾、黄疸、淋病、带下、血崩、痔血、蛔虫病、疮疡红肿等。
眼子菜属成分、药理等研究相对较少,WARFARIN等[2]利用二氯甲烷从光叶眼子菜(PotamogetonlucensLinnaeus)中萃取出一种已知的呋喃糖苷和2种新型糖苷及羟基化脂肪酸,其均对月牙藻具有抑制作用;对比另外几类眼子菜属植物的非极性萃取物发现,这类糖苷在眼子菜属植物中普遍存在。易道生等[3]用马来眼子菜(PotamogetonintortusifoliusJ. B. He, L. Y. Zhou & H. Q. Wang)提取马来眼子菜多糖,证明马来眼子菜多糖Ⅰ(PMPSⅠ)由D-果糖和D-木糖组成,而马来眼子菜多糖Ⅱ(PMPSⅡ)由 D-葡萄糖、D-果糖和另一未知单糖成分组成。KURASHOV等[4]第一次对小眼子菜(PotamogetonpusillusLinnaeus)的挥发油进行GC-MS分析,共测出133种挥发油组分。眼子菜属植物除含蛋白质、脂肪、氨基酸、纤维素等常见成分外,还含有丰富的类胡萝卜素[5-6]。眼子菜(PotamogetondistinctusA. Bennett J. Bot.)具有相应的中药药理作用、抗癌活性、抗氧化活性、抑菌抗炎活性、细胞因子诱导活性和其他药理作用[7],且对污染河道氮、磷有净化吸收作用,可以充分调动河道的底质肥力、加速氮磷循环、丰富水中营养盐、提高水体生产力,对治理污染河道水体有重大意义[8-9]。在《陆矶诗疏》《毛晋诗疏广要》《尔雅》《救荒本草》及《本草纲目》等古籍中均有关于眼子菜属植物食用的记载。同时眼子菜属植物主要营养成分与稻谷相一致,氨基酸与玉米相近,还含有一些生理活性成分和微量元素,可提高动物免疫力和肌肉品质,因其野生能力较强、资源丰富、容易采集,是家畜、家禽和草食性鱼类喜食的青绿饲料[10-11]。
眼子菜具有一定的潜在药用价值和水生态恢复、食用、饲用价值。在农业上,眼子菜的相关研究在于如何防治[12]。对于该资源的开发和利用研究较少。眼子菜以全草或休眠芽入药,采集时茎易断,入药部位难以大量收集。目前,鲜见眼子菜组织培养(以下简称“组培”)的相关研究报道。为此,以眼子菜茎为试验材料,研究不同浓度6-糠基氨基嘌呤(KT)、萘乙酸(NAA)、6-苄基氨基嘌呤(6-BA)、吲哚丁酸(IBA)、无机盐和糖对眼子菜茎段出芽数、叶片数、根状茎节数、生根数的影响,以期为眼子菜快速繁殖体系的建立及其应用提供技术支撑。
1材料与方法
1.1材料
试验材料:眼子菜,于2019年5月采集于安顺市西秀区蔡官镇稻田中,经检索《中国植物志》等相关资料鉴定为眼子菜。模拟其生境栽培于安顺职业技术学院应用医药系中药学专业实训地中。取长势健壮植株的幼嫩茎段为外植体进行试验。
试剂:MS培养基(Murashige和Skoog 1962,固体培养基),贵阳诚承化工设备有限公司;6-糠基氨基嘌呤(KT)、萘乙酸(NAA)、6-苄基氨基嘌呤(6-BA)、吲哚丁酸(IBA),上海易恩化学技术有限公司;无菌水,自制。
仪器:超净工作台,苏州市金净净化设备科技有限公司;YM30Z高压蒸汽灭菌器,上海三申医疗器械有限公司;光照培养箱,上海琅玕实验设备有限公司。
1.2方法
1.2.1培养基和培养条件根据试验目的不同添加不同浓度的植物生长调节剂。以MS为基础培养基,附加蔗糖3%,琼脂均为6 g/L,pH均调至5.8~6.0,1/2MS培养基为MS基础培养基中大量元素减半,附加蔗糖1.5%,其他成分不变。配制的培养基使用高压蒸汽锅121℃灭菌30 min。使用纯净水高压灭菌制得无菌水。无菌营养液为使用MS培养基配方而不添加植物调节剂、蔗糖和琼脂配制,高压灭菌而得。培养温度(25±1)℃,光周期12 h/d,光强约为60 μmol/m2·s,培养周期根据培养阶段不同而变化。
1.2.2外植体消毒处理取长势健壮的眼子菜幼嫩茎段,在自来水下冲洗1 h,无菌纱布滤干。于超净工作台上用浸泡75%乙醇的棉花擦拭1次,去除多余叶片、叶苞和不定根,并用无菌手术刀将其切成小段(每段需有2个茎节)。将切成小段的眼子菜用无菌水冲洗2次,75%酒精充分浸泡40 s,再用0.1%升汞充分浸泡10 min,取出后用无菌水冲洗3次,置入装有无菌水的玻璃杯中等待接种。
1.2.3不定芽的诱导及继代培养将消毒好的外植体接种(平放于培养瓶中)到A(MS+KT 0.1 mg/L+NAA 0.05 mg/L)、B(MS+KT 0.1 mg/L+NAA 0.1 mg/L)、C(MS+KT 0.05 mg/L+NAA 0.05 mg/L)、D(MS+KT 0.05 mg/L+NAA 0.1 mg/L)培养基上进行不定芽诱导,每组10次重复,每瓶4个外植体。萌芽后开始记录其出芽数,每2 d观察记录数据1次。16 d为1个培养周期,将诱导培养出来的芽进行继代或增殖培养。
1.2.4增殖培养将诱导出的不定芽切割分离为单株,接种于增殖培养基E1(MS+6-BA 1 mg/L+NAA 0.05 mg/L)、E2(MS+6-BA 1 mg/L+NAA 0.05 mg/L+无菌水)、E3(MS+6-BA 1 mg/L+NAA 0.05 mg/L+营养液)、F1(MS+6-BA 0.5 mg/L+NAA 0.05 mg/L)、F2(MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+无菌水)、F3(MS+6-BA 0.5 mg/L+NAA 0.05 mg/L+营养液)、G1(MS+6-BA 0.5 mg/L+NAA 0.1 mg/L)、G2(MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+无菌水)、G3(MS+6-BA 0.5 mg/L+NAA 0.1 mg/L+营养液)、H1(MS+6-BA 1 mg/L+NAA 0.1 mg/L)、H2(MS+6-BA 1 mg/L+NAA 0.1 mg/L+无菌水)、H3(MS+6-BA 1 mg/L+NAA 0.1 mg/L+营养液)中进行增殖培养,每组10次重复,每瓶4个单株。接种后第3天开始记录其新增出芽数、叶片数和根状茎节数,每2 d观察记录数据1次。8 d为1个培养周期,达到生根壮苗要求的数量时进行下一步生根培养。
1.2.5生根培养与炼苗移栽将增殖培养的眼子菜植物取出,接种于生根培养基I1(MS+IBA 0.5 mg/L)、I2(MS+IBA 0.5 mg/L+无菌水)、I3(MS+IBA 0.5 mg/L+营养液)、J1(MS+IBA 1 mg/L)、J2(MS+IBA 1 mg/L+无菌水)、J3(MS+IBA 1 mg/L+营养液)、K1(1/2MS+IBA 0.5 mg/L)、K2(1/2MS+IBA 0.5 mg/L+无菌水)、K3(1/2MS+IBA 0.5 mg/L+营养液)、L1(1/2MS+IBA 1 mg/L)、L2(1/2MS+IBA 1 mg/L+无菌水)、L3(1/2MS+IBA 1 mg/L+营养液)中进行生根培养,每组10次重复,每瓶1株眼子菜组培苗。接种后第3天开始记录其新增出芽数、新增叶片数、新增根状茎节数和生根数,每2 d观察记录数据1次。6 d为1个培养周期,将生根后的眼子菜组培苗打开瓶盖,在培养室放置2 d。将植株从培养基中取出,去除苗根部的培养基,种植于带有泥土的水箱中,水深2 cm,土深10 cm。放置在温室阴凉处,常规管理。10 d后统计移栽成活率及苗生长状况。
1.2.6评定规则按照各个阶段的不同制定不同的评分标准,对每组每个指标求平均值,然后赋予每个指标一定评分( 满分为100分)权重。
2结果与分析
2.1不同浓度KT和NAA对眼子菜芽诱导的影响
从表1可知,当KT与NAA浓度分别为0.1 mg/L和0.05 mg/L时,眼子菜茎段的诱导出芽数最低,为2.7个,综合评分为27分;当KT与NAA浓度分别为0.05 mg/L和0.1 mg/L时,眼子菜茎段的诱导出芽数最高,为13个,评分为100分。综合分析,当KT/NAA浓度比为较低时,有利于眼子菜芽的诱导,当KT/NAA浓度比为较高时,对眼子菜芽的诱导有一定的抑制作用。

表1 不同浓度KT和NAA处理眼子菜的出芽诱导状况
2.2不同处理对眼子菜增殖培养的影响
由于第8天后部分培养瓶中叶片数量较多,难以观察记录指标,故以第8天的记录数据进行指标评分。从表2可知,E1处理的评分最高,为72.4分,出芽数、生长叶片数和根状茎数均最大,分别为5.3个、9张和8.3节; H1处理的综合评分最低,为21.4分,其出芽数、生长叶片数和根状茎节分别为1.3个、2.5张和2.8节。综合分析,当6-BA浓度为1 mg/L,NAA浓度为0.05 mg/L,不添加无菌水或无菌营养液时,有利于眼子菜的增殖培养;当6-BA浓度为1 mg/L,NAA浓度为0.1 mg/L,不添加无菌水或无菌营养液时,眼子菜的增殖培养效果差。
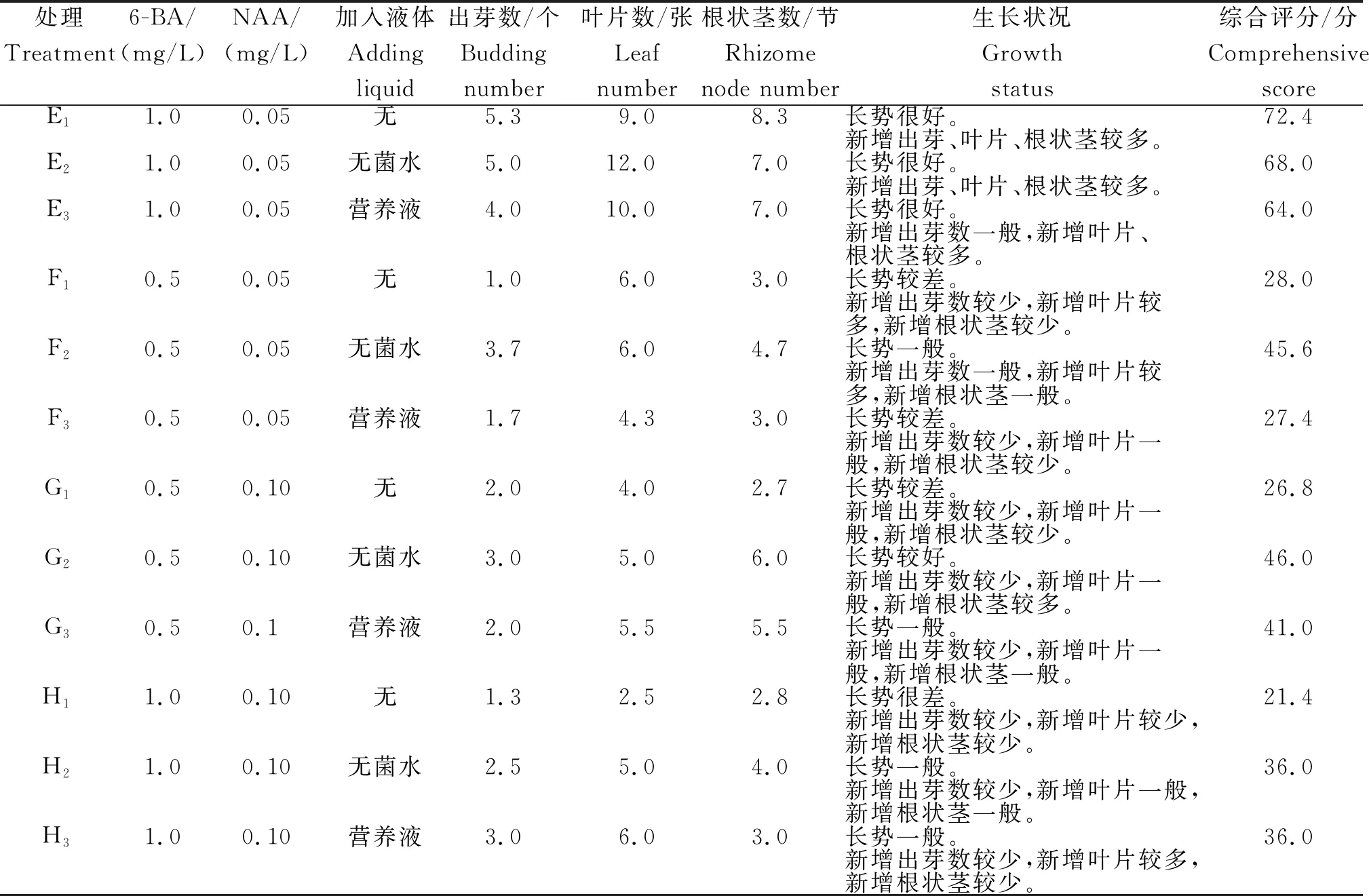
表2 不同处理眼子菜的增殖培养状况
2.3不同处理对眼子菜生根培养的影响
从表3可知,K2处理的综合评分最高,为76.2分,其出芽数、叶片数、根状茎数和生根数分别为5.7个、15.0张、8.7条和13.7条。G1处理的综合评分最低,为17.8分,其出芽数、叶片数、根状茎数和生根数分别为0.8个、4.5张、1.8条和1.8节。综合分析,当培养基中无机盐、有机质等含量较少,IBA浓度较低,添加无菌水时,有利于眼子菜根的诱导培养;当培养基中无机盐、有机质等含量较高,IBA浓度较高时,对根的诱导培养有一定的抑制作用。
2.4组培苗移栽的存活率
炼苗结束后将组培苗移栽于带有泥土的水箱中,放置在温室阴凉处,常规管理。10 d后统计移栽成活率为98%。
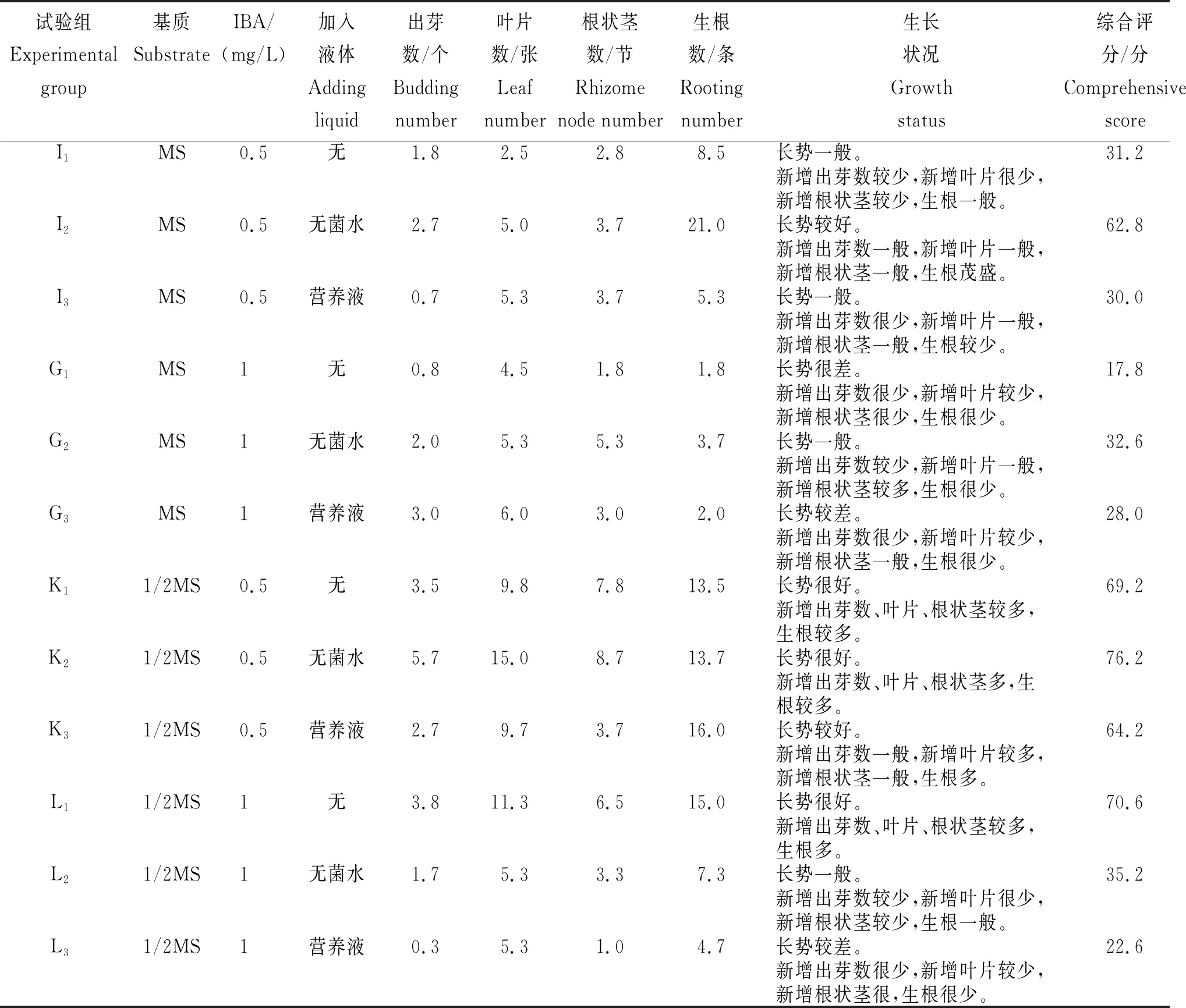
表3 不同处理眼子菜的生根培养状况
3结论与讨论
研究表明,眼子菜芽的最佳诱导培养基为MS+KT 0.05 mg/L+NAA 0.1 mg/L,该条件下的出芽数为10个,大部分形成不定芽,诱导能力很好;眼子菜的最佳增殖培养基为MS+6-BA 1 mg/L+NAA 0.05 mg/L,其出芽数、叶片数和根状茎数分别为5.3个,9张和8.3节;眼子菜的最佳生根培养基为1/2MS+IBA 0.5 mg/L+无菌水,其出芽数、叶片数、根状茎数和生根数分别为5.7个,15.0张、8.7节和13.7根;眼子菜茎的组培苗在模拟水田环境中存活率高,为98%,无需其他处理。
眼子菜的组织培养材料存在不易消毒、操作等特点,在培养过程中对组培苗进行观察记录时受制约因素较多,很难准确地对植株生长状况进行评定。试验在参考前人研究其他植物组织培养的基础上,对各培养阶段的眼子菜指标给予评分,再进行分析,能较为客观地反映各处理间的总体差异,得到的试验结果更加客观和具有说服力。
研究在参考同属植物竹叶眼子菜的组织培养方法的基础上,对生长调节剂浓度进行了调整,在增殖培养和生根培养时考虑到眼子菜的水生环境,特别制造了液态环境(添加无菌水或无菌营养液)。通过试验初步探索出眼子菜茎的组织培养方案,构建了以眼子菜茎为外植体诱导分化成苗的快繁体系,为后续眼子菜同属植物组织培养的研究提供一定的研究基础和技术支撑。
眼子菜资源分布广、蕴藏量大,对农业生产危害严重,但其药理方面的研究报道相对较少。若在成分、药理等研究跟进的情况下,对该资源进行开发利用,农业上将会找到另一种治理眼子菜的途径。

