化学计算题分类解析
沙林祥

一、坐标图象式计算题
解题时先分析坐标曲线图中横、纵坐标表示的意义,再结合题中所涉及的化学反应分析图象的起点、拐点和终点的含义。从坐标图象中找已知量的方法一般有三种:(1)拐点对应的横坐标(某些情况下需要进行换算才能代入,如乘以溶质的质量分数等);(2)拐点对应的纵坐标(多为生成的气体或沉淀的质量,可直接代入);(3)起点和拐点对应的坐标差。
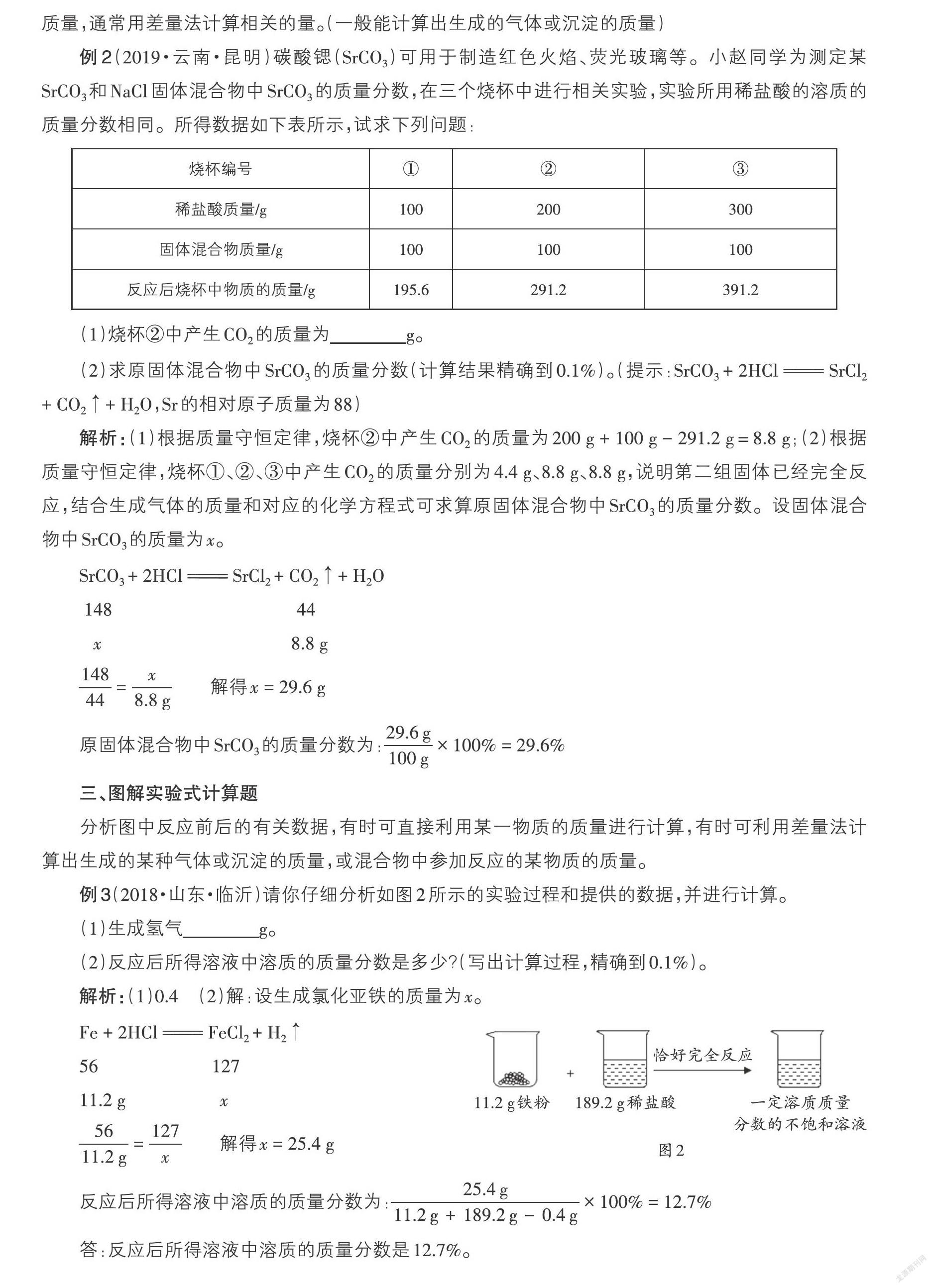
例1(2019·山东·滨州)将1.17 g氯化钠固体放入烧杯中,加入51.7 g水充分溶解后得到常温下氯化钠的不饱和溶液,再向所得溶液中逐滴滴入100 g一定溶质质量分数的硝酸银溶液,实验过程中生成沉淀的质量与滴入硝酸银溶液的质量关系如图1所示,请回答下列问题。
(1)B点时,溶液中所含硝酸银的质量为 ;
(2)A点时,所得溶液中溶质的质量分数为多少?(计算结果精确至0.1%)
解析:(1)由图象可知,B点时溶液中所含硝酸银的质量等于A点时所消耗的硝酸银的质量。设A点时所消耗的硝酸银的质量为x。
AgNO3 + NaCl [ ] AgCl↓ + NaNO3
170 58.5
x 1.17 g
[170x=58.51.17 g] 解得x = 3.4 g
(2)根据氯化钠的质量和对应的化学方程式求算加入50 g硝酸银溶液生成的氯化银的质量以及生成的硝酸钠的质量,进而求算A点时,所得溶液中溶质质量分数。设A点时生成的氯化银质量为y,生成的硝酸钠质量为z。
AgNO3 + NaCl [ ] AgCl↓ + NaNO3
58.5 143.5 85
1.17 g y z
[58.51.17 g=143.5y=85z] 解得y = 2.87 g,z = 1.7 g
A点时所得溶液溶质的质量分数为:[1.7 g1.17 g + 50 g + 51.7 g - 2.87 g] × 100%=1.7%
二、表格数据式计算题
首先明确表格中各栏表示的含义,然后分析数据的变化,在变化规律中找出物质实际参加反应的质量,通常用差量法计算相关的量。(一般能计算出生成的气体或沉淀的质量)
例2(2019·云南·昆明)碳酸锶(SrCO3)可用于制造红色火焰、荧光玻璃等。小赵同学为测定某SrCO3和NaCl固体混合物中SrCO3的质量分数,在三个烧杯中进行相关实验,实验所用稀盐酸的溶质的质量分数相同。所得数据如下表所示,试求下列问题:
[烧杯编号 ① ② ③ 稀盐酸质量/g 100 200 300 固体混合物质量/g 100 100 100 反应后烧杯中物质的质量/g 195.6 291.2 391.2 ]
(1)烧杯②中产生CO2的质量为 g。
(2)求原固体混合物中SrCO3的质量分数(计算结果精确到0.1%)。(提示:SrCO3 + 2HCl [ ] SrCl2 + CO2↑+ H2O,Sr的相对原子质量为88)
解析:(1)根据质量守恒定律,烧杯②中产生CO2的质量为200 g + 100 g - 291.2 g=8.8 g;(2)根据质量守恒定律,烧杯①、②、③中产生CO2的质量分别为4.4 g、8.8 g、8.8 g,说明第二组固体已经完全反应,结合生成气体的质量和对应的化学方程式可求算原固体混合物中SrCO3的质量分数。设固体混合物中SrCO3的质量为x。
SrCO3 + 2HCl [ ] SrCl2 + CO2↑+ H2O
148 44
x 8.8 g
[14844=x8.8 g] 解得x = 29.6 g
原固體混合物中SrCO3的质量分数为:[29.6 g100 g] × 100% = 29.6%
三、图解实验式计算题
分析图中反应前后的有关数据,有时可直接利用某一物质的质量进行计算,有时可利用差量法计算出生成的某种气体或沉淀的质量,或混合物中参加反应的某物质的质量。
例3(2018·山东·临沂)请你仔细分析如图2所示的实验过程和提供的数据,并进行计算。
(1)生成氢气 g。
(2)反应后所得溶液中溶质的质量分数是多少?(写出计算过程,精确到0.1%)。
解析:(1)0.4 (2)解:设生成氯化亚铁的质量为x。
Fe + 2HCl [ ] FeCl2 + H2↑
56 127
11.2 g x
[5611.2 g=127x] 解得x = 25.4 g
反应后所得溶液中溶质的质量分数为:[25.4 g11.2 g + 189.2 g - 0.4 g] × 100% = 12.7%
答:反应后所得溶液中溶质的质量分数是12.7%。

