雄鼠交配前高盐高脂高糖饮食对子二代焦虑和抑郁样行为的影响
曾穗敏,刘海林,郑 哲,欧彦汝,马 骏,曾诗语,张晓莉,Hocher Berthold,李 健
(湖南师范大学医学院,长沙 410013)
焦虑症和抑郁症是一种困扰人们生活健康,社会危害的疾病,全球焦虑症患者约有2.6亿,全球抑郁症患者约有3.1亿[1]。目前,焦虑症和抑郁症的病因并不非常清楚,但可能是生物、心理和社会环境等诸多方面因素均参与了焦虑症和抑郁症的发病过程。因此,寻找两种疾病发病原因,并从源头防治此病具有重要意义。
由“成人疾病的胎儿起源”假说发展而来的健康与疾病的发育起源(DOHaD)学说在全世界已被成千上万位科学家所认可[2,3],学说认为配子发育时期,宫内与儿童早期的经历的营养、心理、社会应激药物等方面的不良因素,会对人的终生的健康和疾病发生影响,会导致成年以后患病的风险增强。目前母亲的饮食对后代的影响已被广泛研究,数据显示母亲肥胖可以影响后代健康,使他们更容易患肥胖、糖尿病和高血压[4-6]。从当前的研究来看,母系围产期不良营养状况会会对后代神经内分泌系统产生不利影响,可以导致一些精神疾病的发生,如焦虑和抑郁等[7-9]。随着研究的发展,人们也开始关注父系编程对后代神经内分泌功能的影响。截至目前为止,父系DOHaD学说研究中,父系编程对子代焦虑和抑郁的影响的研究还很少,尤其是缺乏模拟人类不良饮食状态的高盐高脂高糖饮食(高复合饮食)对后代的研究。本研究采用高复合饮食给予亲代(F0)雄性 SD 大鼠交配前暴露,且子一代(F1)雄鼠进一步给予高复合饮食二次暴露,来观察对子二代(F2)大鼠焦虑和抑郁样行为的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物实验用SD雄性大鼠30只(4周龄,体质量100~140克)和SD雌性大鼠45只购自湖南斯莱克景达实验动物有限公司。SD大鼠饲养于湖南师范大学医学院SPF级动物房,5只一笼,保持12小时光照,12小时黑暗,标准温度20℃~25℃,相对湿度50%~70%,并且水和食物自由摄取。所有实验动物的进行都得到了湖南师范大学动物伦理委员会的批准。
1.1.2 饲料对照饮食和高复合饮食饲料均由江苏美迪森生物医药有限公司提供,普通饮食由动物房常规提供,三种饲料营养成分见Li等人的文献[10]。
1.2 实验方法
1.2.1 动物模型建立与分组亲代(F0)雄性Sprague-Dawley(SD)大鼠30只,随机分为对照饮食组(CD,n=15)和高复合饮食组(HD,n=15)。F0雄性大鼠交配前高复合饮食饲料喂养9周后与对照饮食的雌鼠交配产生F1。F1给予对照饮食15周,然后分别从CD组和HD组的F1中随机取雄鼠2只,给予对照饮食或高复合饮食二次暴露9周,在第24周时F1雄鼠与CD组的F1代雌鼠交配产生F2,F2大鼠均给予普通饲料喂养。动物模型的建立具体参照Zhang等人的文献[11]。F0雄性大鼠随机分为两个组:(1)对照饮食组(CD,n=15);(2)高盐高脂高糖饮食组(HD,n=15)。F1代分为两组:(1)F1CD组:F0雄鼠喂养对照饮食的子一代;(2)F1HD:F0雄鼠喂养高复合饮食的子一代。F2代分为4组:(1)F0CD+F1CD 组:F0和F1雄鼠均喂养对照饮食的子二代;(2)F0CD+F1HD 组:F0亲代雄鼠喂养对照饮食和F1代雄鼠喂养高复合饮食的子二代;(3)F0HD+F1CD 组:F0亲代雄鼠喂养高复合饮食和F1代雄鼠喂养对照饮食的子二代;(4)F0HD+F1HD 组:F0和F1亲代雄鼠均喂养高复合饮食的子二代。
1.2.2 体重指标检测定期观察大鼠生长状态、毛色、食欲和行为状态等,每周记录大鼠进食量。F2代大鼠分别在第12、15、18、22和25周用电子天平测量体重。
1.2.3 旷场实验分别在F2代大鼠第12周和23周进行。使用规格为40×100×100cm的实验箱,底面平均分为25个4 cm×4 cm小方格,专门的测试软件记录实验数据。于实验开始前5天开始轻轻抚摸大鼠,每只大鼠每天抚摸5min,让其熟悉实验者,减少人为畏惧因素。实验开始前两小时将大鼠搬入实验房间适应,调整好相关仪器。实验时间为5分钟,记录5分钟内中央停留时间。
1.2.4 高架十字迷宫实验分别在F2代大鼠第12周和23周进行。高架十字迷宫包括两个开臂,两个闭臂。实验开始前两小时将大鼠搬入实验房间适应,调整好相关仪器。使用高架迷宫的软件记录大鼠实验期间(通常为5min)进入开臂和闭臂次数及在两臂的停留时间等检测指标。
1.2.5 新奇环境抑制摄食实验分别在F2代大鼠第12周和23周进行。实验装置为顶部开放的木质箱子,底部划分为大小均匀的15 cm×15 cm的方格。大鼠禁食24 h 后,保持实验环境安静,然后将大鼠放入箱子的角落,中间摆放一颗食物,摄像头记录10 min,观察大鼠从放进盒子里到准备进食的潜伏期,然后将其放回鼠笼内。
1.2.6 强迫游泳实验在F2代大鼠第25周进行。实验开始前两小时,将大鼠放入实验房间适应环境。开始实验时将大鼠放入高70cm,直径40cm的圆柱形玻璃缸中,水温控制在23~25℃,水深45cm。强迫游泳实验包括两部分:第一天进行15 min 的适应性游泳训练,取出后擦干,放置回笼中。24 h之后,再次将大鼠置于容器中进行5 min 测试实验,记录大鼠在此期间的累积不动时间。不动时间为大鼠在水中停止挣扎、呈漂浮状态,或者仅有细小的肢体运动以保持头部漂浮于水面之上。
1.3 统计学分析数据统计采用 SPSS 22. 0 软件包进行分析。计量数据采用均数±标准误表示。两两比较采用两独立样本t检验(Independent-samples test),多组间比较采用单方向方差分析(One-way ANOVA),若方差齐则采用LSD(Least significant difference test)法,若方差不齐,则采用多重比较Dunnett’sT3法检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 雄鼠交配前高复合饮食对F2体重改变的影响F2雌鼠中,与F0CD+F1CD组相比,在第18周F0HD+F1HD组大鼠的体重明显升高(P<0.05),在第22周F0HD+F1CD组和F0HD+F1HD组大鼠的体重明显升高(P<0.05)(图1A)。F2雄鼠中,与F0CD+F1CD组相比,F0HD+F1HD组大鼠的体重没有明显变化(图1B)。表明祖父和父亲交配前高复合饮食会导致子二代大鼠体重增加,并以雌鼠体重增加更为明显。
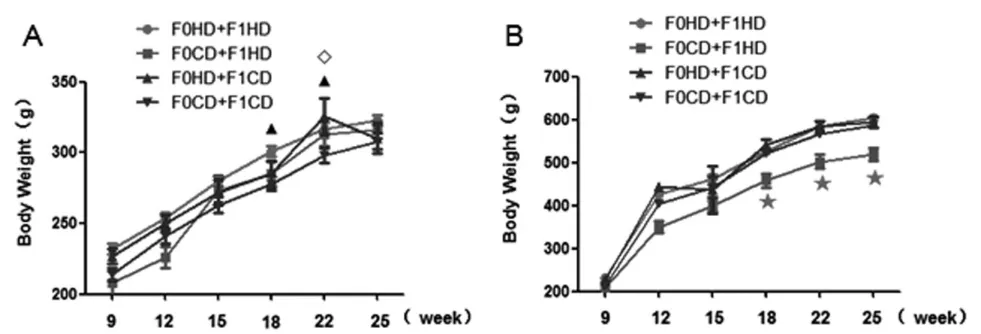
图1 雄鼠交配前高复合饮食对子二代体重的影响
2.2 雄鼠交配前高复合饮食对F2旷场实验行为学的影响在第12周旷场实验中,F2代雌鼠和雄鼠四组之间中心区停留时间无明显差异(图2A,B)。但是在第23周旷场实验中发现,与F0CD+F1CD组相比,F0CD+F1HD组,F0HD+F1CD组和F0HD+F1HD组雌鼠和雄鼠的中心区停留时间均显著降低(雌鼠P<0.01,雄鼠P<0.05)(图2C,D)。表明祖父和父亲交配前高复合饮食导致F2大鼠出现焦虑样行为,并且雌鼠的焦虑样行为更明显。
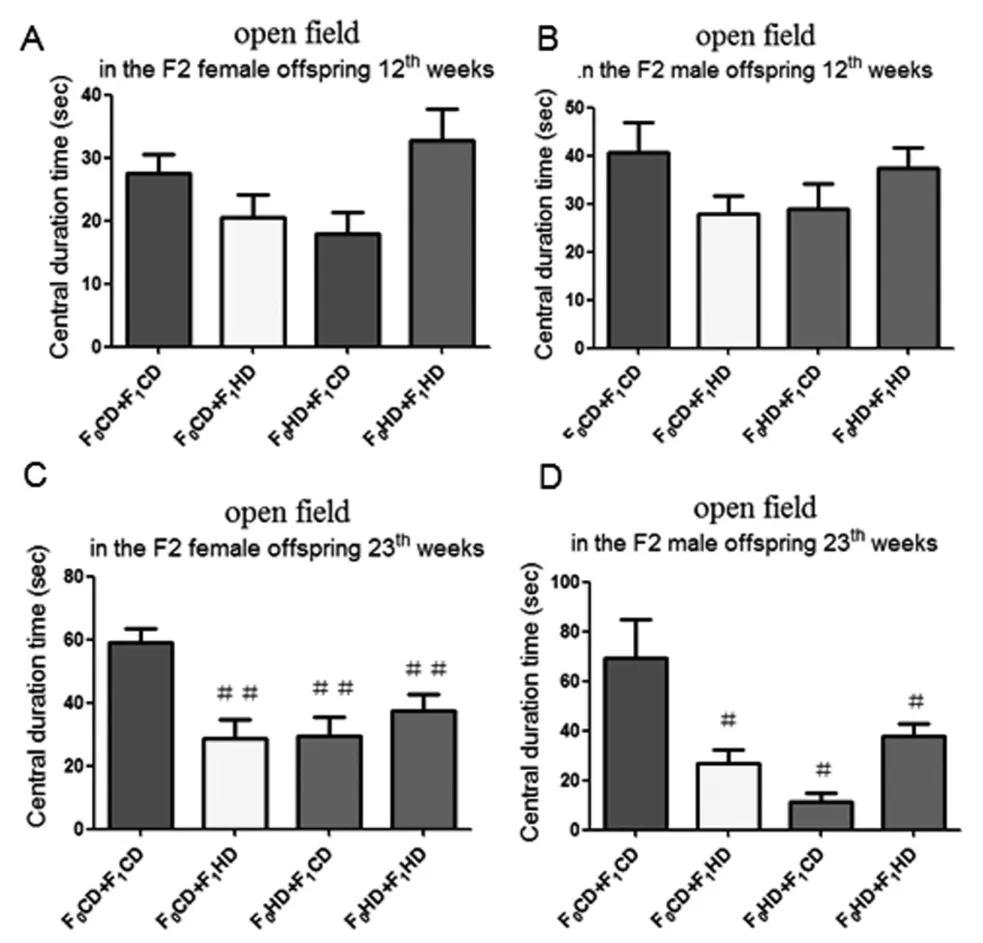
图2 子二代大鼠12周和23周各组旷场实验结果比较
2.3 雄鼠交配前高复合饮食对F2高架十字迷宫实验行为学的影响在第12周高架十字迷宫实验中,F0CD+F1HD组和F0HD+F1HD组雌鼠开放臂进入次数相比于F0CD+F1CD组明显降低(图2-3A),并且F0CD+F1HD组,F0HD+F1CD组和F0HD+F1HD组雌鼠在开放臂停留时间也明显降低,差异有统计学意义(图3C)。F0HD+F1CD组雄鼠在开放臂停留时间明显降低(P<0.05)(图3D)。在第23周高架十字迷宫实验中,F0CD+F1HD组和F0HD+F1HD组雌鼠和雄鼠开放臂进入次数明显低于F0CD+F1CD组(P<0.05)(图4A,B),F0HD+F1HD组雌鼠开放臂停留时间明显低于F0CD+F1CD组(P<0.05)(图4C)。表明祖父和父亲交配前高复合饮食导致F2大鼠出现焦虑样行为。
2.4 雄鼠交配前高复合饮食对F2新奇环境抑制摄食行为学的影响在第12周新奇环境抑制摄食中,F2代雌鼠和雄鼠四组之间摄食潜伏期无明显差异(图5A,B)。但是在第23周新奇环境抑制摄食中发现,雌鼠F0CD+F1HD组和雄鼠F0HD+F1CD组的摄食潜伏期显著高于F0CD+F1CD组(P<0.05)(图5C,D)。表明祖父和父亲交配前高复合饮食导致F2大鼠出现抑郁样行为。
2.5 雄鼠交配前高复合饮食对F2强迫游泳实验行为学的影响在第25周强迫游泳实验中,F0HD+F1HD组雌鼠不动时间明显低于F0CD+F1CD组(P<0.05)(图6A)。F2代雄鼠四组之间没有观察到不动时间有明显差异(图6B)。表明祖父和父亲交配前高复合饮食两次暴露产生的F2雌鼠出现抑郁样行为,而F2雄鼠未出现抑郁样行为。
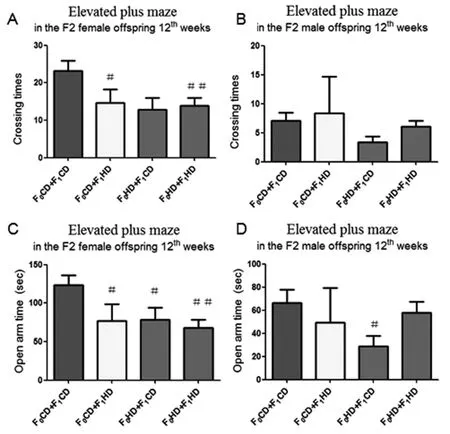
图3 子二代大鼠12周各组高架十字迷宫实验结果比较
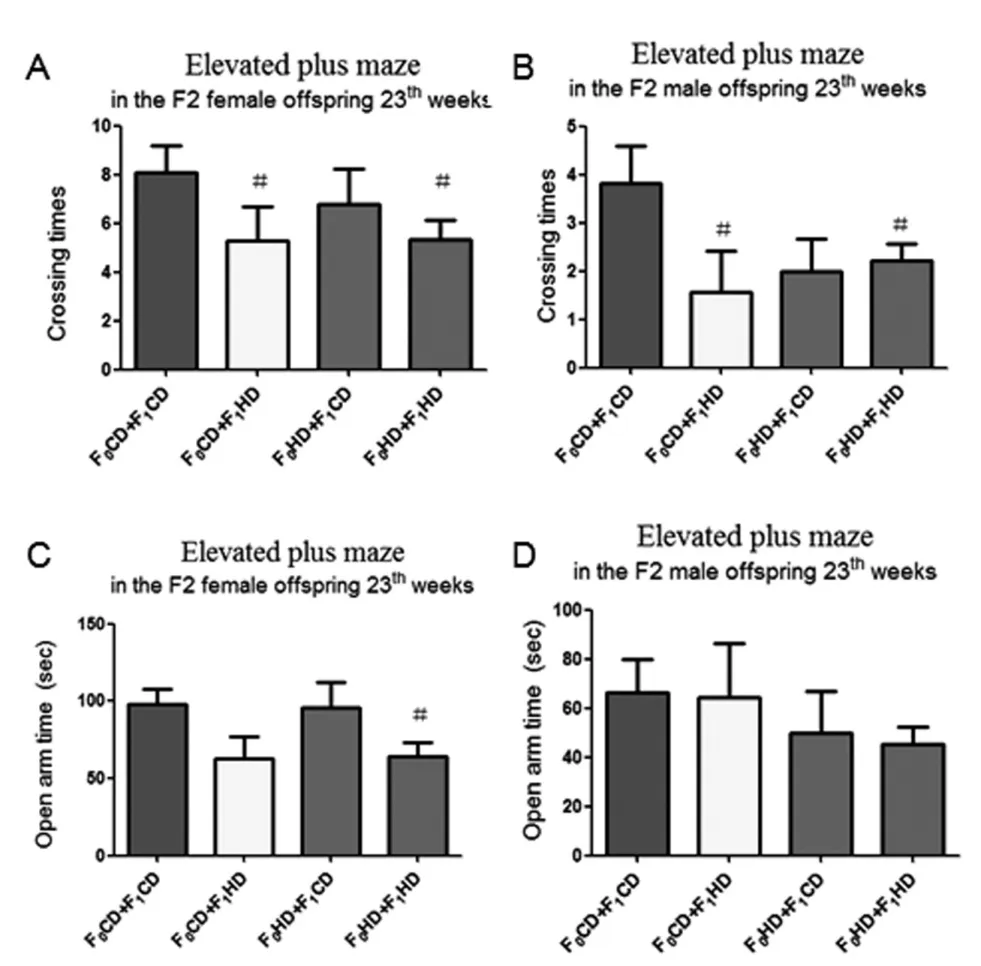
图4 子二代大鼠23周各组高架十字迷宫实验结果比较
3 讨论
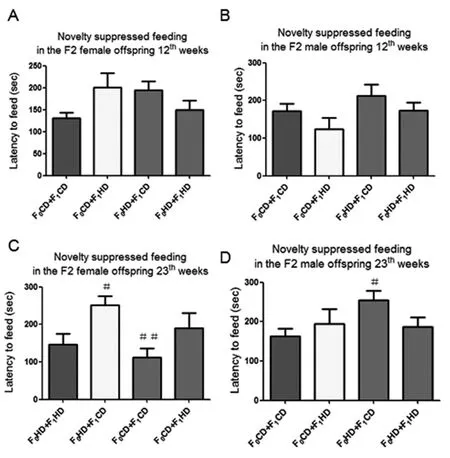
图5 子二代大鼠12周和23周各组新奇环境抑制摄食实验结果比较
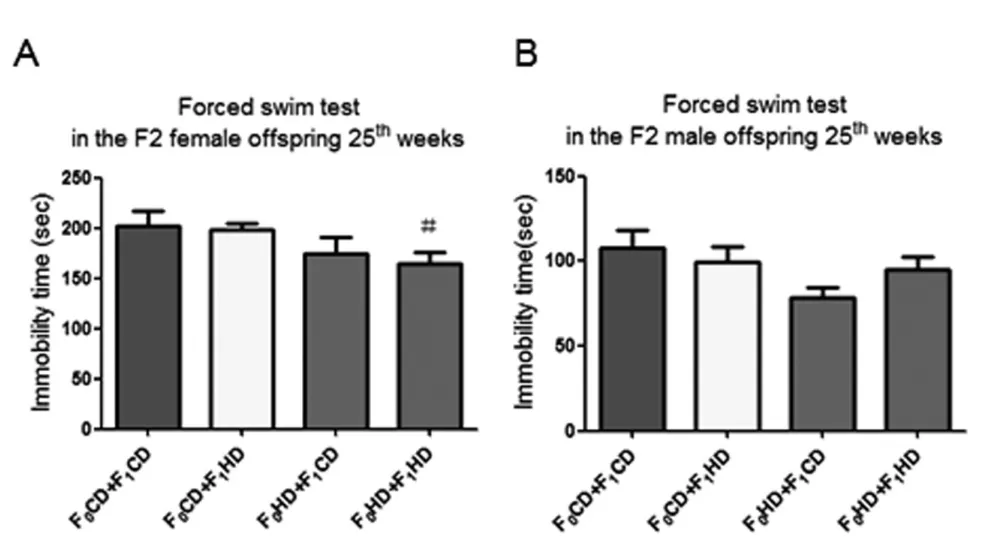
图6子二代大鼠25周各组强迫游泳实验结果比较
DOHaD学说认为环境等暴露因素导致生命早期表型的改变,将程序化成年期罹患疾病的风险性。绝大部分研究关注于母系围产期不良暴露对后代的影响,而越来越多的临床证据表明父系暴露于不良因素也可能通过胚胎程序化对子代疾病起作用,并将增加子代罹患成人疾病的风险[12,13]。目前父系的不良饮食状况会对后代行为有何影响,目前还不清楚。我们首次采用高复合饮食给予 F0雄性 SD 大鼠交配前暴露,且 F1雄鼠进一步给予高复合饮食二次暴露,来观察对F2大鼠焦虑和抑郁样行为的影响。我们首次发现雄鼠交配前高复合饮食两次暴露会导致F2大鼠体重增加,以及产生焦虑和抑郁样行为,并且具有性别差异性,以雌鼠的体重增加和焦虑和抑郁样行为增加更为明显。
Ng等人报道,与同窝对照大鼠相比,即使喂食正常脂肪饮食,父亲在交配前喂养高脂饮食的第11周的F1后代体重更高,脂肪组织积累更多[14]。本研究发现F2大鼠体重检测结果显示祖父和父亲交配前高复合饮食会导致F2大鼠体重增加,以雌鼠体重增加更为明显。已有研究表明,多数的焦虑症患者常常合并有抑郁障碍,称为共病现象,常见的共病有抑郁障碍、惊恐障碍、强迫障碍等,共病造成焦虑症的诊断和治疗难[15]。我们通过旷场实验、高架十字迷宫实验和新奇环境抑制摄食实验来观察父系交配前高复合饮食两次暴露所产生的F2的焦虑和抑郁样行为变化。研究结果显示祖父和父亲交配前高复合饮食两次暴露可导致子二代大鼠焦虑和抑郁样行为水平增加,并以雌鼠的焦虑和抑郁样行为更明显。据文献报道,体重增加是精神疾病高发的风险因素,包括焦虑、抑郁和注意力缺陷多动障碍等[16]。本研究发现祖父和父亲交配前高复合饮食两次暴露会导致F2大鼠体重增加,以及产生焦虑和抑郁样行为。
综上,父亲不良因素暴露将增加其子代在生活中的神经内分泌疾病易感性,但是其具体机制有待进一步挖掘。在其他关于父系DOHaD学说的机制研究中,许多学者认为表观遗传学改变是父系程序化子代疾病的重要机制,尤其是精子表观遗传学的改变。Chen Q等研究组通过将高脂饮食诱导的肥胖小鼠的精子总RNA 注射到正常的受精卵中,结果发现,其出生的子代小鼠在正常饮食下,也会出现类似于父代肥胖小鼠的糖代谢紊乱,这提示肥胖小鼠精子RNA 中携带有传递父代获得性性状的表观遗传信息,进一步分析发现,在父代肥胖小鼠模型中,精子tsRNAs的表达谱以及RNA修饰谱均发生了显著的变化,然后通过分离肥胖小鼠精子中的 tsRNAs(30-40 nt RNA)并注射到正常受精卵内,发现tsRNAs能像总RNA 一样诱导子代代谢紊乱,而注射其他片段的精子 RNA(15-25 nt或 > 40 nt RNA)则不能引发代谢紊乱[17,18]。Ali等人研究发现,在繁殖前将雄性小鼠暴露于6周的慢性不可预见性应激下,其后代均表现出显着地下丘脑-垂体-肾上腺皮质(HAP)轴反映不足,进一步研究精子表观遗传机制发现,父系的精子中microRNA(miR)含量显著增加,分别是miR-193-5p、miR-204、miR-29c、miR-30a、miR-30c、miR-32、miR-375、miR-532-3p和miR-698,再将这9个特异miR的配子经显微注射繁殖后代,后代显著地再现了应激失调表型[19,20]。雄性C57BL/6小鼠在青春期经历两周的慢性不可预见性应激后会增加F1和F2的焦虑和抑郁样行为,这种代际或跨代遗传的产生的后代杏仁核中会产生更为显著的差异基因表达[21]。成年雄性大鼠喂养甲基化供体耗尽或对照饮食5周后与正常雌鼠交配,其甲基化供体耗尽饮食组的F1代表现出焦虑和抑郁样行为的增加[22]。
结合既往研究,我们推测本研究中祖父和父亲交配前高复合饮食两次暴露导致F2焦虑和抑郁样行为的增加可能是通过精子表观遗传学的改变发生的。此外,单胺递质假说、HPA轴异常和脑源性神经营养因子等学说均揭示了焦虑症和抑郁症的发病机制,遗憾的是我们未对神经内分泌中与焦虑症和抑郁症发病机制学说相关的分子标记物进行检测。下一步,我们将从表观遗传机制和分子机制方面研究父系交配前高复合饮食暴露导致后代出现焦虑和抑郁样行为的原因,从而阐明父系编程在后代出现焦虑和抑郁样行为的具体机制。

