猕猴桃溃疡病田间快速检测技术优化
付 博,王家哲,任 平,张 锋,李英梅
(1.陕西省生物农业研究所 有害生物监测与防控研究中心,西安 710043;2.陕西省酶工程技术研究中心,西安 710600)
陕西省猕猴桃种植面积和产量分别占世界1/3和全国1/2以上,近年来,随着陕西省猕猴桃产业“东扩南移”战略的稳步实施,预计到“十三五”期间猕猴桃总种植面积可达10万hm2以上,产业规模继续保持全国首位[1]。但是随着种植面积的不断扩大,猕猴桃相关病害也日益增多,其中最严重的是猕猴桃细菌性溃疡病(Pseudomonassyringaepv.actinidae)。该病于1980年首次在日本发现,而后在世界各地相继出现,陕西自1991年在长安太乙宫首次发现猕猴桃溃疡病,受害面积逐年扩大,并逐渐演变成难以治愈的顽疾,被当地农民称为猕猴桃的“癌症”。一般果园发病率37.5%,病情指数18.85,严重果园植株死亡率达47%,甚至毁园,平均产量损失10%~15%,严重者达60%以上,给果农带来了巨大的经济损失[2-4]。
猕猴桃溃疡病的致病菌为喜低温高湿的弱寄生细菌,可在土壤、植物体和病残体内长期潜伏,当环境条件适宜时快速繁殖、发病[5]。国内外研究表明,猕猴桃溃疡病致病菌在侵染的初期阶段最易治愈,但由于潜伏期不表现病症,因此很难判断是否感染,从而错过了最佳的防治时期,一旦病情表现为菌脓流出,则任何防治措施都无效[6-7]。因此,猕猴桃溃疡病田间的无症带菌状态的早期诊断十分必要,是掌握病情发展阶段的重要依据,也是猕猴桃溃疡病防治的关键[8]。
本研究对猕猴桃溃疡病快速检测体系进行优化,并对田间猕猴桃溃疡病无症样本进行特异性PCR分子检测,建立田间快速检测的方法,为实现猕猴桃溃疡病早期诊断,控制病情发展提供技术支撑。
1 材料与方法
1.1 供试菌种
供试菌株为M13,由有害生物监测与防控研究中心实验室分离、保藏。
1.2 PCR特异引物
PsaF1(5′-TTTTGCTTTGCACACCCGAT- TT-3′)和PsaR2(5′-CACGCACCCTTCAATCAGGATG-3′)设计参考文献[9]的方法,扩增目的片段为细菌16S-23S rDNA ITS部分区域[8]。
1.3 PCR反应体系
反应体系25 μL,其中不含Mg2+的10×buffer 1.5 μL,10 mmol/L dNTP 0.5 μL,25 mmol/L MgCl21.5 μL,上/下游引物各10 μmol/L 1.25 μL,5 U/μLTaq酶2.062 μL,DNA模板2 μL,无菌去离子水16.938 μL。PCR扩增反应程序为:95 ℃ 2 min;94 ℃ 15 s,58 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。PCR扩增产物经20 g/L琼脂糖凝胶检测,目的条带大小280 bp,根据实际扩增情况进行适当调整。
1.4 待测样品的制备条件优化
取新鲜猕猴桃溃疡病病健交界处组织(直径约3~5 mm,叶片病斑)0.1 g,切碎后等量装入4支1.5 mL离心管中,分别加入4种不同的样品浸泡液:磷酸缓冲液[9]、金氏B培养液[10]、PDA培养液[11]、LB培养液[12],26 ℃分别浸泡8 h后各吸取1 μL浸泡液作为PCR反应模板。进一步设置浸泡时间为2 h、5 h、8 h、12 h和16 h,根据特异性条带的亮度选出最佳的浸泡时间。试验设3次重复。
1.5 化学增强剂对PCR检测效果的影响与优化
PCR反应体系中以制备的浸提液为模板,分别加入终质量浓度为50 μg/mL牛血清白蛋白(BSA)、体积分数为10%甘油及0.1 mg/mL白明胶作为反应增强剂。根据特异性条带亮度,筛选出最佳的化学增强剂,并进一步对其使用浓度进行优化。
1.6 无症带菌样品的优化处理
取新鲜健康猕猴桃叶片,剪成32片(约2 mm×10 mm),8片为一组,共4组,分别放入1.5 mL离心管Ⅰ、Ⅱ、Ⅲ、Ⅳ中,取1 mL金氏B培养液和10 μL 4.0×108cfu/mL的猕猴桃溃疡病原菌液加入管中,作为模拟的无症带菌样品。处理Ⅰ:浸提液直接作为PCR反应体系模板;处理Ⅱ:浸提液10 000 r/min离心6 min,弃上清液,加入30 μL ddH2O,混匀后作为PCR反应体系模板;处理Ⅲ:加入终质量浓度为3 mg/mL的Na2SO3,26 ℃浸泡8 h后作为PCR扩增模板;处理Ⅳ:加入终质量浓度为3 mg/mL的Na2SO3,26 ℃浸泡8 h,10 000 r/min离心6 min,弃上清液,加入30 μL 3 mg/mL的Na2SO3混匀后作为PCR扩增模板,以新鲜显症猕猴桃叶片作为阳性对照。根据电泳条带亮度,筛选最佳的处理方式。设3次重复。
1.7 模板量对PCR扩增的影响
新鲜猕猴桃溃疡病病健交界处组织1 g,10 mL浸泡液制样后,分别取混匀的浸提液1 μL、 1.5 μL、2 μL、2.5 μL、3 μL、3.5 μL作为模板进行PCR扩增,根据电泳条带的亮度,确定最佳模板量。
1.8 田间猕猴桃溃疡病最佳检测时期的确定
采集陕西周至县猕猴桃植株萌芽期(2月上旬至3月上旬)、发芽期(3月中下旬至4月中旬)、孕蕾至开花期(4月中旬至5月中旬)、生理落果期(4月下旬至5月下旬)、果实成熟期(8月中下旬至9月下旬)和休眠期(11月下旬至1月下旬)当年生无症枝条和叶片(或芽苞),按照本试验中优化的PCR检测方法,分析不同发育期猕猴桃溃疡病的检出率,确定田间PCR检测猕猴桃溃疡病的最佳时期。
2 结果与分析
2.1 样品浸泡液及浸泡时间的确定
浸泡液的浸提效果比对结果显示(图1),金氏B浸泡液制备的模板在PCR扩增后呈现的DNA靶带清晰明亮,浸提效果最好,其次分别为样品PDA培养液、LB培养液、磷酸缓冲液,3次重复的结果一致。样品浸泡时间筛选的结果显示(图2),浸泡2 h和5 h均未检出扩增产物,说明浸泡时间过短;但是浸泡时间超过12 h,也未检出目的片段,这可能是由于浸泡时间过长导致植物色素、多元酚等干扰物质的量增多,从而抑制了PCR扩增反应。当样品浸泡8 h、12 h时,PCR检测效果均较好,为了达到快速检测的目的,最终确定样品浸泡时间为8 h。
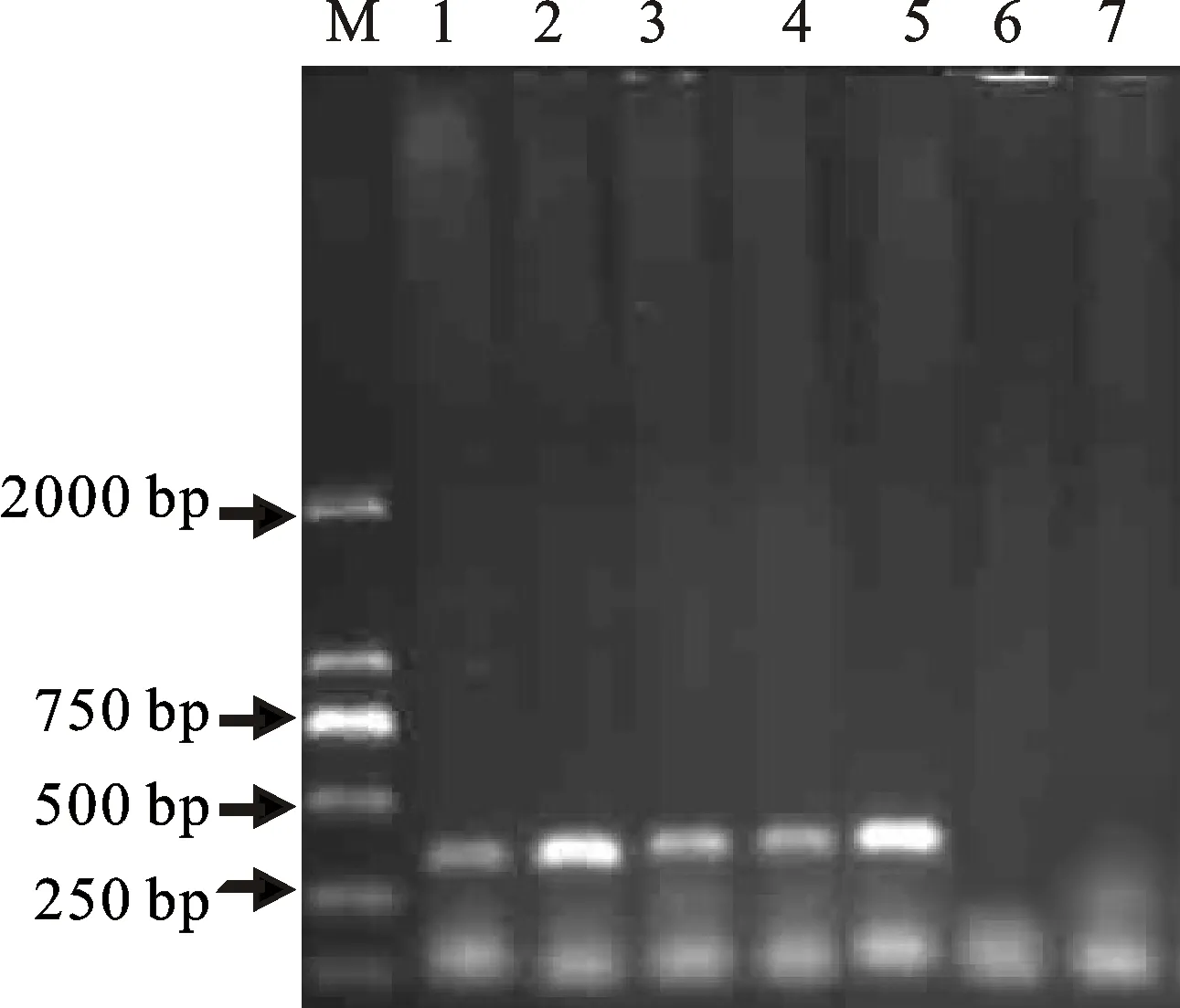
M.100 bp DNA Ladder;1.磷酸缓冲液;2.金氏B浸泡液;3.PDA培养液;4.LB培养液;5.阳性对照;6.清水空白对照;7.不含模板的阴性对照

M.100 bp DNA Ladder;1~5.样品浸泡时间依次为2 h、5 h、8 h、12 h、16 h;6.阳性对照;7.清水空白对照;8.不含模板的阴性对照
2.2 PCR反应中化学增强剂的作用效果
加入甘油或BSA后,比未加化学增强剂的PCR扩增条带明显变粗、变亮,增效显著;但白明胶对PCR扩增没有增效作用(图3)。从扩增的特异性电泳条带结果可见,当化学增强剂为φ=10%的甘油与50 μg/mL的BSA时,增效没有显著性差异,但由于BSA价格昂贵,因此确定选用甘油作为增强剂。进一步检测甘油体积分数对PCR反应效果的影响,结果显示φ=10%的甘油增效最明显(图4)。
2.3 无症带菌猕猴桃样品的处理优化结果
采用4种不同方式处理无症带菌猕猴桃样品,结果显示,加入浓度为3 mg/mL的Na2SO3并浓缩后的PCR检测效果最好(图5)。
2.4 模板量对PCR扩增的影响
按照文中“1.7”的方法制备溃疡病检测样品模板,通过加入不同模板量,比对PCR扩增检测效果,结果显示当模板量为1 μL、1.5 μL和2 μL时均可扩增出目标靶带,其中模板量为1 μL~ 2 μL效果最好;而模板量为2.5 μL、3 μL及3.5 μL时均未扩增出DNA靶带(图6)。

M.100 bp DNA Ladder;1.无化学增强剂对照;2.φ=10%甘油;3.50 μg/mL BSA;4.0.1 mg/mL白明胶;5.菌液阳性对照;6.清水空白对照;7.不含模板的阴性对照
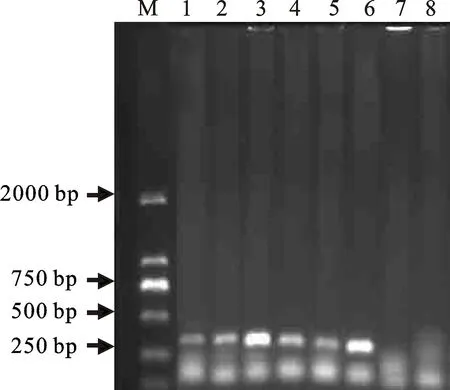
M.100 bp DNA Ladder;1.不含甘油;2~5.甘油体积分数依次为5%,10%,15%,20%;6.阳性对照;7.清水空白对照;8.不含模板的阴性对照
2.5 PCR检测方法在猕猴桃不同发育期的应用效果
采用优化后的PCR方法检测猕猴桃不同发育期的无症带菌枝条和叶片(或花苞),结果显示(图7),猕猴桃树孕蕾至开花期的新生枝条,猕猴桃溃疡病的检出率最高,可达91.8%,同时期的无症带菌叶片检出率则为63.6%;猕猴桃其他发育时期不同检测部位的检出率均在63.6%以下。因此,在开展田间病害调查时,建议主要检测对象为孕蕾至开花期猕猴桃新生枝条,能够更加快速、准确、容易地检出致病菌,有利于提前预警并开展相关病害防治工作。

M.100 bp DNA Ladder;1~2.处理Ⅰ;3~4.处理Ⅱ;5~6.处理Ⅲ;7~8.处理Ⅳ;9.阳性对照; 10.清水空白对照;11.不含模板的阴性对照

M.100 bp DNA Ladder,1~6.每个反应体积(25 μL)的模板量依次为1.0 μL,1.5 μL,2.0 μL,2.5 μL,3 μL,3.5 μL;7.阳性对照;8.清水空白对照;9.不含模板的阴性对照

图7 PCR方法检测猕猴桃不同发育期无症带菌样本Fig.7 PCR method for detection of virgin bacteria at different developmental stages
3 讨论与结论
猕猴桃溃疡病是由丁香假单胞菌猕猴桃致病变种(Pseudomonassyringaepv.actinidae)引起的细菌性、毁灭性病害,栽培种植过程中缺乏有效的检疫措施,通常在表现症状时才开始防治,很难有效控制病情,且由于病原菌清除不彻底造成菌体潜伏,从而逐年发病且越来越严重[13-15]。近年来,分子生物学技术在植物病害田间检测中的应用越来越多,其中PCR检测方法具有特异性好、实验成本相对较低、反应时间短等优点,更加适合在田间开展病害的快速诊断[16-17]。猕猴桃溃疡病为植株系统性病害,具有较强的隐蔽性,借助分子检测方法有助于及早发现病菌潜伏期的猕猴桃溃疡病株,并提前采取有效措施进行病害防控[7,18]。
本研究通过对田间采集的无症带菌猕猴桃样品的PCR检测条件进行优化,并采用特异性引物扩增细菌16S-23S rDNA ITS部分区域,可有效检出猕猴桃溃疡病的致病菌。张慧琴等[19]、伊春峰等[20]采用基于特异性引物扩增的PCR检测方法鉴定了已分离纯化的猕猴桃溃疡病致病菌,与本研究扩增的目的片段结果一致。但是与文献中报道的针对分离纯化菌株进行鉴定不同,本研究中的检测样品为田间采集的猕猴桃植株活体样本,通过检测条件优化,能够直接、快速、准确判断无病症表现的猕猴桃植株是否已被溃疡病致病菌侵染,因此,对指导PCR特异性分子检测在田间的应用更具有实际参考价值。
对田间采集的样本进行PCR模板制备时要排除多种因素的影响:(1)干扰物的抑制 在样本浸泡液中加入浓度为3 mg/mL Na2SO3能够降低植物色素和多元酚等PCR反应抑制物的干扰,特别是浓缩后的浸提液对PCR扩增效果明显提高,这与靶细菌浓缩导致的模板量增大有关,但是随着模板量逐渐增加,PCR反应体系中的植物色素、多元酚等抑制物也相应增多,对PCR扩增反应产生一定的抑制,因此要适当控制实测中的模板量。(2)植株生长期 影响无症带菌样本检出率的最显著因素是猕猴桃的生长期,研究结果显示,在猕猴桃孕蕾至开花期的新生枝条中溃疡病致病菌的检出率最高,是最佳的田间诊断时期,对提前有效检出带病植株并尽早针对猕猴桃溃疡病实施田间防控,特别是对新建园区,具有重要意义。

