含硫醚和砜亚结构的新型芳香酰胺类衍生物的设计、合成及生物活性
华学文*,刘南南,周沙,张蕾蕾,殷昊,王桂清,范志金,马翼
1. 引言
近年来,土壤线虫危害日趋严重,特别是根结线虫危害在一些地区有暴发的态势[1,2]。目前,市场上广泛应用的土壤线虫化学防治药剂主要是噻唑磷(fosthiazate)和阿维菌素(avermectin)B2a(图1)。传统的高毒或剧毒杀线虫剂,如氨基甲酸酯类涕灭威(carbamates aldicarb)、克百威(carbofuran)、杀线威(oxamyl),有机磷酸酯类克线磷(fenamiphos)、硫线磷(cadusafos)、丰索磷(fensulfothion)等,在中国已被禁止或者限制使用。早期的熏蒸剂,如溴甲烷等也因破坏臭氧层而被逐渐淘汰。
新型杀线虫剂的研究对土壤线虫防治十分重要。目前,杀线虫活性组分的开发主要依靠筛选现有杀虫剂、除草剂或杀菌剂对线虫的防治效果,这导致了新型杀线虫剂开发缓慢以及线虫防治药剂严重不足。近期,一些农用化学品企业报道了多种新型杀线虫剂活性成分(图 2),其中,氟吡菌酰胺(fluopyram)是由德国拜耳公司成功开发的新型酰胺类杀线虫剂,同时也被用作广谱杀菌剂[3-6],其作用机制为抑制线粒体呼吸电子传递链上的琥珀酸脱氢酶(SDH)[7]。随后,其他具有杀线虫活性的酰胺类结构被相继报道(图3)[8-14]。
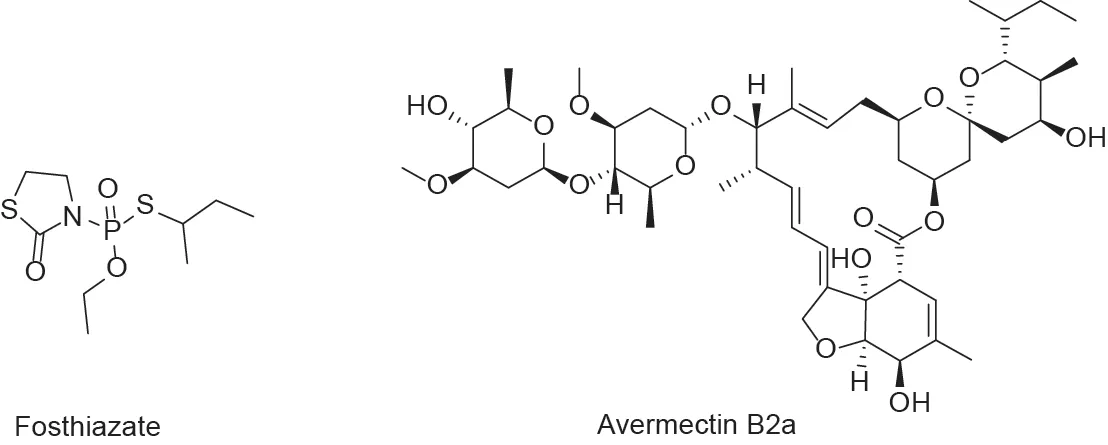
图1. 噻唑磷和阿维菌素B2a的化学结构。
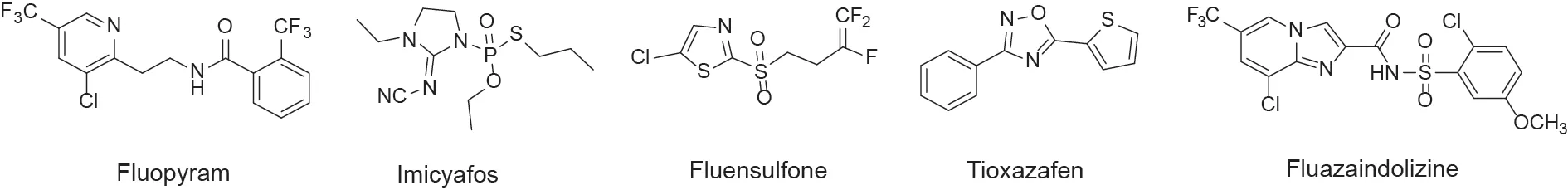
图2. 近期成功开发的杀线虫剂活性成分。
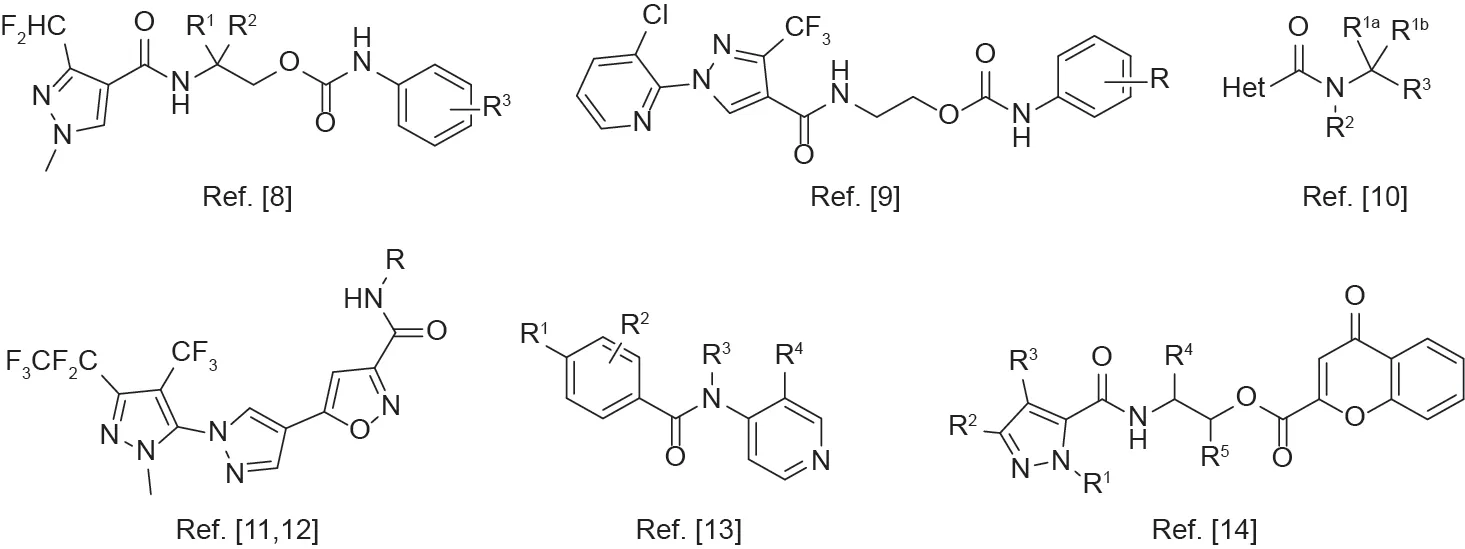
图3. 近期报道的杀线虫的酰胺类化合物结构。Het:取代的芳香杂环。
植物病害严重威胁作物生产,而杀菌剂的使用在过去、现在以及未来都是防治植物病害的有效途径[15]。在国际杀菌剂抗性行动委员会(FRAC)列出的超过224种杀菌剂种类中,琥珀酸脱氢酶抑制剂(SDHI)类杀菌剂在新产品开发及商品化方面是增长最快的一类杀菌剂[16]。自第一种SDHI杀菌剂萎锈灵于1966年被成功开发以来,目前已有23种商品化的SDHI杀菌剂获批用于防治植物病原真菌,如核盘菌(Sclerotinia sclerotiorum)、丝核菌(Rhizoctonia solani)、灰霉菌(Botrytis cinerea)等,其中氟吡菌酰胺具有一个独特的酰胺桥结构[17,18]。
鉴于上述已报道的大多数新型杀线虫结构具有杂环、硫醚、砜和酰胺亚结构[19,20],同时考虑到氟吡菌酰胺合成制备过程中涉及高温脱羧或者高压还原[21],本文通过将硫醚、砜和各种芳香环引入氟吡菌酰胺的分子骨架中,设计合成了两个系列的目标化合物(图4)。目标化合物I-1 ~ I-12、II-1 ~ II-12以及中间体4a的合成路线如图5所示,该合成路线具有合成方便、后处理简单、收率高等优点。
2. 材料与方法
2.1. 试剂与设备
所有反应试剂均为分析纯。目标化合物的熔点通过X-4显微镜熔点仪(河南省巩义市予华仪器有限责任公司)测定。1H和13C核磁共振(NMR)谱图通过Bruker AV-400光谱仪(400 MHz)测定,以四甲基硅烷为内标,以百万分率(ppm)表示化学位移。质谱数据通过Varian 7.0 T FTMS高分辨质谱仪(HRMS)测定。柱层析纯化所用硅胶为200~300目。
2.2. 目标化合物的合成
中间体3和4a以及目标化合物I-1 ~ I-12、II-1 ~II-12通过已报道的合成方法制备[8,22,23]。相应的合成路线及结构表征数据见Supplementary data。
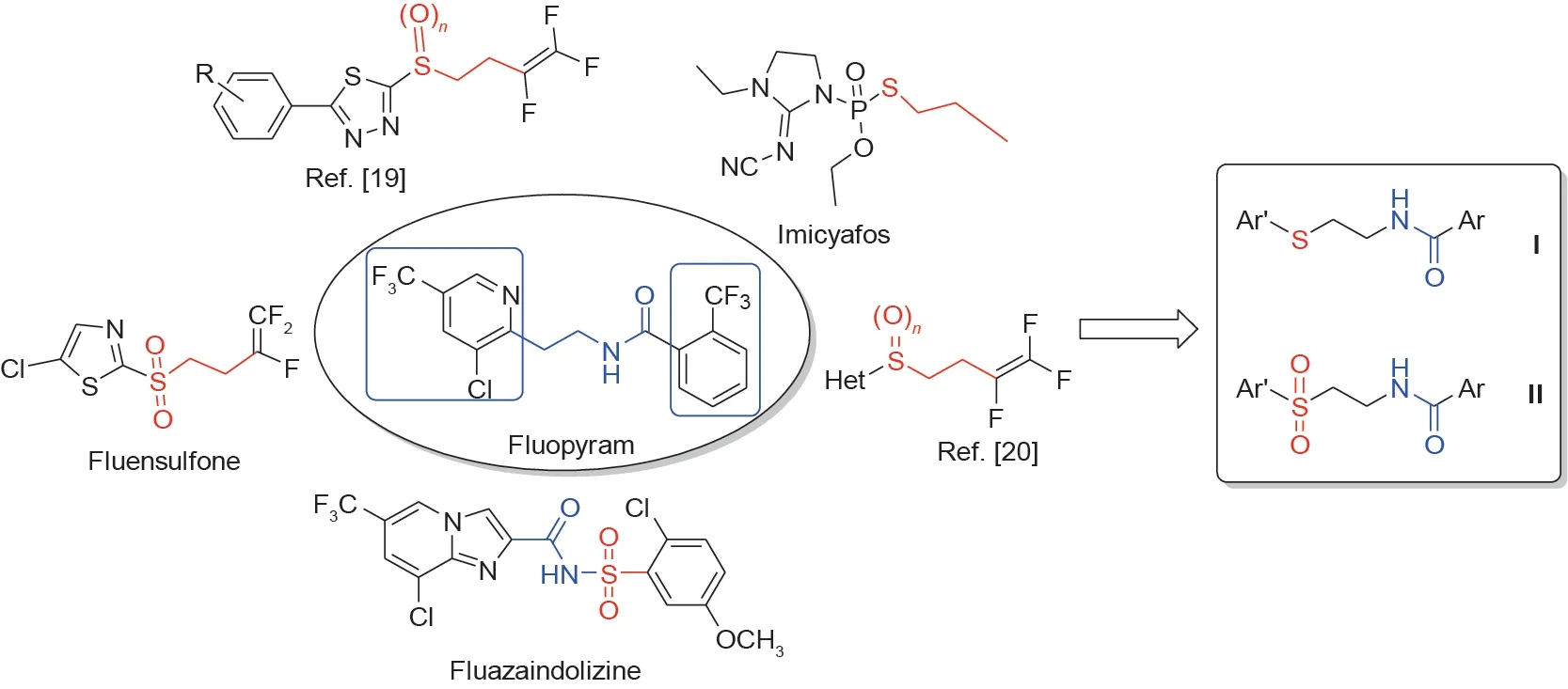
图4. 目标化合物的设计思路。Ar、Ar′:取代的芳香环。
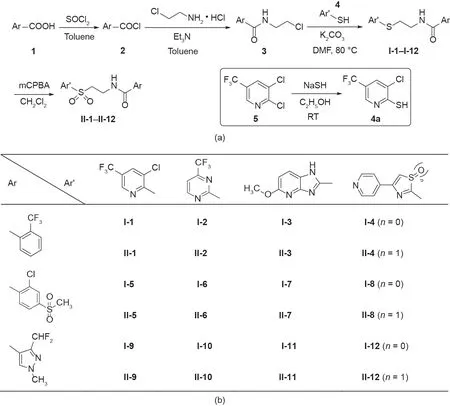
图5. 目标化合物的合成路线。(a)目标化合物的有机合成路线;(b)不同取代的芳香环结构。DMF:N,N-二甲基甲酰胺;mCPBA:间氯过氧化苯甲酸;RT:室温;Et:乙基。
2.3. 生物活性筛选
目标化合物对南方根结线虫(Meloidogyne incognita)的杀线虫活性测试参照文献[24,25]的方法。用稀释后的次氯酸钠(NaOCl)溶液从受感染的番茄(Solanumlycopersicum)根茎中提取南方根结线虫的卵,充分冲洗后,将卵铺展到孔径为30 μm的尼龙滤网上,将滤网放置到含水的培养皿中,在25 ℃温度下培养。每天收集二龄幼虫(J2)并直接将其用于生物活性测试。通过将目标化合物溶解在二甲基亚砜中,并用0.1%的吐温-80水溶液稀释,制备待测溶液。将待测溶液加入到24孔组织培养板中,每孔二龄线虫的浓度大约为每毫升水含100条二龄线虫,然后盖上24孔组织培养板盖,于(25 ± 1)℃温度下进行培养,每个处理重复三次,24 h后用体视显微镜观察线虫死亡率。如果线虫虫体静止不动(如虫体笔直),即使转入到清水中12 h后仍然静止不动,则认为线虫死亡。
此外,鉴于对照药氟吡菌酰胺的杀菌活性,通过菌丝生长抑制法[26]测定了目标化合物的离体抑菌率。测试的常见植物病原真菌为玉米纹枯病菌(Rhizoctonia solani,RS)、小麦赤霉病菌(Gibberella zeae, GZ)、苹果轮纹病菌(Physalospora piricola, PP)、桃褐斑病菌(Cercospora circumscissa, CS)、梨黑斑病菌(Alternaria kikuchiana, AK)、黄瓜灰霉病菌(Botrytis cinerea,BC)、辣椒炭疽病菌(Colletotrichum capsici, CC)以及茄褐纹病菌(Phomopsis vexans, PV)。
2.4. 分子对接
采用SYBYL 6.9软件中的Surflex-Dock方法[27]研究具有优异杀菌活性的目标化合物I-9与SDH的分子对接模型。文献[7]报道氟吡菌酰胺为SDHI,特异性结合到线粒体SDH的泛醌结合位点(Q-位点)。根据泛醌在大肠杆菌(E. coli)SDH的Q-位点的结合位置(PDB ID:1NEK)[28],将化合物I-9和氟吡菌酰胺对接到大肠杆菌SDH的Q-位点。受体和配体分子的准备工作参照标准方法完成。
3. 结果与讨论
3.1. 化学合成
关键的中间体3和目标化合物I-1 ~ I-12、II-1 ~II-12按照Supplementary data中的步骤合成制备。首先,酰氯中间体2通过芳香甲酸酰化制备,然后与2-氯乙胺盐酸盐反应得到酰胺中间体3。芳香硫酚4通过购买市售产品或者实验室制备得到,其中,3-氯-5-三氟甲基吡啶-2-硫酚(4a)通过2,3-二氯-5-三氟甲基吡啶和硫氢化钠反应制备。最后,N-(2-氯乙基)芳香酰胺中间体3和硫酚4反应得到目标化合物I-1 ~ I-12,用间氯过氧化苯甲酸(mCPBA)进一步氧化得到II-1 ~ II-12。然而,在过量的mCPBA作用下,目标化合物I-4、I-8和I-12中噻唑环上的硫原子进一步被氧化为亚砜结构,得到目标化合物II-4、II-8和II-12。由于硫醚亚结构的引入,使得目标化合物的合成路线相较对照药氟吡菌酰胺的更加方便、快捷,同时避免了高温、高压等反应条件。目标化合物的结构通过1H NMR、13C NMR和HRMS进行表征,部分结构参数通过化合物I-3的单晶结构(CCDC No. 1830647,图6)揭示。
3.2. 生物活性
目标化合物对南方根结线虫的杀线虫活性见表1,以氟吡菌酰胺为阳性对照。由表1数据得出,与对照药氟吡菌酰胺相比,大多数目标化合物在200 μg·mL-1浓度下显示了优异的杀线虫活性,但化合物I-2除外。当测试浓度降低为100 μg·mL-1时,目标化合物的杀线虫活性大大降低,然而化合物I-11和II-6仍然显示出了较好的杀线虫活性,线虫死亡率分别为75%和70%,以上结果将为探索潜在的杀线虫剂先导化合物提供一定的理论指导。此外,针对含硫醚和砜亚结构的目标化合物而言,两者之间的杀线虫活性无明显差异。
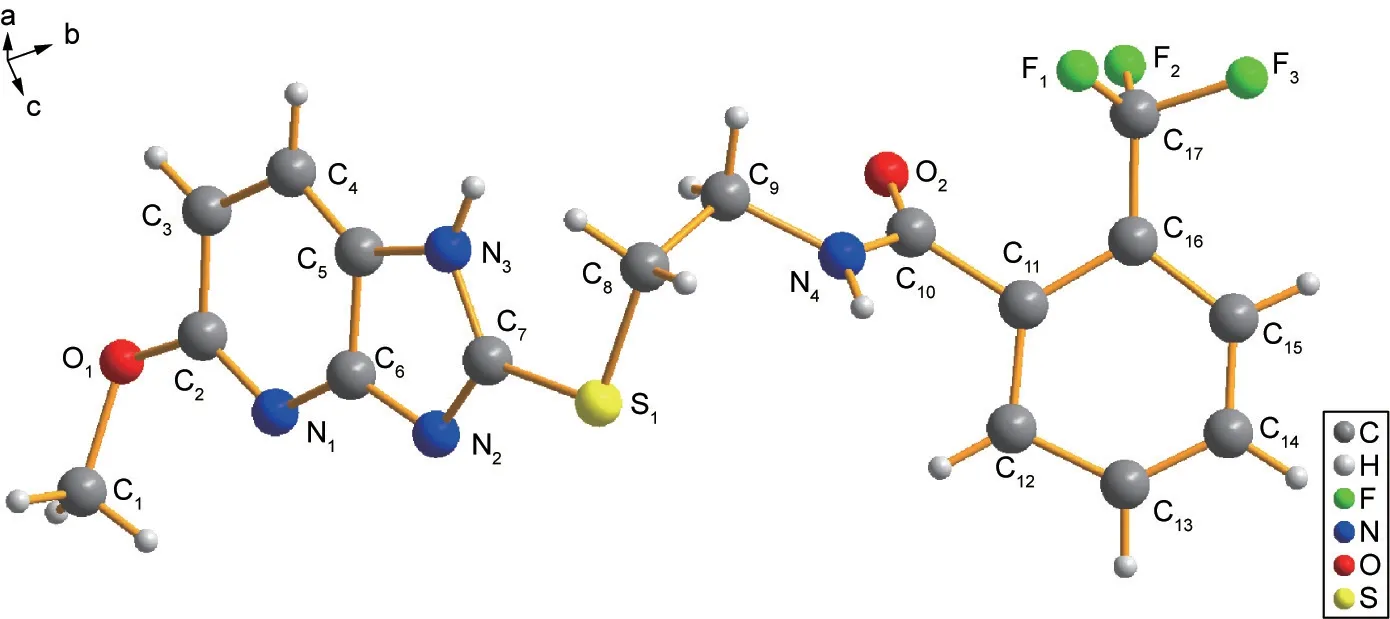
图6. 化合物I-3的单晶结构。
鉴于对照药氟吡菌酰胺的杀菌活性,测试了目标化合物的抑菌率,结果见表2。由表2可知,与氟吡菌酰胺相比,大多数目标化合物显示出了相对较弱的杀菌活性,然而化合物I-9除外,其抑菌率几乎与对照药相当。同时,与杀线虫结果类似,针对含硫醚和砜亚结构的目标化合物而言,两者之间的杀菌活性无明显差异。基于以上结果,氟吡菌酰胺结构中硫醚和砜亚结构的引入和芳香杂环的替换对目标化合物的杀菌活性影响较大,这可能是由于酰胺桥长度的改变影响了化合物与靶标酶结合的优势构象,这些结果对探索和开发潜在的杀菌剂先导化合物具有重要的指导意义。
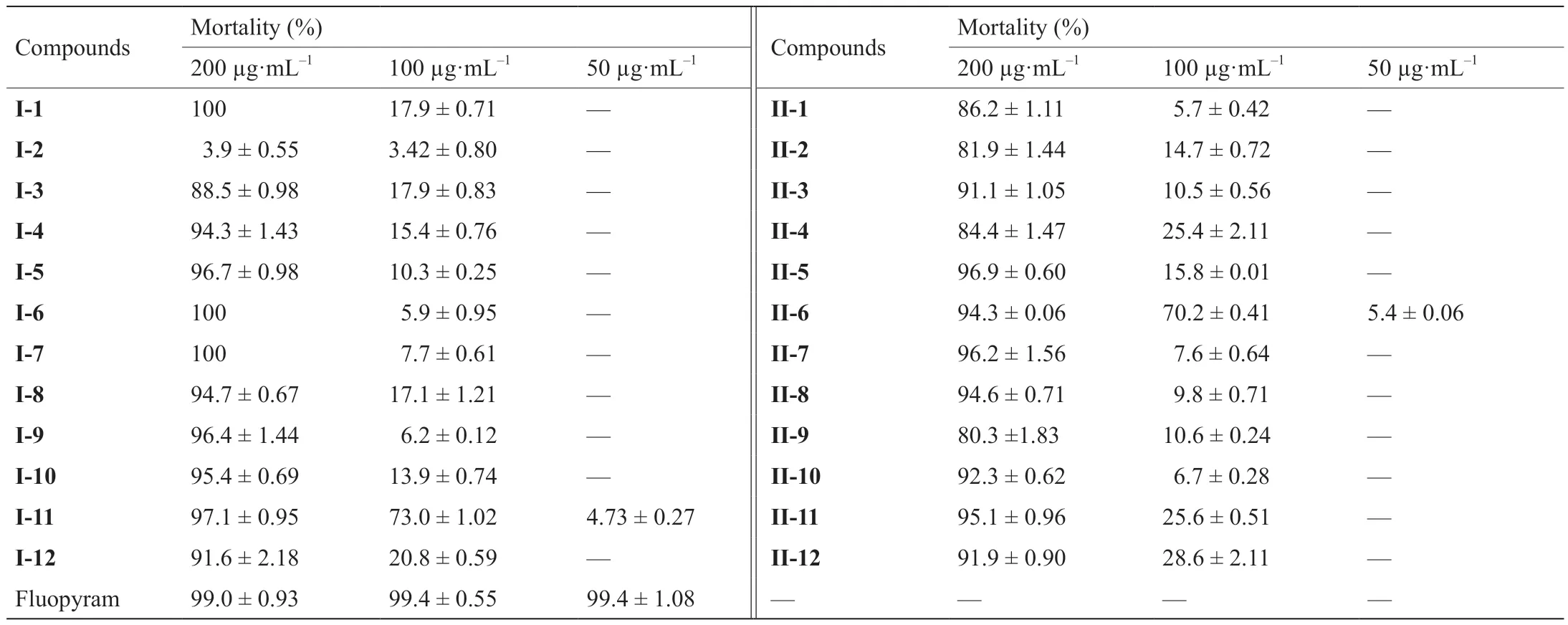
表1 目标化合物对南方根结线虫的杀线虫活性
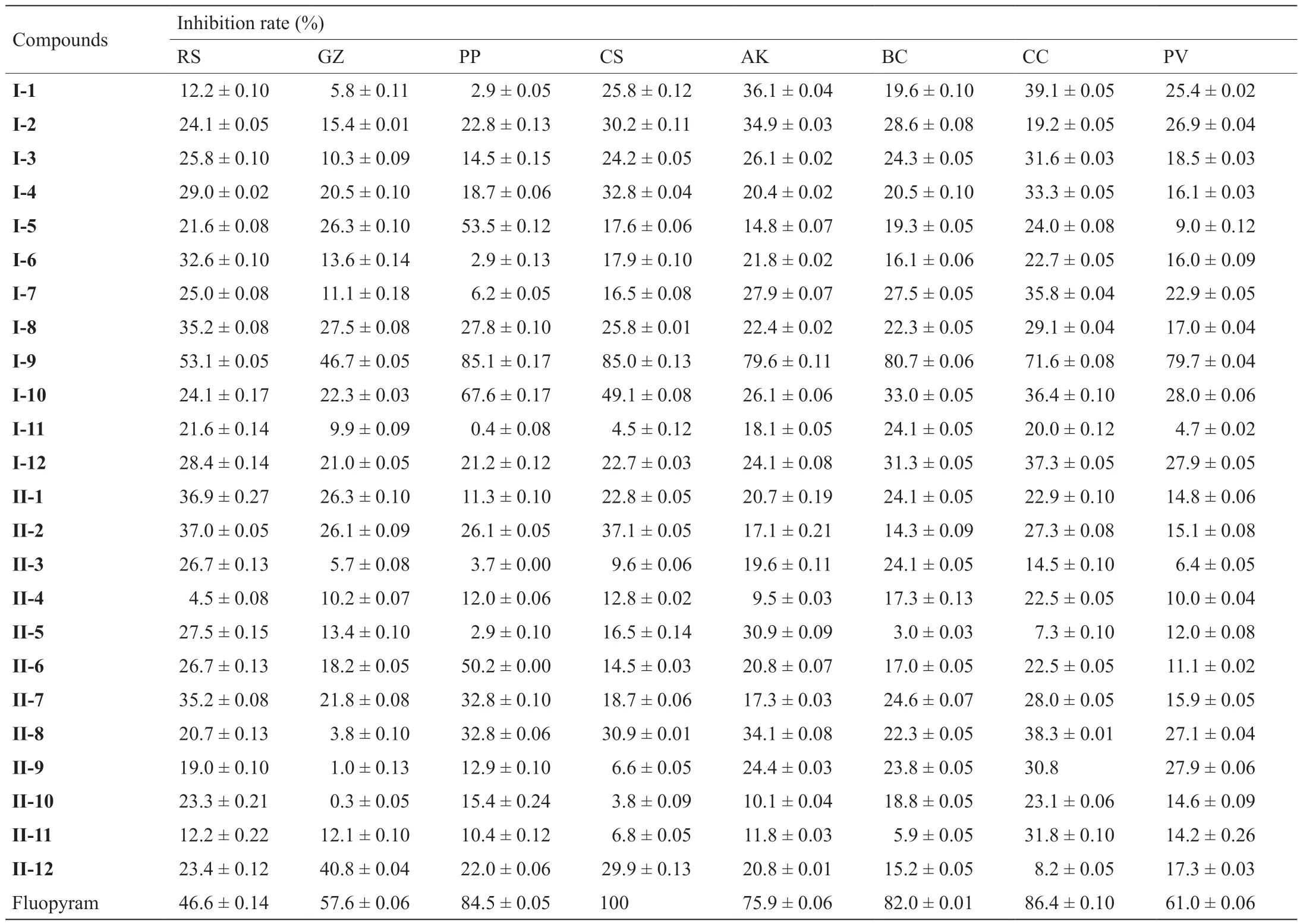
表2 目标化合物在100 μg·mL-1浓度下的杀菌活性
为了进一步评估化合物I-9的杀菌活性,测试了其与氟吡菌酰胺对测试植物病原真菌的EC50值,结果见表 3。由表中数据得出,化合物I-9和氟吡菌酰胺对小麦赤霉病菌的抑制活性均较弱,并且化合物I-9的抑制活性相对弱于对照药氟吡菌酰胺。然而,总体上,化合物I-9对黄瓜灰霉病菌、辣椒炭疽病菌以及茄褐纹病菌显示出明显优于其他测试病原真菌的杀菌活性。
3.3. 分子对接模拟
文献[7]报道杀菌和杀线虫剂氟吡菌酰胺的作用机制为抑制线粒体呼吸电子传递链上的复合体II,即SDH或琥珀酸辅酶Q还原酶(SQR)。虽然目前氟吡菌酰胺与靶标酶SDH之间的复合晶体结构尚未在蛋白质数据库(RSCB PDB)中被报道,但文献[28]指出作用于SDH的酰胺类杀菌剂特异性地结合到复合体II的辅酶Q位点。因此,研究配体与靶标酶之间的结合模式将为揭示离体杀菌结果提供一定的理论指导。
运用SYBYL软件中的Surflex-Dock模块模拟化合物I-9、氟吡菌酰胺和大肠杆菌SDH(PDB码:1NEK)之间的相互作用,结果见图7。由图中数据得出,氟吡菌酰胺结构中酰胺键上的羰基氧和邻三氟甲基基团上的氟原子的存在有助于其与靶标酶辅酶Q位点的氨基酸残基B/TRP-164、D/TYR-83和C/ARG-31形成氢键相互作用,这有利于改善杀菌活性。同时,三氟甲基基团与酰胺键上的羰基氧处于酰胺桥的同侧,这有助于二者共同与氨基酸残基B/TRP 164形成氢键相互作用[图7(a)]。
当将3-二氟甲基-1-甲基-1H-吡唑引入酰胺桥后,酰胺键邻位二氟甲基基团上氟原子的存在有助于其与氨基酸残基之间形成氢键相互作用,这与氟吡菌酰胺的结合模式近乎一致。考虑到氟吡菌酰胺和目标化合物I-9的优异杀菌活性及其结构特点,结合分子对接结果,可以得出酰胺键及其邻位含氟基团的存在对化合物的杀菌活性至关重要。另一方面,在芳香硫醚部分引入不同的芳香环以及改变酰胺桥的长度对目标化合物的生物活性有重要影响。

表3 化合物I-9和氟吡菌酰胺的EC50值
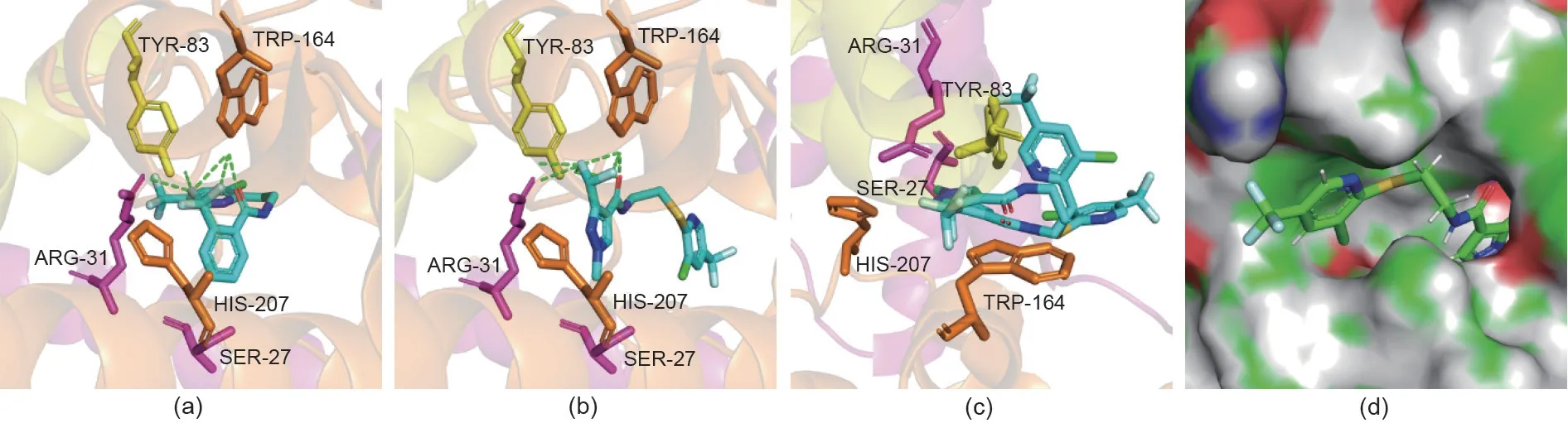
图7. (a)氟吡菌酰胺与大肠杆菌SDH(PDB码:1NEK)的结合模型;(b)化合物I-9与大肠杆菌SDH的结合模型;(c)氟吡菌酰胺与化合物I-9的叠合构象;(d)化合物I-9与大肠杆菌SDH的对接口袋。TYR、TRP、ARG、HIS、SER是氨基酸残基。
4. 结论
本文通过将硫醚和砜亚结构引入氟吡菌酰胺母体骨架中,设计合成了24种结构新颖的目标化合物。经生物活性测试发现,目标化合物的结构修饰对化合物的杀线虫和杀菌活性存在不同程度的影响。虽然硫醚和砜亚结构的引入使得目标化合物的合成路线得到优化,但是生物活性受到重要影响。通过各种芳香杂环的替换发现了具有良好杀线虫活性的化合物I-11、II-6以及具有优异杀菌活性的化合物I-9,结合分子对接模拟,该结果将为下一步的分子结构优化提供理论指导。
致谢
本文研究工作由山东省自然科学基金(ZR2017 BC053)、聊城大学博士科研启动基金(318051625)资助。
Compliance with ethics guidelines
Xuewen Hua, Nannan Liu, Sha Zhou, Leilei Zhang,Hao Yin, Guiqing Wang, Zhijin Fan, and Yi Ma declare that they have no conflict of interest or financial conflicts to disclose.
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2019.09.011.

