鼻窦低氧环境对鼻息肉内成纤维细胞分泌VEGF的作用研究
于 博,王吉喆,孙 东
(大连医科大学附属第二医院 耳鼻喉科教研室,辽宁 大连 116027)
慢性鼻窦炎并发鼻息肉是临床上常见的鼻科疾病,多见于成年人,好发于上颌窦,筛窦,中鼻道等部位,特别是后鼻孔息肉,多来自于上颌窦,经上颌窦自然开口而坠入后鼻孔[1]。其病理表现为鼻黏膜长期慢性炎症或鼻窦脓性分泌物经常刺激,鼻黏膜增生,充血,肿胀,静脉淤血,渗出增加,加之细菌毒素的作用,促使小血管渗出增加及黏膜水肿加重,久而发生鼻息肉变[2]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)作为一种高度特异性的促血管内皮细胞生长的因子,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用[3]。VEGF参与许多血管生成依赖性疾病的发展及其进展,包括息肉,癌症,某些炎症疾病等。
研究发现鼻息肉阻塞上颌窦自然口后,造成上颌窦内存在多种病理性环境,包括低氧,内毒素,各种细胞因子等,都可对VEGF增高及鼻息肉形成有促进作用[4],其中低氧作为其中最主要的一种病理环境,对VEGF的增生刺激尤为明显。但是病理状态下上颌窦内的低氧环境具体氧分压数值一直以来鲜有明确研究,本文针对临床上慢性鼻窦炎伴鼻息肉患者群,测出上颌窦内低氧压力平均值,结合基础实验方法,分离出鼻息肉内纤维原细胞,体外模拟鼻窦内低氧环境,研究低氧对纤维原细胞产生的VEGF的作用。
1 资料与方法
1.1 临床资料
选取2015年3月至2019年3月在大连医科大学附属第二医院耳鼻喉科门诊诊断慢性鼻窦炎伴鼻息肉并进行了鼻窦穿刺治疗的患者16例。其中男11例,女5例,年龄17~62岁,平均年龄(48.19±9.42)岁。患者慢性鼻窦炎临床病史均超过1年,临床保守药物治疗无明显改善,患者近3个月内无药物治疗,通过氧分压测定仪得出鼻窦内低氧的数据。患者手术摘除鼻息肉,标本均离体30 min内送至实验室,细切,至培养皿中培养原代成纤维细胞。16例患者中6例存在上颌窦内积液,取6例患者的鼻腔分泌物、鼻窦内积液和血浆,用ELISA试剂盒检测上清液中VEGF蛋白浓度。本实验涉标本已告知患者本人,签署知情同意书,并通过大连医科大学附属第二医院伦理委员会批准。
1.2 主要试剂与仪器
使用JUHN-TYM-TAP吸引器(XOMED,Jacksonville,FL)从鼻孔中段采集鼻息肉。使用商用试剂盒(英国Biosource公司)通过酶联免疫吸附试验(ELISA)测定血管内皮生长因子浓度,杜贝克培养基(DMEM)中培养。
1.3 方 法
1.3.1 氧分压的测定:16例慢性鼻窦炎伴鼻息肉患者临床结合鼻窦CT确诊后,下鼻道局部表面麻醉,鼻窦穿刺针于下鼻甲附着处斜上方进入上颌窦内,氧分压探针沿穿刺针管芯进入鼻窦,测出鼻窦氧分压数值。操作方法见示意图1。
图1 上颌窦穿刺模拟图 Fig 1 Maxillary sinus puncture simulation
1.3.2 鼻窦积液、鼻涕、血浆的获取:鼻窦积液获取:穿刺针进入上颌窦积液患者鼻窦后,负压抽出窦内分泌物;鼻腔分泌物获取:鼻内镜下直达窦口鼻道复合体位置,采取液体标本。血浆: 抽取静脉血2 mL,EDTA紫管,离心,取上清液。
1.3.3 鼻息肉摘除手术:全麻鼻内镜手术下摘除鼻孔中段息肉样肿物,经病理确诊为鼻息肉。
1.3.4 原代成纤维细胞提取及培养:用磷酸盐生理盐水彻底清洗鼻息肉标本,切碎,并在95%空气和5%二氧化碳的加湿环境下,在DMEM液中培养。用0.25%胰蛋白酶和0.02%乙二胺四乙酸(EDTA)提取成纤维原代细胞,在相同条件下分成两个培养皿传代,传代5~6次。这些多重通道不影响成纤维细胞的功能和生存能力。在倒置相差显微镜下观察培养的原代成纤维细胞的性质和纯度。用台盼蓝排斥法测定细胞存活率,在实验期间细胞存活率>95%。
1.3.5 ELISA检测:DMEM全培养基(含10%FBS,双抗)培养原代成纤维细胞于37 ℃,5%CO2孵箱4~5 d。胰酶消化后DMEM全培养基重悬细胞,以1×103个/孔接种于96孔板。次日待细胞贴壁后,换用DMEM培养基(无10%FBS,无双抗)。对照组继续37 ℃,5%CO2培养,实验组使用Gaspak袋(Becton公司)建立和维持缺氧培养条件;氧分压(PO2)在40~60 mmHg范围内。各组分别培养5、10、20 h后,ELISA检测VEGF水平。
1.4 统计学方法
用SPSS23.0软件进行统计学分析,上颌窦内氧分压非正态分布,采用Md(P25,P75)表示。其余实验结果均属于计量资料,符合正态分布,用Mean±SD表示,组间比较采用t检验的方法,P<0.05为差异有统计学意义。
2 结 果
2.1 上颌窦内氧分压及鼻腔分泌物、鼻窦积液、血浆中VEGF蛋白含量的测定
慢性鼻窦炎伴鼻息肉患者鼻窦氧分最低氧分压30 mmHg左右,最高氧分压73 mmHg左右,平均氧分压47.74(36.72,56.84)mmHg。 ELISA结果显示,6例存在上颌窦内积液的患者的鼻腔分泌物中VEGF蛋白的含量明显高于鼻腔分泌物和血浆(P<0.05,P<0.005)。见表1,图2。
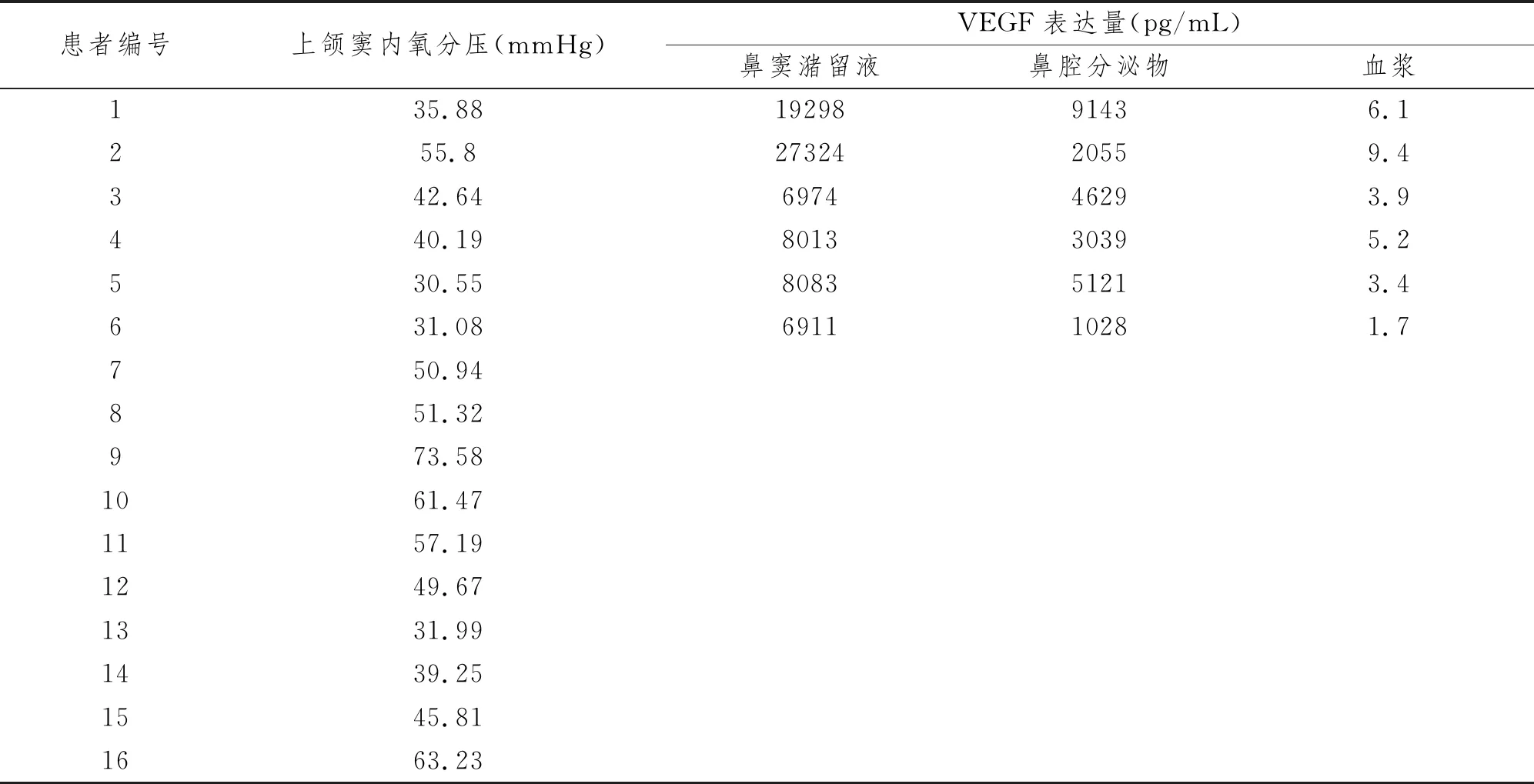
表1 上颌窦内氧分压及鼻腔分泌物、鼻窦积液、血浆中VEGF蛋白含量的测定
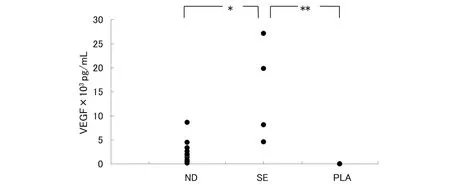
ND :鼻腔分泌物;SE :鼻窦积液;PLA :血浆。*P<0.05,** P<0.005图2 鼻腔分泌物、鼻窦积液及血浆中VEGF蛋白的浓度Fig 2 Expression of vascular endothelial growth factor in sinus effusion,nasal discharge and plasma
2.2 低氧环境对鼻息肉内纤维原细胞分泌VEGF产生的影响
ELISA结果显示息肉内提取的纤维原细胞在低氧环境下培养5 h产生的VEGF与普通氧分压环境下无差异;而10、20 h产生的VEGF比普通氧分压环境下明显增多,差异有统计学意义(P<0.05)。见表2。
3 讨 论
VEGF是最有效的促血管生成细胞因子之一,它在调节正常组织和致病组织的血管生成过程中起着重要作用,VEGF还在增加血管通透性,导致血管外渗出和水肿等方面发挥着病理作用。这些生理特征表明VEGF与慢性炎症,如鼻息肉和慢性鼻窦炎黏膜水肿增生病理变化有关,在鼻窦黏膜和鼻息肉中,已知上皮细胞和炎性细胞,如巨噬细胞、嗜酸性粒细胞和浆细胞,能产生血管内皮生长因子。而我们实验选择的鼻息肉成纤维细胞,也是产生VEGF的重要来源[5]。本实验通过ELISA和体外培养细胞研究,证明了在鼻腔和鼻窦内脓汁中都存在大量的VEGF,表明VEGF在鼻腔和鼻窦黏膜中都有局部产生。其中鼻窦内产生的VEGF数量远远大于其他部位,这也侧面证实了为什么鼻息肉多由上颌窦内发生。

表2 在普通环境下及低氧环境中成纤维细胞产生的VEGF含量比较
刺激VEGF增生的一个常见因素就是低氧环境,由于耳鼻喉科的特殊解剖特点,健康人上颌窦自然口正常状态下与鼻道相通,上颌窦内氧分压与空气中氧分压大致相当。当鼻窦窦腔在特定病理条件下处于堵塞状态,氧分压必然低于常态。因此,我们首先确定了慢性鼻窦炎患者上颌窦内一个重要病理因素,低氧环境[6],并由此测定了临床量化低氧分压。而在体外模拟大致相同的低氧环境,并在此环境下培养纤维原细胞,发现对比普通氧分压状态的培养基,低氧环境中纤维原细胞产生的VEGF含量有统计学意义的增强。因而尽快解决鼻窦炎鼻窦的低氧状态,开放堵塞的鼻窦窦口,对改善鼻窦炎的渗出及治疗有一定的临床指导意义。
缺氧最常见诱导人类风湿性关节炎滑膜组织成纤维细胞产生VEGF[7],然而,尽管成纤维细胞是鼻窦和鼻窦黏膜中的主要细胞成分,并且能够产生VEGF,但鼻腔内息肉成纤维细胞产生VEGF的研究仍不多见。本研究中鼻息肉成纤维细胞产生的VEGF水平低于滑膜成纤维细胞,可能是因为缺氧条件下的鼻窦内氧浓度仍然相对较高。在较低的氧分压下,鼻窦成纤维细胞可能产生更高水平的VEGF。鼻窦成纤维细胞比滑膜成纤维细胞产生VEGF低的另一个原因可能与它们的生理反应不同有关。这些发现提示成纤维细胞产生VEGF的能力取决于组织来源和炎症的存在与否。
因为慢性鼻窦炎病理条件下,鼻窦内不止单单存在低氧条件,还存在大量病理性细胞因子[8],近期我们的研究发现缺氧诱导的鼻息肉成纤维细胞产生VEGF被鼻窦内多种因素联合影响并增强。由此考虑,炎症因子和缺氧联合作用条件下的鼻窦增加了VEGF的产生,它们可能与慢性鼻窦炎的发病机制和持续性密切相关。

