CXCR4表达与三阴性乳腺癌的相关性研究
唐超莉

[摘要]目的 探讨趋化因子受体4(CXCR4)在三阴性乳腺癌中的表达及与复发转移预后的关系。方法 收集我院2015年5月~2018年1月的160例三阴性乳腺癌患者的组织,利用免疫组化法对CXCR4的表达进行分析,对其临床病理特征及CXCR4与无疾病进展时间、总生存时间的关系进行分析。结果 三阴性乳腺癌患者的年龄、腋窝淋巴结、CXCR4组间无病生存期(DFS)比较,差异有统计学意义(P<0.001)。年龄≤45岁、腋窝淋巴结阳性、CXCR4阳性有较短的DFS。CXCR4阳性较CXCR4阴性有更短的总生存期(OS)。结论 CXCR4过表达不仅是肿瘤侵袭性的标志,也可能是三阴性乳腺癌患者预后不良的标志。
[关键词]三阴性乳腺癌;趋化因子受体4;无疾病进展期;总生存期
[中图分类号] R737.9 [文献标识码] A [文章编号] 1674-4721(2020)7(a)-0118-04
Correlation study between CXCR4 expression and triple negative breast cancer
TANG Chao-li
Department of Oncology, Chongzuo People′s Hospital, Guangxi Zhuang Autonomous Region, Chongzuo 532200, China
[Abstract] Objective To investigate the expression of the chemokine receptor 4 (CXCR4) in triple negative breast cancer and its relationship with the prognosis of recurrence and metastasis. Methods A total of 160 cases of triple negative breast cancer from May 2015 to January 2018 in our hospital were collected, immunohistochemistry was used to analyze the expression of CXCR4. The clinicopathological features and the relationship between CXCR4, time of disease progression and total survival were analyzed. Results There were significant differences in the age, axillary lymph nodes and disease-free survival (DFS) of CXCR4 group (P<0.001). There were shorter DFS with age ≤ 45 years old, axillary lymph node positive and CXCR4 positive. The overall survival (OS) of CXCR4 positive patients was shorter than that of CXCR4 negative patients. Conclusion CXCR4 overexpression is not only a marker of tumor invasiveness, but also a marker of poor prognosis in triple negative breast cancer patients.
[Key words] Triple negative breast cancer; Chemokine receptor 4; Disease free survival; Overall survival
三阴性乳腺癌是指缺乏雌激素受体(ER)、孕激素受体(PR)和人类表皮生长因子受体2(HER2)的表达,占乳腺癌总数的15%~20%[1]。三阴性乳腺癌即使早期治疗复发的可能性也较高,尤其是远处转移,这种表型的转移进展通常以早期复发和肝、肺和中枢神经系统转移为主[2]。因此,找寻三阴性乳腺癌复发转移的靶点尤为重要。趋化因子受体4(chemokine receptor 4,CXCR4)是一种进化高度保守的G蛋白偶联受体,表达于外周血单核细胞、B细胞和幼稚T细胞。其配体CXCL12是一种稳态趋化因子,能够控制造血细胞的运输、黏附、免疫监视和发育[3]。CXCR4在三阴性乳腺癌中的表达鲜少报道。本研究对三阴性乳腺癌组中的CXCR4基因表达水平进行分析,旨在探讨CXCR4表达与患者临床病理特征、疾病复发转移及预后的关系。
1资料与方法
1.1一般资料
收集我院2015年5月~2018年1月收治的160例三阴性乳腺癌患者,年龄21~75岁,中位年龄51.6岁。160例三阴性乳腺癌病例為治疗过程中或治疗完成后发生首次复发转移的三阴乳腺癌患者,复发转移的部位包括胸壁(52例)、脑(36例)、肺(89例)、肝(103例)、骨转移(78例)、其他转移(41例),其他单个部位转移62例,多个部位转移98例。纳入标准:①曾行乳腺癌改良根治术,术后免疫组化证实为三阴性乳腺癌,术后病理证实为乳腺浸润性导管癌、髓样癌、其他类型癌;②术后经病理活检或临床证实出现胸壁复发或其他器官的远处转移;③根治性手术前未行任何抗肿瘤治疗;④女性,汉族,年龄21~75岁;⑤临床病理资料完整。排除标准:①合并其他部位恶性肿瘤或重要脏器严重疾病者;②乳腺癌根治术前已出现远处转移者;③年龄>75岁,不能耐受放疗、化疗者;④临床资料不完整者。本研究经崇左市人民医院医学伦理委员会批准,患者或其家属知情。所有病例均行乳腺癌改良根治术,其手术切除标本常规石蜡包埋、固定后行HE染色,经2名病理科医生按世界卫生组织(WHO)《乳腺病理组织学分类》(2003新版)标准读片确认其病理类型。
1.2免疫组化及结果判定
对每位患者的石蜡包埋块进行相应处理,进行IHC染色及免疫组化染色。计数4个不同高倍视野下200个癌细胞,计算阳性细胞百分数。阳性细胞百分数为0%~49%计为阴性,阳性细胞百分数>50%计为强阳性(+)。肿瘤细胞核着色<1%,则ER、PR定义为阴性。HER-2免疫组化的判读标准:无着色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色为阴性(0);>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色为阴性(1+);>10%的浸润癌细胞呈现不完整的和(或)弱~中等强度的细胞膜染色,或≤10%的浸润癌细胞呈现强而完整的细胞膜染色为不确定(2+);>10%的浸润癌细胞呈现强、完整、均匀的细胞膜染色为阳性(3+)。对于免疫组化不确定的病例(阳性2+)需进行荧光原位杂交(FISH)进一步检测。
1.3观察指标与疗效判定
采集所有患者的人口统计学、病理特征及临床症状等相关信息。此外,所有患者的肿瘤分期根据第7版美国癌症联合委员会发布的癌症分期手册(AJCC 7.0)进行评估。随访截止日期为2019年6月31日,中位随访时间为16.8个月。总生存期(overall survival,OS)和无病生存期(disease free survival,DFS)的時间分别是从手术日期至由任何原因引起的死亡之间的时间以及手术时间开始到出现肿瘤复发或由任何原因引起死亡之间的时间。
1.4统计学方法
采用SPSS 22.0统计软件进行数据分析,不符合正态分布的计量资料采用中位数表示,计数资料采用频数表示,组间比较采用χ2检验,采用Kaplan-Meier计算患者的生存时间,采用Logrank法进行组间比较,采用多因素Cox回归分析对疾病无病生存期的独立影响因素进行分析,以P<0.05为差异有统计学意义。
2结果
2.1三阴性乳腺癌患者临床病理特征及CXCR4与DFS的关系
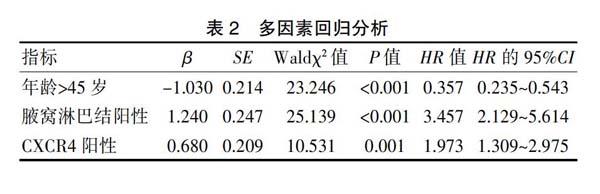
对160例三阴性乳腺癌患者进行长期随访,患者无疾病进展时间为4.0~13.0个月,中位时间为9.7个月。对三阴性乳腺癌的临床病理特征进行分析,经过Logrank检验分析,组间比较结果显示,患者绝经状态、病理分类、肿瘤大小、辅助治疗方式与无疾病进展时间无关(P>0.05)。年龄、腋窝淋巴结状态、CXCR4表达的组间无病生存期比较,差异有统计学意义(P<0.001)(表1)。多因素回归分析结果显示,年龄、腋窝淋巴结状态、CXCR4表达均为影响无进展生存期的独立影响因素,其中,腋窝淋巴结阳性、CXCR4阳性均为独立危险因素(表2)。
2.2 CXCR4表达与三阴乳腺癌患者预后的关系
三阴乳腺癌患者的总生存时间为9.1~20.1个月,中位总生存时间为15.6个月。随访分析结果显示,三阴乳腺癌CXCR4阳性组中位总生存时间为14.90个月,显著短于CXCR4阴性组的17.80个月,差异有统计学意义(P<0.001)。
3讨论
乳腺癌主要分为三种治疗亚型,分别为雌激素和/或黄体酮受体阳性(ER+,PR+)、HER2+、三阴性乳腺癌。三阴性乳腺癌是世界上最复杂、最具侵袭性的乳腺癌[4-7],远处转移的风险性高,预后较差,死亡风险较高。转移性三阴性乳腺癌越来越引起人们的注意。由于乳腺癌细胞缺乏激素受体,因此化疗成为唯一的治疗方案。除了预后差和存活率低外,其转移和复发的高倾向促使找寻有效的靶点。CXCR4是一个高度保守的七跨膜G蛋白偶联受体,与配体基质细胞衍生因子1(SDF-1,也称为CXCL12)相结合能够形成反映轴CXCL12-CXCR4,而针对CXCL12-CXCR4轴的靶向治疗可能对治疗癌症有效,目前抗CXCL12适配体、CXCR4拮抗剂和抗CXCR4单克隆抗体已被开发出来[8]。CXCL12信号通过CXCR4和CXCR7受体在癌细胞中上调,并激活多种分子通路,如丝裂原活化蛋白激酶(MAPK)、肌醇1,4,5-三磷酸腺苷(IP3)和磷酸肌醇肽3-激酶(PI3K)[9]。与CXCR4结合的CXCL12能够启动各种信号通路,导致细胞内钙、基因转录、趋化、细胞存活和增殖的增加,其与肿瘤细胞向区域和远处转移的能力有关[10]。CXCL12-CXCL4异源二聚阻止了CXCL12驱动的乳腺癌细胞迁移[11]。相关研究显示,浸润性乳腺癌样本中CXCR4-CXCL12趋化轴与正常邻近组织相比升高。在晚期转移的肿瘤样本中,CXCR4-CXCL12轴的表达水平与转移相关基因(E-cadherin和MMP2)之间也存在显著的相关性[12]。对人乳腺肿瘤的分析显示,在不同的分子亚型中,三阴性乳腺癌细胞中CXCR4的表达水平最高[13]。Shanmugam等[14]的研究表明胸腺醌(TQ)主要发挥其对趋化因子受体CXCR4表达下调的影响,具有抗乳腺癌转移的潜力,靶向CXCR4可以提高转移性乳腺癌的疗效。Yang等[15]的研究表明通过CXCR4或CXCR7基因的单次敲除能够显著降低三阴性乳腺癌细胞增殖、生长、迁移和侵袭,延缓G1/S周期的转化,而共敲除对这些生物学能力的抑制作用更显著。Guembarovski等[16]的研究提示CXCL12、CXCR4多态性和CXCR4免疫染色可能在三阴性乳腺癌发病机制中具有易感性和预后作用。
本研究结果显示,CXCR4过表达的三阴性乳腺癌患者获得较短的OS及DFS,发生复发及远处转移的风险明显更高,预后更差。多因素分析显示,CXCR4蛋白过表达是三阴性乳腺癌患者DFS差的独立危险有因素。目前的研究显示,CXCR4蛋白的过表达增加了三阴性乳腺癌患者发生远处转移和生存不良的风险,有可能成为控制三阴性乳腺癌远处转移的新靶点。其可能的机制为CXCR4-LASP1-eIF4F轴的激活可能有助于致癌mRNA的优先翻译,从而导致乳腺癌的进展和转移[17],也可能是三阴型乳腺癌细胞通过激活CXCL12/CXCR4/MMP-2信号通路,抑制CXCR4表达,进而抑制乳腺癌细胞的恶性生物学行为如增殖和迁移[18],进一步的机制需要去探索。本研究的数据与Guembarovski等[16]近期报道的数据一致。对三阴性乳腺癌组织进行免疫组化检测,结果显示53.12%的三阴性乳腺癌组织中CXCR4蛋白表达量较高,提示CXCR4可能在具有侵袭表型的乳腺癌细胞中特别高表达。此外,本研究还发现三阴性乳腺癌患者的DFS与患者绝经状态、病理分类、肿瘤大小、辅助治疗方式无关,而在年龄分组、腋窝淋巴结方面CXCR4表达,差异有统计学意义(P<0.001)。
综上所述,本研究中超过一半的三阴性乳腺癌组织标本中CXCR4表达上调。CXCR4过表达不仅是肿瘤侵袭性的标志,也可能是三阴性乳腺癌患者预后不良的标志。对CXCR4的进一步研究有助于明确三阴性乳腺癌复发及远处转移的分子机制,为控制三阴性乳腺癌复发及远处转移提供可能的新策略。
[参考文献]
[1]Romagnolo DF.Epigenetic Activation of BRCA1 by Genistein In Vivo and Triple Negative Breast Cancer Cells Linked to Antagonism toward Aryl Hydrocarbon Receptor[J].Nutrients,2019,11(11):2559.
[2]Bergin ART,Loi S.Triple-negative breast cancer:recent treatment advances[J].F1000Res,2019,8:F1000 Faculty Rev-1342.
[3]D′Alterio C,Buoncervello M,Ieranò C,et al.Targeting CXCR4 potentiates anti-PD-1 efficacy modifying the tumor microenvironment and inhibiting neoplastic PD-1[J].J Exp Clin Cancer Res,2019,38(1):432.
[4]Thakur V,Kutty RV.Recent advances in nanotheranostics for triple negative breast cancer treatment[J].J Exp Clin Cancer Res,2019,38(1):430.
[5]陳锡康,田华琴.三阴性乳腺癌的治疗现状及进展[J].西部中医药,2018,31(11):135-140.
[6]何慧君,欧阳翠雯,潘小梅.三阴性乳腺癌组织hMLH-1、Ki-67表达水平以及雄激素水平与其生物学行为的关系分析[J].现代医院,2018,18(8):1191-1193,1197.
[7]曲范杰,张捷,时淑珍,等.比卡鲁胺对三阴性乳腺癌MDA-MB-231细胞增殖抑制和诱导凋亡的影响[J].中国当代医药,2019,26(36):47-49.
[8]Ferreira F.CXCL12-CXCR4 axis in feline mammary carcinoma[J].Aging (Albany NY),2017,9(12):2457-2458.
[9]Duda DG,Kozin SV,Kirkpatrick ND,et al.CXCL12 (SDF1alpha)-CXCR4/CXCR7 pathway inhibition:an emerging sensitizer for anticancer therapies?[J].Clin Cancer Res,2011, 17(8):2074-2080.
[10]Kijowski J,Baj-Krzyworzeka M,Majka M,et al.The SDF-1-CXCR4 axis stimulates VEGF secretion and activates integrins but does not affect proliferation and survival in lymphohematopoietic cells[J].Stem Cells,2001,19(5):453-466.
[11]Nguyen KTP,Druhan LJ,Avalos BR,et al.CXCL12-CXCL4 heterodimerization prevents CXCL12-driven breast cancer cell migration[J].Cellular Signalling,2020,66:109 488.
[12]Dayer R,Babashah S,Jamshidi S,et al.Upregulation of CXC chemokine receptor 4-CXC chemokine ligand 12 axis ininvasive breast carcinoma:a potent biomarker predicting lymph node metastasis[J].J Cancer Res Ther,2018,14(2):345-350.
[13]Chu QD,Panu L,Holm NT,et al.High chemokine receptor CXCR4 level in triple negative breast cancer specimens predicts poor clinical outcome[J].J Surg Res,2010,159(2):689-695.
[14]Shanmugam MK,Ahn KS,Hsu A,et al.Thymoquinone Inhibits Bone Metastasis of Breast Cancer Cells Through Abrogation of the CXCR4 Signaling Axis[J].Front Pharmacol,2018,9:1294.
[15]Yang M,Zeng C,Li P,et al.Impact of CXCR4 and CXCR7 knockout by CRISPR/Cas9 on the function of triple-negative breast cancer cells[J].Onco Targets Ther,2019,12:3849-3858.
[16]Guembarovski AL,Guembarovski RL,Hirata BKB,et al.CXCL12 chemokine and CXCR4 receptor:association with susceptibility and prognostic markers in triple negative breast cancer[J].Mol Biol Rep,2018,45(5):741-750.
[17]Howard CM,Bearss N,Subramaniyan B,et al.The CXCR4-LASP1-eIF4F Axis Promotes Translation of Oncogenic Proteins in Triple-Negative Breast Cancer Cells[J].Front Oncol,2019,9:284.
[18]焦娟,宋艳艳,刘霞,等.CXCL12/CXCR4/MMP-2信号通路对三阴型乳腺癌生物学行为的影响[J].临床与实验病理学杂志,2017,33(11):1203-1208.
(收稿日期:2020-02-24)

