MiR-338及PTN的表达与卵巢癌的临床诊断价值的研究*
吴大英 黄 震 张秀艳 李 霞 郭予武 武红梅
1 广东省深圳市龙岗中心医院 518116; 2 深圳市龙岗区中医院
上皮性卵巢癌(Epithelial ovarian cancer, EOC)是卵巢恶性肿瘤中最常见的组织类型,占卵巢恶性肿瘤90%以上,肿瘤的浸润和转移是影响上皮性卵巢癌患者生存率的主要因素[1],病死率高居妇科恶性肿瘤之首[2-3]。但由于其发病隐匿且缺乏早期诊断方法,多数患者确诊时已表现为腹腔内广泛播散和转移[4]。因此寻找预测其侵袭转移的生物学标志物具有重要的临床意义。
越来越多的证据显示miRNA 在肿瘤的发生、发展、复发及转移中都起到了重要作用。研究也证实 microRNA 在多种肿瘤如卵巢癌、肺癌等异常表达,和肿瘤的发生发展有重要关系。Yuting Z等[5]发现miR-338在卵巢癌发病过程中通过调控PKM2的表达,促进卵巢癌细胞的增殖和代谢。已经发现PTN在恶性肿瘤的侵袭和转移中起着重要作用[6]。但国内尚未见卵巢癌MiR-338及PTN表达之间相互关系的研究文献报道。本文作者应用免疫组化方法检测卵巢癌组织、卵巢良性病变组织及卵巢交界性病变组织中MiR-338及PTN的表达,同时ELISA 检测以上三类患者血清中MiR-338及PTN含量,旨在研究MiR-338及PTN在卵巢癌中表达水平及其对EOC的临床诊断价值。
1 材料和方法
1.1 材料 本研究中的所有材料均来自深圳市龙岗中心医院手术切除组织,标本获取时间为2016年1月—2019年2月,包括70例卵巢良性病变组织、80例卵巢交界性病变组织和70例卵巢癌组织,通过石蜡包埋保存。以上三类基本病理及临床信息分别为:(1) 70例卵巢良性病变组织,其中单纯性囊肿30例(42.85%),腺纤维瘤40例(57.14%);(2) 80例卵巢交界性病变组织,其中浆液性囊腺癌38例(47.5%),黏液性囊腺癌42例(52.5%);(3) 70例卵巢癌组织,其中黏液性囊腺癌25例(35.7%),子宫内膜样癌45例(64.3%)。根据其发病机制及分子遗传特点又可以分为两型:Ⅰ型肿瘤和Ⅱ型肿瘤。其中,Ⅰ型肿瘤包括了低级别浆液性癌、黏液性癌、子宫内膜样癌和透明细胞癌等;Ⅱ型肿瘤包括了高级别浆液性癌、癌肉瘤及未分化癌。按照国际抗癌协会建议的TNM分期法将卵巢癌组患者分为T、N、M期,T1、T2、T3分别为17例(24.3%)、10例(14.3%)、8例(11.4%);N0、N1期分别为12例(17.1%)、5例(7.1%);M0、M1期分别为7例(10.0%)、11例(15.7%);肿瘤直径<5cm的42例(60.0%),肿瘤直径>5cm的28例(40.0%)。本研究经深圳市龙岗中心医院伦理委员会审批同意。
1.2 方法
1.2.1 免疫组化S-P法检测MiR-338及PTN蛋白表达: 取外科手术切除的70例卵巢良性病变组织、80例卵巢交界性病变组织和70例卵巢癌组织,均制备石蜡块标本,卵巢良性病变组织蜡块标本作正常对照。免疫组化染色采用ABC法,DAB显色,所有实验操作均按博士德试剂公司说明书。用双盲法对染色结果进行评估,每例随机观察5个高倍视野(×200),每高倍视野计数100个瘤细胞。将细胞染色强度评分(无,0分;弱,1分;中度,2分,强度,4分)和阳性细胞率评分(<5%,0分;6%~10%,1分;11%~20%,2分;21%~50%,3分;>51%,4分)之和为该病例评分值,且将评分值≤1分定为阴性病例,>2分定为阳性病例。以博士德公司提供的阳性切片作为两者染色的阳性对照,以0.01M PBS液(pH7.4)代替一抗作为每次染色的阴性或替代对照。
1.2.2 血清MiR-338及PTN的检测: 取待检者清晨空腹静脉血5ml,离心(3 000r/min,8~10min),分离血清,-20℃保存备用。ELISA法测定血清MiR-338及PTN水平,按深圳晶美生物技术公司试剂说明书操作,所有操作严格按试验说明书流程进行。

2 结果
2.1 卵巢良性病变组织、卵巢交界性病变组织及卵巢癌组织中MiR-338及PTN蛋白表达 MiR-338及PTN免疫组化反应产物主要定位于胞膜和(或)胞浆,少部分病例偶见胞核也着色,出现棕黄色颗粒,背景不着色。两者在癌组织中分布呈较明显异质性,同一切片不同癌巢或同一癌巢不同细胞着色强度或阳性细胞率也较明显不同。70例卵巢良性病变组织MiR-338及PTN阳性病例分别为3例(4.3%),5例(7.1%),其评分值分别为0.6±0.2和0.8±0.2;80例卵巢交界性病变组织MiR-338及PTN阳性病例分别为7例(8.8%)、8例(10.0%),其评分值分别为1.1±0.4和1.3±0.3; 70例卵巢癌组织MiR-338及PTN阳性病例分别为43例(61.4%)、47例(67.1%),其评分值分别为5.0±1.2和5.7±1.1;卵巢癌组织MiR-338及PTN表达阳性率及其评分均显著高于卵巢良性病例及卵巢交界性病变组织,卵巢癌组织中MiR-338及PTN 阳性率经过χ2检验分析(χ2=30.13,P=0.015;χ2=23.50,P=0.017)明显高于卵巢良性病例及卵巢交界性病变组织,结果具有统计学意义。结果见图1~3。
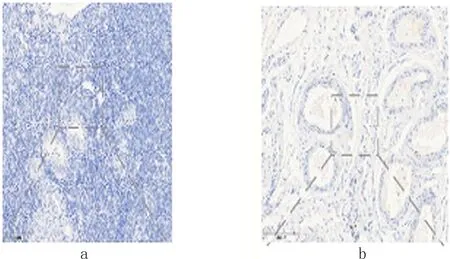
图1 卵巢良性病变组织MiR-338、PTN的表达(×200)

图2 卵巢交界性病变组织MiR-338、PTN的表达(×200)
2.2 卵巢良性病变组、卵巢交界性病变组及卵巢癌组三组患者血清中MiR-338及PTN表达水平 ELISA检测结果显示,卵巢癌组血清MiR-338及PTN表达水平显著高于卵巢良性病变组和卵巢交界性病变组,P分别为0.020和0.024。结果见表1。
2.3 MiR-338及PTN的表达与卵巢癌临床病理特征的分析 检测结果显示MiR-338及PTN表达水平随TNM分级的增高而增加,且表达水平随着肿瘤直径增大而增加(P<0.05),MiR-338及PTN两者表达水平呈正相关关系(r=0.89)。结果见表2。
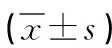
表2 70例不同病理类型卵巢癌患者中MiR-338及PTN的表达水平及相关性分析
3 讨论
卵巢癌是当前死亡率较高的妇科恶性肿瘤之一,手术辅以化疗是其主要的治疗方法。然而化疗耐药严重影响了卵巢癌患者的化疗效果和生存质量,使卵巢癌5年生存率长期维持在20%~30%[7]。肿瘤的侵袭和转移是导致临床治疗失败和患者死亡的主要原因。因此,探索影响EOC侵袭转移能力的相关细胞分子以及潜在的作用分子机制,为临床防治提供更准确而早期的诊断信息,一直是人们潜心研究的重要课题和努力方向[8]。
越来越多的证据显示MiRNA 在肿瘤的发生、发展、复发及转移中都发挥了重要作用。研究也证实 microRNA 在多种肿瘤如卵巢癌、结直肠癌、白血病、前列腺癌、胃、肝癌和肺癌等异常表达,和肿瘤的发生发展有重要关系[9]。
PTN是一种分泌性生长因子,在发育成熟的组织中一般不表达或极少表达。研究发现,PTN 在神经母细胞瘤、神经胶质瘤、绒癌、卵巢癌、前列腺癌、结肠癌、胰腺癌和黑色素瘤等肿瘤中呈高表达,在上述这些肿瘤组织中内源性的基因持续活化,而在相应的非瘤组织中很难检测到 PTN 的表达[6,10-11]。
本文研究结果显示,利用免疫组化检测70例卵巢良性病变组织、80例卵巢交界性病变组织和70例卵巢癌组织的MiR-338及PTN表达,卵巢癌组织MiR-338及PTN蛋白定位于肿瘤细胞胞浆及胞膜,阳性表达为胞浆或胞膜染为棕黄色,呈弥漫或散在的颗粒状。癌间质内皮细胞不表达或呈弱阳性表达,癌旁组织几乎不表达。癌周淋巴结主要分布在癌周围间质,尤其是浸润前缘数量最多。而MiR-338及PTN表达阴性者癌周淋巴结较少,管腔内偶见淋巴细胞,随PTN表达强度的增加,癌周淋巴结也有增加趋势,癌组织内PTN表达与癌周淋巴结呈正相关关系(P<0.05),提示肿瘤细胞可分泌PTN,通过PTN刺激微血管形成,肿瘤增殖速度加快,反映了恶性肿瘤的特征。进一步利用免疫组化的评分标准,对上述标本进行MiR-338及PTN表达情况的判读,发现MiR-338及PTN8在良性病变组织的评分集中在0~1分之间,在交界性卵巢病变组织的评分集中在0.8~1.5分之间,而恶性组织中的评分集中在4~6分之间,按>2分定义为高表达MiR-338及PTN,可明确恶性肿瘤组织中MiR-338及PTN的表达高于良性病变组织及交界性病变组织, 因此可以认为MiR-338及PTN对肿瘤组织具有良好的特异性。
本文研究结果显示,卵巢癌患者血清MiR-338及PTN表达均显著高于卵巢良性病变患者及卵巢交界性病变患者,二者浓度过高可能是发生卵巢癌的危险因素。
然后按照国际抗癌协会建议的TNM分期法将卵巢癌组患者分为T1期、T2~3期,N0期、N1期,M0期和M1期。从表2可以看出,经方差分析显示MiR-338及PTN表达水平随TNM分级的增高而增加(P<0.05),且两者之间存在呈正相关关系,更重要的是,肿瘤直径>5cm的卵巢癌患者血清中MiR-338及PTN表达水平明显高于且肿瘤直径<5cm的卵巢癌患者。Kim 等[12]学者通过PCR 技术和免疫组化实验技术检测到miR-338在卵巢癌中表达上调,且与患者的临床分期、淋巴结转移和远处转移相关。Chen 等[13]研究发现miR-338在上皮性卵巢癌中表达显著上调,并且这种上调与上皮性卵巢癌的病理分化和临床分期具有相关性。这些均与本研究结果基本一致。本研究发现miR-338可能在EOC中能够调控PTN表达,在卵巢癌中也有促进肿瘤细胞的生长增殖和侵袭,促进卵巢癌细胞的增殖和代谢。
目前已公认PTN 具有促血管新生、刺激细胞增殖与迁移等多种生物学活性,与肿瘤的发生发展密切相关,PTN在卵巢癌中高表达且与其侵袭转移能力也有一定的相关性[14];PTN促进肿瘤细胞的生长增殖和侵袭迁移能力,笔者推测MiR-338及PTN可能参与了卵巢癌血管的病变过程,miR-338与间质成纤维细胞、巨噬细胞、淋巴细胞、血管及淋巴管网络和细胞外基质成分形成肿瘤微环境,进而促使机体分泌合成PTN等炎症因子上升,血液中PTN浓度过高导致的血管炎症因子的持续刺激,使机体产生过多的氧自由基,破坏DNA双螺旋结构,导致抑癌功能慢性丧失,导致肿瘤发生发展[15]。
综上所述,miR-338及PTN在EOC增殖和侵袭中发挥重要作用。miR-338通过上调PTN的表达水平,参与调控EOC增殖、侵袭及转移,最终影响EOC的进展。在EOC发生发展过程中miR-338对PTN潜在的调控作用机制值得我们进一步研究。

