光照强度对日本荚蒾幼苗生长和生理特性的影响
夏云飞 ,李瑞娇,杨在娟,陈献志,李贺鹏,郭 亮,岳春雷
(1.台州市林业技术推广总站,浙江 台州 318020;2.浙江省林业科学研究院,浙江 杭州 310023;3.临海市林业技术推广总站,浙江 临海 317000;4.椒江区林业技术推广总站,浙江 台州 318000)
光是植物进行光合作用并赖以生存的生态因子,影响植物的生存、生长及生态机构[1]。同一植物在不同光照环境下表现出不同的生理形态特性,这是植物本身对于不同光照环境条件做出的适应性变化[2]。因此,研究植物对不同光环境的生理生态响应,能够为植物保护和培育提供理论依据。
日本荚蒾Viburnum japonicum为忍冬科Caprifoliaceae 荚蒾属Viburnum常绿灌木,叶浓绿而光亮,花密集白色,果实熟时红色,经冬不凋,是优良的观赏花木。日本荚蒾在我国仅分布于浙江省台州市椒江区大陈岛、临海市头门岛和雀儿岙,舟山市普陀区东福山岛等海岛,植株数量十分稀少,已被列入浙江省重点保护野生植物名录(第一批)和浙江省极小种群拯救保护物种[3-6]。野生日本荚蒾通常生长在海岛西北面山坡的松林下、灌草丛及乱石堆中[3]。海岛光照强烈,因此,研究不同光照强度下日本荚蒾的生长和生理特性,能够明确该植物对光照强度的适应能力。本文通过设置不同光照强度,对日本荚蒾幼苗的生长和生理生化指标进行分析,为该物种的保护和苗木培育提供理论依据。
1 材料和方法
1.1 试验材料
选用生长健壮、长势基本一致的3 年生日本荚蒾实生幼苗(由临海市林业技术推广总站提供)作为供试材料,平均苗高(59.4±1.9)cm。试验采用盆栽法,盆钵规格为21 cm×16 cm×21 cm(上径×下径×高),每盆1株,每盆土质量5 kg,栽培基质为苗圃熟土,土壤有机质含量为38.26 g·kg-1,速效氮含量为0.16 g·kg-1,速效磷含量为0.06 g·kg-1,速效钾含量为0.14 g·kg-1。
1.2 试验设计
试验在浙江省林业科学研究院苗圃内进行。2017 年4 月,将购置的3 年生日本荚蒾实生幼苗装盆栽培,在温室大棚缓苗10 天后,将盆栽幼苗放到自然条件下生长一个月,期间进行常规管理,在全光环境下适应30 d后,放入2 m 高的荫棚进行遮荫处理。遮荫网四周底线距离地面30 cm 便于通风。设置4 个遮荫梯度,以全光照(无遮荫,透光100%)为对照计算出各个处理的遮荫率,4 个遮荫梯度分别为:全光照、遮荫30%(1 层遮荫网,透光70%)、遮荫60%(2 层遮荫网,透光40%)、遮荫85%(3 层遮荫网,透光15%),每个处理3个重复,每个重复5 株。所有供试植株均按一致的常规栽培技术管理,株间距为50 cm。分别于遮荫处理30,60,90 d(即6 月、7 月、8 月)时进行生长及生理生化指标测定。
1.3 测定指标与方法
比叶重的测定:分别于试验处理30,60,90 d 时摘取每个遮荫处理植株下中上部成熟叶片各10 片,装入密封袋封存编号,置于冰桶中带回实验室,用去离子水清洗干净,吸干水分后,用一定面积的打孔器打成叶圆片,随机分成5 组,80℃烘干至恒质量,称其干质量,比叶重(SLW,g·m-2)=叶干质量/叶面积。
相对生长速率的测定:用卷尺测量不同处理下植株的株高,并进行相对生长速率(RGR,cm·d-1)的计算。
花色素苷含量的测定:遮荫处理90 d 后,随机取不同遮荫处理植株各3 株,每株取下部叶片2~ 3 片,清洗干净、吸干水分后,去掉中脉,剪成0.2 cm 左右的细丝或小块混合均匀,每份取0.03 g 样品,每个处理共取3 份,置于5 mL 1%盐酸乙醇提取液中,室温浸提4 h,取上清液测定520 nm 处的吸光度,以每克鲜质量在10 mL提取液中的吸光度为1 OD,以0.1 OD 为一个色素单位,即花色素苷相对含量(0.1 OD535·g-1FW·10 mL-1)=吸光度/0.1(色素单位)。叶片丙二醛(MDA)含量采用硫代巴比妥酸法测定[7];叶片可溶性蛋白含量采用考马斯亮蓝染色法测定[7];叶片可溶性糖采用蒽酮比色法测定[8];叶片超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定[7];叶片过氧化物酶(POD)活性采用愈创木酚比色法测定[8]。
1.4 数据分析
采用SPSS18.0 软件对试验数据进行单因素方差(One-way ANOVA)分析,并用最小显著法(Duncan’s)进行多重比较,用Origin 8.5 软件绘图。
2 结果与分析
2.1 遮荫对日本荚蒾幼苗生长的影响
由图1 可知,不同遮荫处理对日本荚蒾幼苗RGR和SLW有显著影响(P<0.05)。由图1A 可知,在生长势较强的6 月,遮荫30%和60%处理的RGR较高,植株生长最快;遮荫85%处理的RGR较小,全光照下植株生长最慢。随着时间的推移,在处理60 d 和90 d 时,日本荚蒾植株的RGR逐步减小。在处理90 d,不同遮荫处理间的RGR无明显差异,但各遮荫处理的RGR均高于全光照。在整个处理过程中全光照下的RGR均为最低,强光抑制了日本荚蒾幼苗的生长。
SLW是研究遮荫环境对植物影响常用的形态学指标,反映了植物对于弱光环境在形态学上的适应对策。遮荫30 d 时,30%遮荫下日本荚蒾幼苗的SLW最高,与其他处理之间差异显著(P<0.05),其他3 个处理间则没有明显差异(P>0.05)。处理60 d 和90 d 时,随着光照强度的减弱,各处理植株的SLW均逐渐降低且处理间差异显著(P<0.05)。
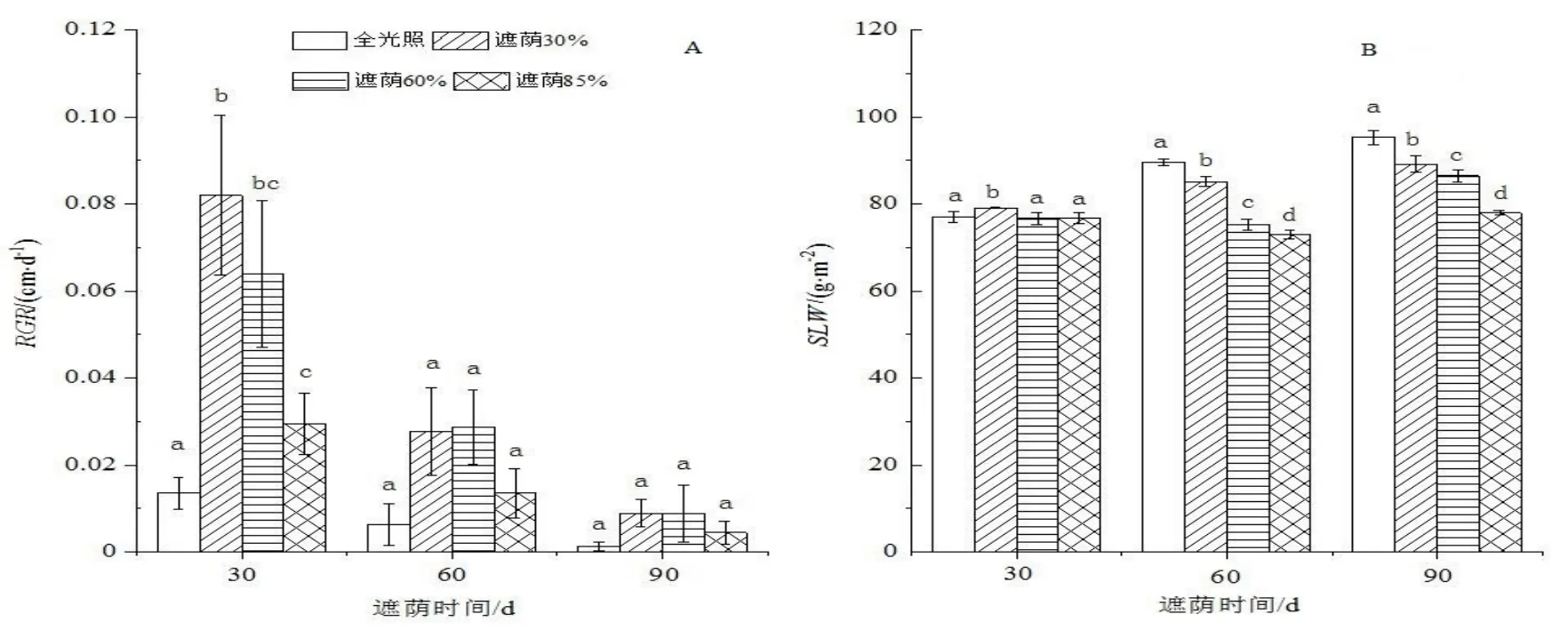
图1 不同遮荫处理对日本荚蒾幼苗RGR 和SLW 的影响Figure 1 Relative growth rate and specific leaf mass of V.japonicum seedlings under different shading treatments
2.2 遮荫对日本荚蒾幼苗叶片花色素苷含量的影响
经过长时间的全光照射,日本荚蒾幼苗下部叶片及幼叶边缘逐渐变红,而遮荫处理下叶片仍为绿色。由图2 所示,通过对日本荚蒾不同光照处理下下部叶片的花色素苷含量的测定,发现全光照下日本荚蒾幼苗叶片花色素苷明显高于其他处理,叶片花色素苷含量随遮荫强度的升高逐渐减小。因此,可以推断全光照下日本荚蒾幼苗叶片含有大量的花色素苷导致了叶片变为红色。
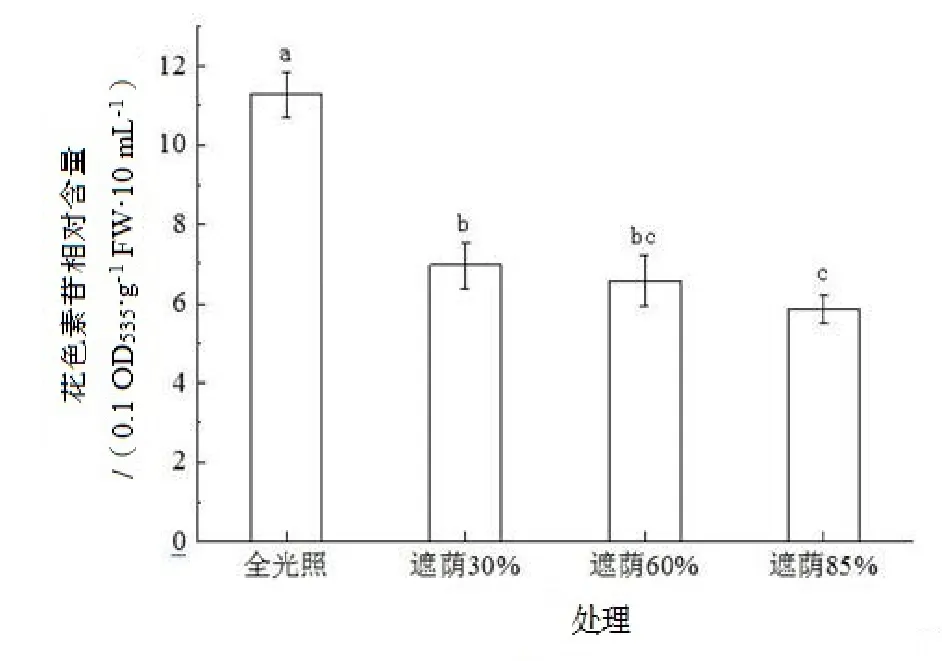
图2 不同遮荫处理对日本荚蒾幼苗叶片花色素苷含量的影响Figure 2 Anthocyanin content of V.japonicum seedlings under shading treatments
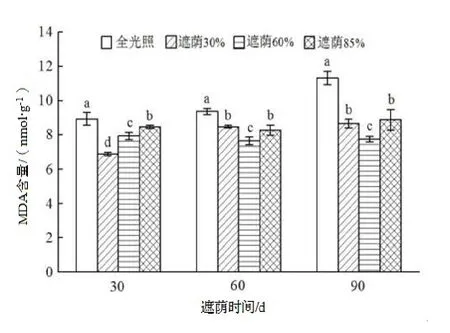
图3 不同遮荫处理对日本荚蒾幼苗叶片MDA 含量的影响Figure 3 MDA content of V. japonicum seedlings under different shading treatments
2.3 遮荫对日本荚蒾幼苗MDA 含量的影响
由图3 可知,处理30 d 时,全光照下日本荚蒾幼苗叶片的MDA 含量最高,遮荫30%处理的最低,且各处理间均差异显著(P<0.05)。随着处理时间的延长,全光照下的MDA 含量仍为最高并逐渐上升,且与其他处理间呈显著差异(P<0.05)。处理60 d 和90 d 时,遮荫60%处理叶片的MDA 含量为最低,显著低于其他处理(P<0.05),遮荫30%和遮荫85%处理之间无显著差异。
2.4 遮荫对日本荚蒾幼苗渗透调节物质的影响
日本荚蒾幼苗在不同处理下的渗透调节物质变化如图4 至图7。由图4 可知,在不同处理时间,均以在全光照下叶片的可溶性糖含量最高,且与其他处理间均达显著差异(P<0.05)。处理90 d 时,遮荫60%叶片的可溶性糖含量最低,与其他处理之间均达显著差异(P<0.05)。在全光条件下,叶片的可溶性蛋白含量随着处理时间的延长变化不明显。随着时间的延长,不同遮荫处理叶片可溶性蛋白含量均有增加。但在不同的处理时间,遮荫60%处理叶片的可溶性蛋白含量均显著低于其他处理(P<0.05)(图5)。
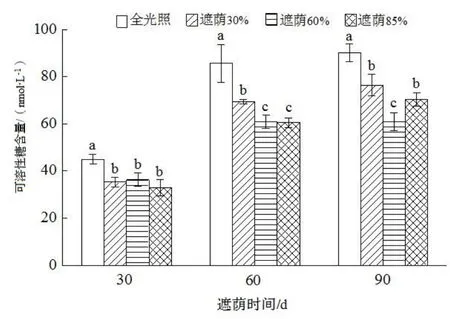
图4 不同遮荫处理对日本荚蒾幼苗叶片可溶性糖含量的影响Figure 4 Soluble sugar content of V. japonicum seedlings under different shading treatments
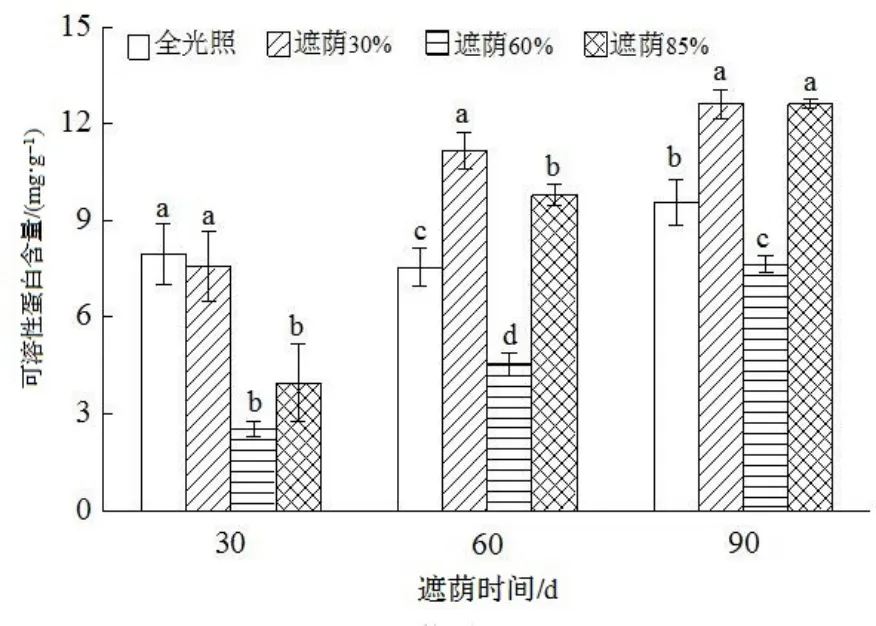
图5 不同遮荫处理对日本荚蒾幼苗叶片可溶性蛋白含量的影响Figure 5 Soluble protein content of V. japonicum seedlings under different shading treatments
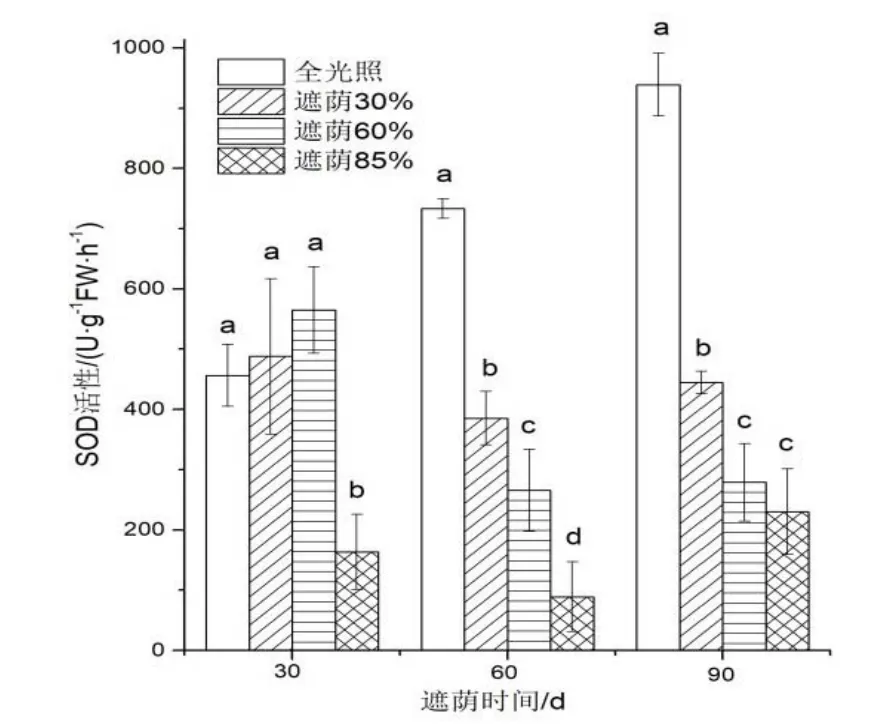
图6 不同遮荫处理对日本荚蒾幼苗叶片SOD 活性的影响Figure 6 SOD activity of V.japonicum seedlings under different shading treatments
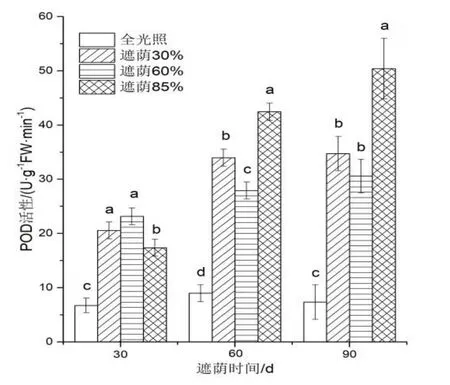
图7 不同遮荫处理对日本荚蒾幼苗POD 活性的影响Figure 7 POD activity of V.japonicum seedlings under different shading treatments
由图6 可知,处理30 d 时,全光照、遮荫30%、遮荫60%处理之间日本荚蒾幼苗叶片的SOD 活性无明显差异,遮荫85%处理的则显著降低。处理60 d 和90 d 时,随着遮荫强度的增大,叶片的SOD 活性逐渐降低。
由图7 可知,各遮荫处理叶片的POD 活性随着处理时间的延长逐渐升高,不同处理时间全光照下叶片的POD 活性均为最低。处理30 d 时,遮荫30%和遮荫60%处理间无明显差异。处理60 d 和90 d 时,遮荫60%叶片的POD 活性均低于遮荫30%和遮荫85%处理。
3 结论与讨论
过强或过弱的光照均不适宜植物的生长。光照过强可能会出现光抑制而引起光合速率下降,导致植物生长速率下降;过弱则会出现光缺乏现象,最终影响植物体的正常生长发育[10]。在本研究中,遮荫30%和60%处理下日本荚蒾幼苗的相对生长速率较大,植物利用增加株高的方式来获得更多的光照,以适应荫蔽的环境,这样能够增大植物的垂直受光面积,增强对漫射光和散射光的接受能力[11]。全光照下光照强烈,日本荚蒾长时间暴露在强光环境中生长受到严重抑制,尤其是8 月份高光照天气增加,强光照使植物上部叶片出现焦枯、翻卷的现象,植物受伤害明显,这与典型喜阴植物金花茶Camellia nitidissima,短梗大参Macropanax rosthornii在强光胁迫下的表现相类似[12-13]。因此,日本荚蒾是典型的喜阴植物。SLW是影响叶片光合能力的重要因素,与光合能力呈正相关。随着遮荫强度的增大,日本荚蒾幼苗叶片的SLW逐渐降低,这可能是由于受光度的降低,当太阳辐射能量成为植物生长的主要限制因子时,植物通过使叶片变薄,最大限度地提高光能捕获效率[14]。而强光下,植物为了避免吸收过量的光能引起光抑制,会减少叶片生物量的投入,增大SLW。6-8 月,各处理SLW的升高也说明这一点。
由于全光照下光照较强,植物叶片内积累大量的花色素苷,叶片由绿色变为红色,而遮荫条件下光强强度相对较弱,叶片花色素苷相对较少,叶片仍为绿色。有研究表明,花色素苷能够为植物的光合器官提供“保护罩”,通过减少在强光等逆境条件下进入光系统的光能,清除活性氧离子以及耗散过剩光能等途径,在一定程度上减轻甚至解除光抑制,维持光合能力[15]。虽然日本荚蒾幼苗在全光照环境下生长缓慢,光合能力大幅下降,受到严重胁迫,而叶片花色素苷含量的升高也许是日本荚蒾抵御逆境的一种特殊的生理机制。
胁迫对植物的伤害首先表现为膜脂过氧化。MDA 是脂质过氧化的产物之一,其积累是活性氧毒害作用的表现,是检测膜损伤程度的公认指标[16-17]。植物在抵御和适应不良环境时,自身还会形成一些防御机制,如启动抗氧化系统、进行渗透调节等[18]。本研究中,在全光照下日本荚蒾幼苗叶片的MDA 含量、可溶性糖含量均为最高,全光照下渗透调节物质共同作用调节细胞渗透势,而由于夏季全光照抑制植物的生长,对植物造成破坏,阻碍可溶性蛋白的合成,随着处理时间延长细胞膜脂过氧化程度加重。遮荫条件下,遮荫60%处理叶片的MDA含量、可溶性蛋白含量最低,可溶性糖含量也较低;遮荫30%和85%处理叶片中的渗透调节物质随着MDA 含量的升高逐渐升高。这说明MDA 积累对叶片中渗透调节物质的增加有一定的调节作用,遮荫60%处理较适宜日本荚蒾的生长,而遮荫30%和85%处理下,植物为了防止活性氧积累破坏细胞膜,通过增加渗透调节物质抑制伤害,保证正常生长。
本研究中随着处理时间的延长,全光照下日本荚蒾幼苗叶片的SOD 活性逐渐升高,而POD 活性则一直处于较低水平,MDA 含量一直较高,说明保护酶系统调节作用发生破坏,植物体内活性氧产生与消除失衡,细胞膜脂过氧化严重,阻碍了植物的生长。在遮荫条件下,叶片的SOD 活性随着遮荫强度的升高逐渐降低,遮荫60%处理叶片的POD 活性相对较低,MDA 含量最低,说明保护酶系统与活性氧清除平衡;遮荫30%处理叶片的SOD 活性、POD 活性均较高,它们共同作用清除活性氧;遮荫85%处理在6 月POD 活性下降时叶片的MDA含量较高,在7 月和8 月POD 活性大幅升高时MDA 含量较其它处理降低,说明在光照过弱的环境中,植物保护酶系统中POD 活性发挥了更重要的作用,保护植物的正常生长。
综上所述,遮荫条件下日本荚蒾通过提高渗透调节物质含量和保护酶活性,维持活性氧产生与消除平衡,共同维持植物的生长,保证日本荚蒾有较高的生长速率。遮荫60%处理幼苗细胞膜受破坏程度最小,而全光照下细胞膜受到严重破坏,顶部叶片焦枯卷曲,下部叶片由于花色素苷含量积累较高导致叶片发红。全光照下日本荚蒾受到严重的光抑制,遮荫60%较适宜该植物生长。

