四川省食品动物源大肠埃希菌产ESBLs菌株blaCTX–M基因的分子流行特征
杨承霖,吴聪明,王爽,林居纯*
四川省食品动物源大肠埃希菌产ESBLs菌株CTX–M基因的分子流行特征
杨承霖1,吴聪明2,王爽1,林居纯1*
(1.四川农业大学动物医学院,四川 成都 611130;2.中国农业大学动物医学院,北京 100193)
2010—2016年,从四川省不同养殖场的食品动物源(猪源、鸡源)中分离和纯化并最终获得123株大肠埃希菌产超广谱β–内酰胺酶(ESBL–EC)菌株,采用PCR法,并通过测序检测其CTX–M基因,采用脉冲场凝胶电泳法(PFGE)分析33株不同来源菌株的亲缘关系。结果显示:123株菌株中CTX–M检出率高达91.9%(113/123),其中以CTX–M–55和CTX–M–65基因型为主;CTX–M流行率呈逐年上升的趋势;不同动物源菌株中CTX–M流行情况不同;12株菌中CTX–M基因发生了9种类型的突变,其中有10株菌为有义突变,导致7种类型氨基酸被取代;33株不同来源菌株共有32种PFGE型。可见,四川省食品动物源产ESBLs大肠埃希菌中CTX–M基因型复杂且存在变异,在不同遗传背景的ESBL–EC菌株间广泛流行。
猪;鸡;食品动物源;大肠埃希菌;β–内酰胺酶;CTX–M;分子流行特征;四川
自2000年以来,CTX–M型超广谱β–内酰胺酶(ESBLs)在世界各地均有报道。尤其在发展中国家,由于抗生素滥用和较低卫生防疫水平,导致包括CTX–M在内的多重耐药基因在人、动物和环境中广泛传播,给公共卫生安全带来威胁[1]。近年来,CTX–M型已取代TEM和SHV,成为最流行的ESBLs,CTX–M型以对头孢噻肟高水平耐药为主要表型特征[2]。由于CTX–M基因极易发生突变,已报道的CTX–M已超过150种亚型,分属于6群(CTX–M–1、CTX–M–2、CTX–M–8、CTX–M–9、CTX–M–25和KLUC)[3]。CTX–M基因通常位于可移动质粒上,而这些质粒可与耐四环素类、氨基糖苷类、氯霉素类、磺胺–甲氧苄啶耐药基因发生共转移,使用以上任何1种抗生素都可诱导和筛选出CTX–M菌株[4-5]。CTX–M可借助插入序列、转座子、整合子等多种可移动基因元件,如IS可在质粒间、质粒与染色体间转移,也可在不同菌株和菌种间进行水平传播[6]。
食品动物与人类有密不可分的联系,耐药细菌可通过人与动物直接接触或食物链完成耐药基因从动物到人类转移,对人类健康造成威胁[1]。大肠埃希菌作为动物体内常见共生菌和致病菌,承受着多种抗菌药物的诱导及选择压力,形成了严重的耐药性,某些菌株甚至对所有的抗菌药物表现出耐药性。在抗生素持续诱导和选择压力下,导致了CTX–M基因突变,也出现了一些新的流行类型,如在中国CTX–M–55已经超过CTX–M–15,成为仅次于CTX–M–14的流行类型,该酶对头孢他定具有高水解活性。而CTX–M–65型在中国动物源菌株中快速传播[7]。目前,对于CTX–M的流行特征研究主要集中在医学临床分离菌株,而食品动物源菌株相关报道较少,尤其有关四川省产CTX–M菌株及其基因型流行特征和扩散演化变迁的研究鲜有报道。本研究中,以四川省猪、鸡源产ESBLs大肠埃希菌为研究对象,分析CTX–M基因在不同来源菌株中的分子流行特征,旨在为科学应对食品动物源菌株产CTX–M在四川省的流行提供依据。
1 材料与方法
1.1 菌株来源
2010—2016年,从四川省不同养殖场分离和纯化444株大肠埃希菌临床菌株。经双纸片确认试验,获得123株产ESBLs菌株,其中鸡源菌95株,猪源菌28株。
1.2 blaCTX–M基因检测
使用OMEGA小量质粒提取试剂盒,提取123株产ESBLs大肠埃希菌质粒DNA,并以此为模板,对其进行不同群CTX–MPCR扩增[8-10]。PCR引物序列及扩增条件见表1。将获得的目的片段送往上海英骏生物技术有限公司(北京)进行双向测序,测序结果通过GenBank进行比对分析。

表1 blaCTX–M基因PCR引物及扩增条件
1.3 亲缘关系鉴定
采用脉冲场凝胶电泳(PFGE)对挑选的33株不同来源、携带CTX–M的菌株进行分子分型[11],以确定这些菌株的遗传相关性或差异性,从而了解CTX–M在菌株间的扩散是垂直还是水平传播。
2 结果与分析
2.1 不同来源菌株blaCTX–M的流行特点
从123株ESBLs大肠埃希菌中检出CTX–M113株(检出率91.9%),其中CTX–M–1群83株(73.5%),CTX–M–9群30株(26.5%),CTX–M–2、CTX–M–8/25群尚未检出。测序结果显示,CTX–M–1群以CTX–M–55为主(44/113),其次是CTX–M–65(23/113)、CTX–M–15(8/113)和CTX–M–123(8/113);CTX–M–9群以CTX–M–14为主(20/113),其次是CTX–M–24(6/113)和CTX–M–121(4/113)。
从表2可知,CTX–M检出率呈逐年上升的趋势,2013—2016年,分离菌株检出的CTX–M基因型逐年增多。如图1所示,猪源和鸡源菌均是CTX–M–55检出率最高,其余基因型检出率呈菌株来源性差异,鸡源菌比猪源菌检出更复杂的基因型。

表2 2010—2016年blaCTX–M基因型的检测结果

图1 猪和鸡源菌株blaCTX–M基因型的检测结果
2.2 不同blaCTX–M基因的突变特点
将113株菌株扩增获得的CTX–M测序结果与GenBank收录序列进行比对,发现其中12株菌携带的4种CTX–M基因发生了9种突变,其中10株发生了有义突变,导致7种氨基酸被取代(表3)。

表3 不同菌株blaCTX–M基因的突变及氨基酸取代特征
2.3 blaCTX–M阳性菌株的PFGE分型结果
所选取的33株不同时间、不同动物源菌株共产生32种不同PFGE谱型,即便是携带相同CTX–M基因型菌株,但其PFGE谱型也不相同,这说明检测到的CTX–M阳性菌不存在克隆关系,遗传背景具有多样性(图2)。
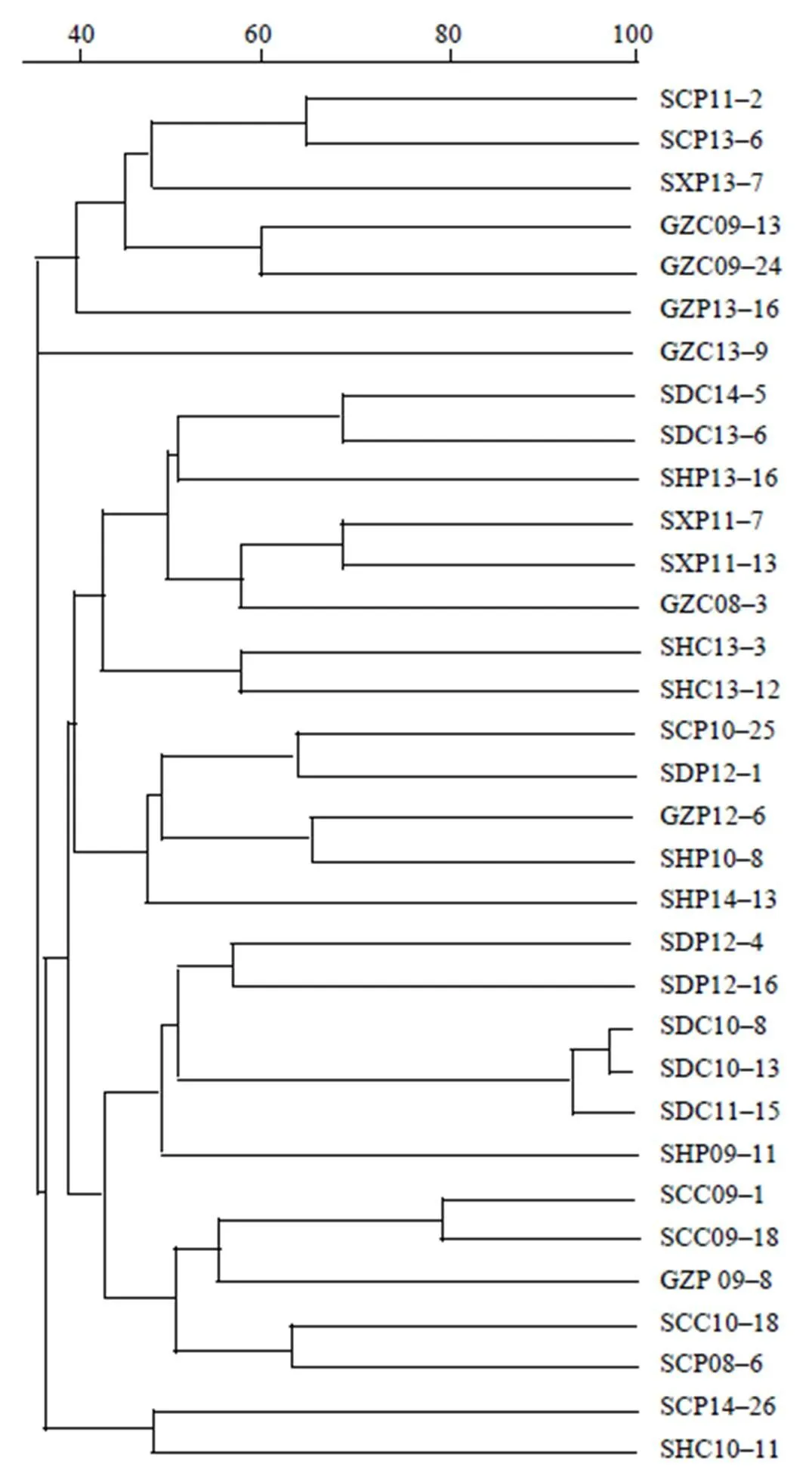
图2 33株blaCTX–M菌株的PFGE聚类分析结果
3 讨论与结论
本研究中,在123株ESBLs动物源大肠埃希菌中检出113株携带CTX–M,检出率达91.9%,与其他报道[12–14]的CTX–M检出率84.8%~94.6%相符,说明食品动物源大肠埃希菌是CTX–M主要宿主菌,该类基因在产ESBLs大肠埃希菌中已获得稳固传播能力。本研究检出的CTX–M主要分属于CTX–M–1群(73.5%)和CTX–M–9群(26.5%),其中CTX–M–55(44/113)、CTX–M–65(23/113)和CTX–M–14(20/113)检出率较高,为优势基因型,CTX–M–15、CTX–M–123、CTX–M–24也有检出。可见,在四川省食品动物源的分离菌株中,检出的CTX–M–55、CTX–M–65基因型已经超过了CTX–M–14,尤其是CTX–M–65基因,作为CTX–M–14的突变体,具有水解头孢噻肟、头孢曲松的能力,而且该基因常常与其他耐药基因,如KPC–2、NDM–5、、SHV和共同存在于同一质粒,呈多重耐药性,这给耐药性防控和临床感染治疗带来严峻挑战[15],故兽医临床上对新型CTX–M基因流行、对其介导耐药性及耐药机制的研究应进一步加强。
自2000年后CTX–M型ESBLs流行逐年上升。RAO等[7]对分离自2003—2012年间中国食品动物源产CTX–M大肠埃希菌动态监测结果显示,产CTX–M菌株从2003—2005年的5.7%显著上升到2009—2012年的35.3%。本研究结果也显示,2010—2016年,CTX–M流行逐年上升,且基因型更加复杂。CTX–M流行特点除与菌株分离时间有关外,还与菌株分离自不同动物有关。本研究中,除CTX–M–55在不同动物源检出率均较高外,鸡源菌比猪源菌检出更复杂的基因型。这可能与养鸡场使用抗菌药物种类较多且交叉或轮换使用药物更频繁有关。
对CTX–M基因遗传结构研究发现,CTX–M型ESBLs的种类以惊人的速度发生变化。已报道的CTX–M亚型已超过150种[6],这些亚型的产生,是在药物选择压力下,同源基因发生变异并逐渐累积的结果,导致各亚型间水解活性也不尽相同。而基因发生变异多发生于CTX–M–1群和CTX–M–9群间,可能是这2个基因群具有更高的可塑性,能为基因进化提供更多机会[16–17]。本研究中的113株CTX–M测序的结果表明,属于CTX–M–1群的CTX–M–15、CTX–M–123、CTX–M–65和CTX–M–9群的CTX–M–14共4种亚型基因发生了突变,导致7种氨基酸被取代。这些位点氨基酸被取代对酶水解活性的影响有待进一步研究。
尽管克隆株介导的垂直传播对CTX–M流行起到了一定作用,但不同遗传元件(结合型质粒、插入序列、转座子和整合子等)参与的传播,在CTX–M基因传播和表达中起到了更重要作用。从33株不同来源CTX–M菌株PFGE分型发现,除2株菌具有高度遗传相似度外,其余菌株间亲缘关系远,未发现四川地区优势克隆株。这也间接说明,CTX–M在本次研究的菌株中被广泛检出,可能存在质粒等可移动基因元件参与的水平传播。
CTX–M酶流行广泛,具有较强的水平传播能力,在四川省食源动物中检出率高,且其亚型逐渐多样化,水解底物种类逐渐增多,故需要重新审视β–内酰胺类抗菌药在兽医临床及畜牧业中的使用,特别是在禽类养殖业中应禁止某些不规范使用药物的现象,如作为饲料添加剂使用、盲目用药及超量使用等,同时加强对大肠埃希菌CTX–M酶流行的监测,以控制其进一步发展。
[1] BEVAN E R,JONES A M,HAWKEY P M.Global epidemiology of CTX-M β-lactamases:temporal and geographical shifts in genotype[J].Journal of Antimicrobial Chemotherapy,2017,72(8):2145–2155.
[2] CORMIER A,ZHANG P L C,CHALMERS G,et al. Diversity of CTX-M-positiverecovered from animals in Canada[J].Veterinary Microbiology,2019,231:71–75.
[3] D’ ANDREA M M,ARENA F,PALLECCHI L,et al. CTX-M-type β-lactamases:a successful story of antibiotic resistance[J].International Journal of Medical Microbiology,2013,303(6/7):305–317.
[4] 甄盼盼,汤电,任艳娜,等.食品动物源产CTX–M–14大肠杆菌传播分子机制的演变[J].中国畜牧兽医,2012,39(9):195–202. ZHEN P P,TANG D,REN Y N,et al.Evolutionally dissemination of CTX-M-14 producingamong food-producing animals[J].China Animal Husbandry & Veterinary Medicine,2012,39(9):195–202.
[5] 坤清芳,耿毅,余泽辉,等.四川兔源大肠埃希菌的耐药性及耐药基因检测[J].湖南农业大学学报(自然科学版),2018,44(5):549–552. KUN Q F,GENG Y,YU Z H,et al.Antibiotic resistance and resistance genes detection ofin Sichuan rabbits[J].Journal of Hunan Agricultural University(Natural Sciences),2018,44(5):549–552.
[6] LAHLAOUI H,BEN HAJ KHALIFA A,BEN MOUSSA M.Epidemiology of Enterobacteriaceae producing CTX-M type extended spectrum β-lactamase(ESBL)[J]. Médecine et Maladies Infectieuses,2014,44(9):400– 404.
[7] RAO L,LV L,ZENG Z,et al.Increasing prevalence of extended-spectrum cephalosporin-resistantin food animals and the diversity of CTX-M genotypes during 2003-2012[J].Veterinary Microbiology, 2014,172(3/4):534–541.
[8] KOJIMA A,ISHII Y,ISHIHARA K,et al. Extended- spectrum-β-lactamase-producingstrains isolated from farm animals from 1999 to 2002:report from the Japanese veterinary antimicrobial resistance monitoring program[J].Antimicrobial Agents and Chemotherapy,2005,49(8):3533–3537.
[9] 张新宇,高燕宁.PCR引物设计及软件使用技巧[J].生物信息学,2004,2(4):15–18. ZHANG X Y,GAO Y N.To design PCR primers with Oligo 6 and Primer Premier 5[J].China Journal of Bioinformatics,2004,2(4):15–18.
[10] DALLENNE C,DA COSTA A,DECRÉ D,et al. Development of a set of multiplex PCR assays for the detection of genes encoding important β-lactamases in Enterobacteriaceae[J].Journal of Antimicrobial Chemo- therapy,2010,65(3):490–495.
[11] 吴丽云,池圣清,吴家荣,等.野生动物园不同源性大肠杆菌耐药性及PFGE分型研究[J].中国兽医科学,2017,47(11):1424–1432. WU L Y,CHI S Q,WU J R,et al.Molecular typing through PFGE and detection of drug resistant ofisolated from different sources in Safari Park[J].Chinese Veterinary Science,2017,47(11):1424–1432.
[12] ZHAO W D,YAN P,GUAN H N,et al.Characterization of CTX-M-type extended-spectrum beta-lactamase in clinical clones ofin Southwest China[J]. Journal of Basic Microbiology,2014,54(3):247–252.
[13] 曾莉.不同来源大肠杆菌ESBLs基因分子流行病学研究[D].广州:华南农业大学,2016. ZHENG L.Molecular characteristics of plasmid- mediated ESBLs genes inisolated from animals, retail meat and humans [D].Guangzhou:South China Agricultural University,2016.
[14] 贺小红.CTX–M–55型超广谱β–内酰胺酶的分布、进化及抗药活性研究[D].郑州:郑州大学,2017. HE X H.The distribution, evolution and antimicrobial resistance characteristics of CTX-M-55 type extended- spectrum Beta-lactamases [D]. Zhengzhou:Zhengzhou University,2017.
[15] FU L,WANG S M,ZHANG Z K,et al.Co-carrying of KPC-2,NDM-5,CTX-M-3 and CTX-M-65 in three plasmids with serotype O89:H10strain belonging to the ST2 clone in China[J].Microbial Pathogenesis,2019,128:1–6.
[16] PALZKILL T.Structural and mechanistic basis for extended-spectrum drug-resistance mutations in altering the specificity of TEM,CTX-M,and KPC β-lactamases[J]. Frontiers in Molecular Biosciences,2018,5:16.
[17] 贺丹丹.CTX–M型杂合酶生化特性及遗传特征研究[D].广州:华南农业大学,2016. HE D D.Biochemical and genetic characteristics of CTX-M hybrid[D].Guangzhou:South China Agricultural University,2016.
Molecular epidemiologic characteristics ofCTX-Mgenes of ESBLs-producingisolates from food animals in Sichuan province
YANG Chenglin1, WU Congming2, WANG Shuang1, LIN Juchun1*
(1.College of Veterinary Medicine, Sichuan Agricultural University, Chengdu, Sichuan 611130, China; 2.College of Veterinary Medicine, China Agricultural University, Beijing 100193, China)
123 extended-spectrum β-lactamase-producing(ESBL-EC) were isolated and collected from food-producing animals(swine and chicken) of different farms in Sichuan province from 2010 to 2016. PCR and DNA sequencing were performed to detectionCTX-Mgenes. Pulsed-field gel electrophoresis(PFGE) was used for molecular typing of 33 isolates of the 123 isolates with different sources. The results showed that prevalence ofCTX-Mwas 91.9%(113/123) in ESBL-EC isolates, among whichCTX-M-55andCTX-M-65were the dominant genotypes. The occurrence ofCTX-Mwas increasing yearly;CTX-Mvariants were observed in isolates from chicken and swine; 9 types of mutations ofCTX-Mgenes were found in 12 isolates, in which 10 were sense mutations, which made 7 types of amino acid substitutions; 33 isolates were classified into 32 types by PFGE. In sumary,CTX-Mgenotypes were mutated, and had spread widely among different molecular types of ESBL-EC isolates from food animals in Sichuan province.
swine; chicken; food animal;;β-lactamases;CTX-M; molecular epidemiologic characteristics; Sichuan

S852.61
A
1007-1032(2020)04-0456-05
10.13331/j.cnki.jhau.2020.04.012
杨承霖,吴聪明,王爽,林居纯.四川省食品动物源大肠埃希菌产ESBLs菌株CTX–M基因的分子流行特征[J].湖南农业大学学报(自然科学版),2020,46(4):456–460.
YANG C L, WU C M, WANG S, LIN J C. Molecular epidemiologic characteristics ofCTX-Mgenes of ESBLs-producingisolates from food animals in Sichuan province[J]. Journal of Hunan Agricultural University (Natural Sciences), 2020, 46(4): 456–460.
http://xb.hunau.edu.cn
2019–09–26
2020–01–22
国家重点研发计划专项(2018YFD0500300)
杨承霖(1993—),男,硕士,主要从事细菌耐药性研究,377396380@qq.com;
,林居纯,教授,主要从事兽医药理学与毒理学研究,juchunlin@126.com
责任编辑:邹慧玲
英文编辑:柳正

