重组人Dickkopf相关蛋白1在氟化钠所致PC12细胞损伤中的作用及其机制
岳苏阳,丁 钦,李慧华,陈 锐*
0 引言
氟化物广泛存在于自然界和日常生活中,目前正成为一种不可避免的环境污染物,其能够引起海马神经元损伤、影响神经再生以及突触可塑性。有研究表明,氟化物的细胞毒性与细胞凋亡、氧化应激、DNA和RNA的一般变化以及蛋白质的生物合成有关[1]。长期暴露会导致氟中毒和不可逆转的脑损伤,并诱导神经元凋亡,损害神经发生、突触的可塑性以及突触的功能,破坏突触相关蛋白的表达,导致大脑皮层微管相关蛋白2(MAP2)、突触素(SYP)和发育受调节的脑蛋白(Dbn)在蛋白和mRNA水平上的表达明显降低,氟化物介导的认知功能障碍的减少可能是由于这些突触相关蛋白表达的破坏,导致神经元功能减弱而引起[2-3]。有研究表明,Wnt信号通路参与了暴露于氟化物的PC-12细胞的抗增殖过程,DDK1则能够减弱PC-12细胞中氟化物的抗增殖活性[4]。此外,氟化物可通过JNK和Wnt信号通路来抑制细胞增殖。
Dickkopf-1 (DKK-1)在体内参与了许多病理生理过程,其异常表达不仅会改变典型Wnt/β-catenin信号通路中相关蛋白和基因的表达,还会改变其他信号通路中相关蛋白和基因的表达。以往对DKK-1的研究主要集中在其在肿瘤中的作用,近年大量研究表明,其在胚胎发育、神经再生、突触形成等方面发挥着重要作用,因此,DKK-1在神经发育不良、认知功能障碍、情绪障碍等神经精神疾病中的作用越来越受到人们的重视[5]。DKK-1作为调控Wnt通路的关键负性因子,在正常脑组织中很少表达,但是DKK-1在发生神经元凋亡的脑组织中高表达,提示DKK-1可能参与了神经元凋亡的过程[6]。DKK-1在许多肿瘤中低表达,但在部分肿瘤中高表达,越来越多的证据表明,DKK-1在不同肿瘤的发生、发展和转移中起着复杂而不同的作用[7]。因此,笔者提出设想,DKK-1可通过诱导氟中毒神经细胞的凋亡,抑制神经再生,从而改变认知功能。本实验通过对PC12细胞给予氟化钠处理,观察PC12细胞的增殖、凋亡情况以及DKK-1、β-catenin的表达变化。
1 材料与方法
1.1 材料 PC12细胞株购自上海中科院细胞所,NaF购自德国耶拿生物科学公司,RPMI-1640购自美国Hyclone公司,胎牛血清(Fetal bovine serum,FBS)购自美国Gemini公司,蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、Annexin V FITC/PI细胞凋亡试剂盒购自徐州博立达生物科技有限公司,CCK-8购自日本同仁化学研究所,DKK-1、β-catenin兔单克隆抗体购自美国Abcam公司,actin鼠单克隆抗体购自美国Santa公司。
1.2 方法
1.2.1 PC12细胞培养 用含10%FBS、双抗的RPMI-1640培养基作为生长培养基,将PC12细胞接种到半径5 cm的培养皿中,置于5%CO2培养箱内培养,培养温度为37 ℃。待细胞生长密度达70%~80%后,用胰蛋白酶EDTA消化液加以消化细胞,按1∶3予以分皿传代。
1.2.2 CCK-8检测相关细胞增殖率 细胞以5×103/孔密度接种到96孔板中,待细胞贴壁后加入2 000 μM NaF,干预0、6、12、24、48 h。每组设置了6个副孔。吸除培养基,用37 ℃ PBS洗2次,每孔加入100 μl用培养基配制的10%CCK-8液体,在37 ℃、5%CO2条件下培育1 h,并使用450 nm波长酶标仪测定吸光度值。
1.2.3 Western blot方法检测DKK-1与β-catenin蛋白表达水平 按照“1.2.2”所示分组,2 000 μM NaF干预,按照试剂盒说明书步骤予以提取蛋白,BCA法测定蛋白浓度,取等量蛋白进行10%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,将蛋白转移至NC膜上,牛奶室温封闭2 h,1抗4 ℃孵育过夜,Washing buffer清洗5 min×3次,荧光2抗室温孵育2 h,Washing buffer清洗5 min×3次,Odyssey红外激光成像,Image J软件分析灰度值。
1.2.4 转染 转染前24 h,用胰蛋白酶处理处于对数生长期的PC12细胞,以含10%血清的培养基调整细胞密度约5×106个细胞/15 ml,重新接种于10 cm细胞培养皿,37 ℃、5%CO2培养箱内培养。24 h待细胞密度达70%~80%时即可用于转染;向灭菌离心管中加入无双抗培养基与病毒液(10 μl n-siRNA、10 μl Dkk1-siRNA),调整总体积为6 ml,混匀后,给细胞换液,于37 ℃、5%CO2细胞培养箱中培养。培养24 h后,弃去含有转染混和物的培养基,加入2 ml PBS液清洗2次,轻柔晃动培养皿以洗涤残余的转染混和物后倒弃;然后缓慢加入含10%血清的细胞培养基6 ml,于37 ℃、含5%CO2培养箱内继续培养48 h,于荧光显微镜下观察转染情况,若效果较好,则予以提取细胞蛋白,Western blot检测DKK-1干扰效果。转染成功后加入NaF药物干预,检测Wnt/β-catenin通路蛋白变化。依据说明书,运用Annexin V FITC/PI细胞凋亡试剂盒检测细胞凋亡情况。

2 结果
2.1 NaF对PC12细胞活性的影响 光镜下观察,对照组细胞贴壁良好,细胞呈梭形,向外突起明显。细胞经NaF损伤后,细胞皱缩,突起变短,部分细胞甚至脱落。CCK-8结果显示,与对照组相比,氟化钠药物组细胞活性明显降低(P<0.05或P<0.01)。见图1。

图1 NaF对PC12细胞活性的影响
*P<0.05,**P<0.01
2.2 NaF对DKK-1蛋白表达的影响 Western blot方法检测NaF对DKK-1蛋白表达的影响,与对照组比较,NaF损伤24 h和48 h后,DKK-1蛋白的表达随着NaF损伤时间的增加而升高,差异有统计学意义(P<0.05)。见图2。
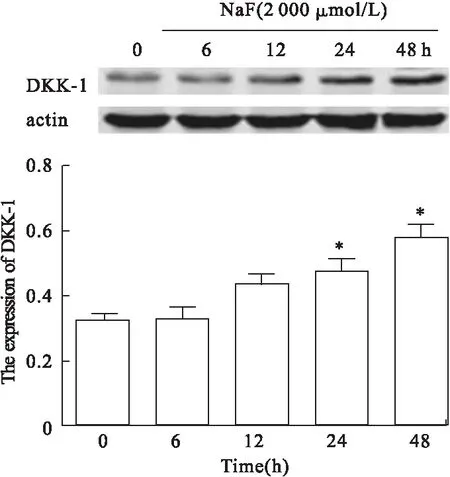
图2 Western blot方法检测NaF损伤后细胞中DKK-1蛋白表达
2.3 转染 荧光显微镜下观察空载病毒(n-siRNA)与DKK-1干扰病毒(DKK-1-siRNA)转染情况,WB方法结果提示DKK-1干扰效果较好(图3)。
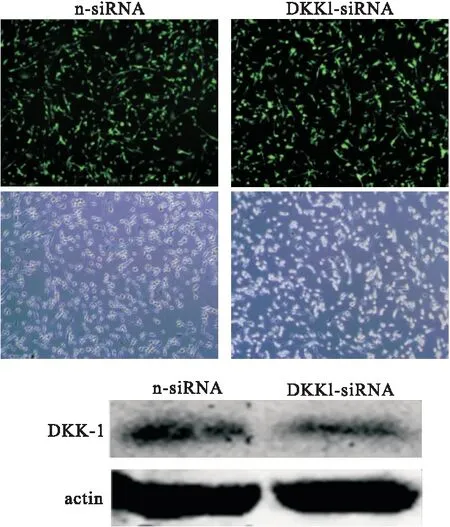
图3 DKK-1-siRNA与n-siRNA干扰结果对比
2.4 DKK-1对Wnt/β-catenin信号通路的影响 与n-siRNA对比,NaF组DKK-1蛋白表达明显升高,β-catenin蛋白表达明显降低(P<0.05)。与n-siRNA+NaF组对比,DKK-1-siRNA组DKK-1蛋白表达降低,β-catenin蛋白表达升高(P<0.05)。见图4。
2.5 DKK-1对细胞凋亡的影响 与n-siRNA对比,n-siRNA+NaF组细胞凋亡增多。与n-siRNA+NaF组对比,DKK-1-siRNA组细胞凋亡减少。见图5。
3 讨论
流行病学研究报告显示,高氟化饮用水可能会显著降低接触儿童的智商(IQ)。有报道,突触可塑性是发展儿童的学习和记忆技能的基础[8]。氟化物暴露与智商的关系呈分段线性关系,具有阈值和饱和效应,而适度过量氟化物暴露主要与优秀智力的丧失有关[9]。
过量氟化物暴露导致的细胞凋亡、智力受损主要有以下机制:①内质网应激(ERS)诱导的神经元损伤:一定剂量的NaF可以导致神经元细胞凋亡,其中过量的氟产生了过量的ROS,诱导神经元中过度的氧化应激和ERS,加剧了神经元的凋亡,并且在细胞凋亡水平与细胞内ROS水平之间呈线性关系,最后导致损伤[10]。②JNK途径:高剂量的NaF通过半胱天冬酶介导但不依赖ROS的途径中的细胞凋亡导致hESC死亡,并伴随着磷酸化c-Jun N端激酶(p-JNK)水平的增加。用p-JNK特异性抑制剂(SP600125)进行预处理可以以浓度和时间依赖性方式有效保护hESC免受NaF诱导的细胞死亡[11]。③Fas-L途径:在一定的研究条件下,Fas-L依赖性信号通路被激活,进而使得NaF诱导了低水平的细胞凋亡[12]。④Wnt/β-catenin 信号通路:氟能够通过激活Wnt/β-catenin 途径,并改变相关基因的表达和细胞中β-catenin蛋白的位置,从而调节细胞的增殖[13]。⑤M1和M3毒蕈碱型乙酰胆碱受体的表达水平:慢性氟中毒大鼠学习和记忆障碍的机制可能与mAChRs中M1和M3表达的降低有关[14]。⑥氟化物对某些神经递质水平的改变及其神经毒性:氟化物含量的增加导致某些神经递质(如肾上腺素、组胺、5-羟色胺和谷氨酸盐)的水平升高,而去甲肾上腺素、乙酰胆碱和多巴胺的水平呈剂量依赖性降低。同时,脂质过氧化作用显著增加,抗氧化防御系统受损。研究结果表明高剂量的NaF对神经有毒性作用[15]。考虑到氟化物可通过JNK和Wnt信号通路来抑制细胞增殖,随着 Wnt信号通路的活化,氟暴露水平的增加,GSK3β、β-catenin含量以及DKK-1、GSK3β、β-catenin 的异常检出率逐渐增加,但 DKK-1 含量显著降低[16-17]。DKK-1作为调控Wnt通路的关键负性因子,在正常脑组织中很少表达,但其在发生神经元凋亡的脑组织中高表达,提示DKK-1可能参与了神经元凋亡的过程[8]。
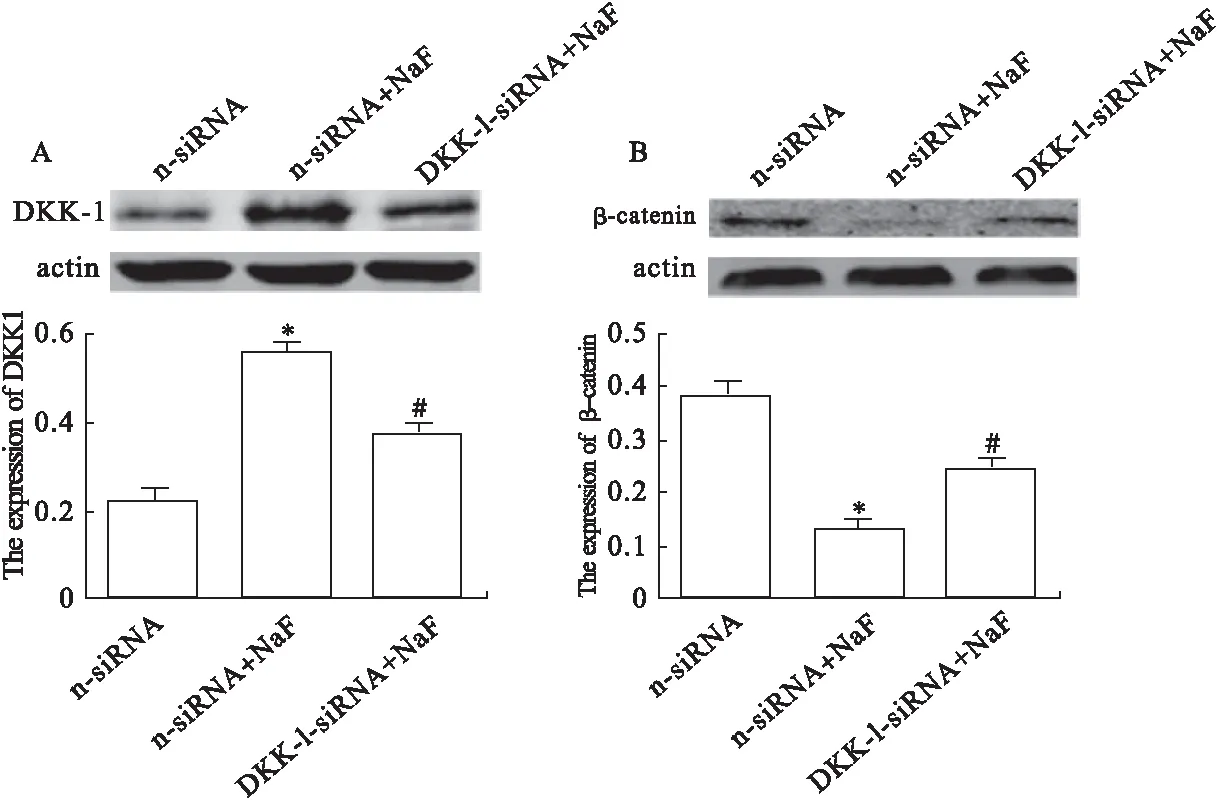
图4 DKK-1对Wnt/β-catenin信号通路的影响
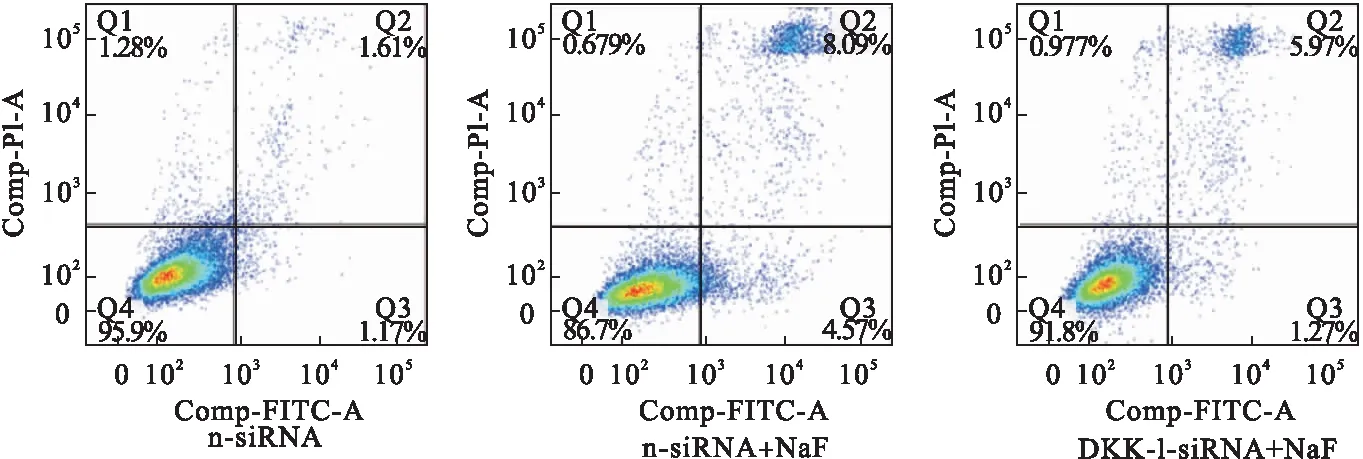
图5 DKK-1对细胞凋亡的影响
Dickkopf(DKK)家族由脊椎动物中的4个分泌蛋白组成(DKK 1、2、3、4),是Wnt信号通路最关键的拮抗剂家族之一,其中DKK-1主要通过与低密度脂蛋白受体相关蛋白5/6(LRP5/LRP6)受体及Kremen-1/2结合成复合物而阻断Wnt信号传导[18-19]。DKK-1是信号通路Wnt/β-catenin通路的抑制剂,在肿瘤发生过程中发挥着相互矛盾的作用,既可以作为肿瘤转移的癌基因启动子,也可以作为肿瘤抑制子,DKK-1可以通过重塑肿瘤微环境和诱导炎症,促进肿瘤的侵袭和迁移[20]。
Wnt信号传导异常与几种疾病有关,例如AD、癫痫、代谢性疾病等。其中阿尔茨海默氏病(AD)是老年性痴呆的最常见形式,其特征是β-淀粉样蛋白(Aβ)沉积在特定的大脑区域,由Aβ诱导的Wnt信号的下调与AD的疾病进展有关。此外,越来越多的证据支持Wnt信号在胚胎发育过程中的中枢神经系统(CNS)发育以及成年大脑的结构和功能调节中起着关键作用。更重要的是,通过Wnt配体持续激活Wnt信号,或抑制Wnt信号的负调节剂,例如在疾病中活跃的DKK-1和GSK-3β,能够降低Aβ毒性并改善AD的认知能力[21]。因此,Wnt信号通路抑制剂DKK-1也可能通过影响神经干细胞的再生,引起氟中毒所致的认知功能障碍。本实验发现,NaF会影响细胞的活性,降低其增殖能力,并且随着NaF干预时间的增加,DKK-1蛋白的表达水平也随之增高。此外,DKK-1还与细胞凋亡之间存在密切联系,通过阻断Wnt /β-catenin途径能够促进Eca109细胞的凋亡[22]。Zhang等[23]研究发现,DKK-1表达的降低,使得Wnt /β-catenin信号通路激活,进而促进成骨细胞增殖。反之,DKK-1的异位表达可抑制细胞增殖,或通过凋亡增强因子诱导凋亡[24]。本项研究发现,NaF能够通过抑制Wnt/β-catenin信号通路激活进而诱发细胞凋亡,反之,干扰DKK-1的表达后,Wnt/β-catenin信号通路重新激活,细胞凋亡减少。
综上所述,DKK-1能促进氟化钠导致的神经细胞PC-12凋亡,其作用机制可能是通过抑制Wnt/β-catenin信号通路进而发挥作用。明确DKK-1在氟中毒所致认知障碍中的作用机制,将为氟中毒所致认知功能障碍的后续治疗和及早干预提供新的可能策略,也能够为今后靶向药物的研发提供理论参考依据。

