苍附导痰汤加二甲双胍联合穴位埋线对肥胖型多囊卵巢综合征不孕症患者免疫功能及肠道菌群的影响
姜晓琳,刘 静,张 阳,褚春莉,董晓茜,张立德
高雄激素血症、月经紊乱、肥胖及不孕等是多囊卵巢综合征(polycystic ovary syndrome, PCOS)患者的主要临床表现,PCOS在育龄期女性较为常见[1-5]。目前有研究表明肠道微生态稳态失衡是PCOS发病的重要因素,肠道微生态稳态失衡可以诱发免疫异常、内分泌紊乱和代谢功能异常,故肠道菌群可以作为治疗PCOS的靶点[6]。《叶天士女科诊治秘方》中记载苍附导痰汤具有很强的健脾、化痰和祛湿功效,适用于治疗肥胖型PCOS[7]。穴位埋线是一种长效针刺治疗,可减少反复多次针刺治疗对机体的损伤,减轻患者的痛苦,肥胖型PCOS患者通过针刺治疗能改善血脂代谢功能和性激素水平,从而取得较好临床效果[8]。本研究将苍附导痰汤和穴位埋线联合应用于肥胖型PCOS患者,取得了较好临床效果,得到了患者认可,现具体报告如下。
1 资料与方法
1.1一般资料 选取2015年2月—2019年2月辽宁中医药大学附属医院招募的符合纳入及排除标准的肥胖型PCOS不孕症120例,采用随机数字表法随机将其分为观察组和对照组两组各60例,其中84例顺利完成研究,观察组40例,对照组44例。两组一般资料比较差异无统计学意义(P>0.05),见表1,具有可比性。本研究经辽宁中医药大学附属医院医学伦理委员会批准,患者和(或)其家属均对本研究有充分了解,皆签署知情同意书。
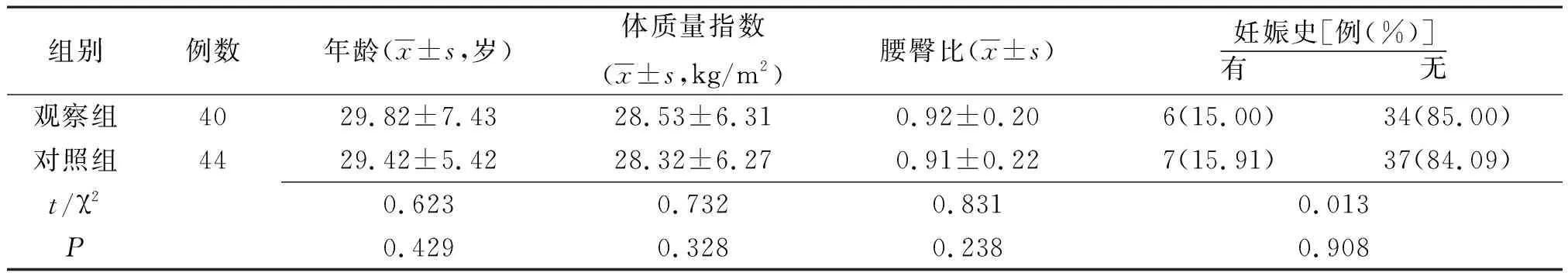
表1 采用不同方法治疗的肥胖型多囊卵巢综合征不孕症两组一般资料比较
1.2诊断标准 应用2003年美国生殖医学协会与欧洲人类鹿特丹会议所采定的PCOS诊疗方案[9]:①排卵次数降低,严重者甚至排卵消失;②因高雄激素血症导致多毛及痤疮等相关症状;③妇科彩色多普勒超声检查提示卵巢呈现出多囊样。满足上述标准中2条即可明确诊断PCOS,且诊断过程中要排除其他疾病导致的内分泌异常而出现的相关高雄激素血症样表现。肥胖诊断依照世界卫生组织2000年会议提出的诊断标准[10]:体质量指数(body mass index, BMI)≥25 kg/m2与腰臀比(waist-to-hipratio,WHR)≥0.85。
1.3纳入及排除标准 纳入标准:①符合上述诊断标准;②无重要器官功能障碍;③患者依从性好。排除标准:①其他内分泌原因导致内分泌疾病者;②重要器官功能障碍者;③近期(3个月内)使用糖皮质激素治疗者;④存在抑郁等心理问题不能很好配合治疗者;⑤入组前1个月内服用影响免疫细胞药物与菌群药物者。
1.4治疗方案 对照组采用苍附导痰汤加二甲双胍进行治疗,其中苍附导痰汤由辽宁中医药大学附属医院提供;二甲双胍为美国百时美施贵宝公司产品,每片500 mg,生产批号H20040416。苍附导痰汤组方[11]:苍术12 g、陈皮8 g、香附10 g、胆南星12 g、桃仁8 g、当归15 g、制半夏10 g、茯苓15 g、生姜5 g、枳壳10 g、神曲12 g、甘草8 g。随经期进行药材加减,经前期加用川牛膝、益母草和桃仁各10 g;经期加用川牛膝12 g,五灵脂和蒲黄各10 g;经后期加服枸杞子和覆盆子各12 g,菟丝子10 g,桑葚8 g。每日1剂,上述各药材混合后加水浸泡12 h,武火煎煮至沸腾后,文火持续加热30 min,过滤,重复上述操作3次,合并3次药液后浓缩至200 ml,连续治疗12周,分早晚2次口服,每次100 ml,连续治疗12周。二甲双胍每日2片,分别于早餐和晚餐中口服,连续治疗12周。观察组在对照组治疗基础上给予穴位埋线。选取中脘、足三里、天枢、气海和三阴交进行埋线。操作方法:患者取仰卧位,消毒需要埋线的穴位,取一次性8号注射针头(前端置入1 cm可吸收外科线),对准所选穴位缓慢进针,有针感后,边推针芯边退针管,将线体埋植在穴位的肌层或皮下组织内,2周更新1次埋线,共治疗12周。若月经来潮则停止治疗,于经后第5天继续治疗。随访情况:每周电话随访1次,每2周门诊随访1次。
1.5观察指标及检测方法 对两组临床研究完成情况及退出原因进行分析,比较两组治疗前后T细胞免疫应答指标、胰岛素抵抗指标和肠道菌群情况,并观察两组治疗期间不良反应发生情况。
1.5.1T细胞免疫应答指标:抽取两组治疗前后肘静脉血5 ml,采用酶联免疫吸附试验法检测血清转化生长因子-β1(TGF-β1)、白细胞介素-10(IL-10)和白细胞介素-17(IL-17)水平。
1.5.2胰岛素抵抗指标:抽取两组治疗前后清晨空腹肘静脉血5 ml检测空腹血糖(FBG)(葡萄糖氧化酶法)、空腹胰岛素(FINS)(化学发光法);口服无水葡萄糖75 g,2 h后再次抽取肘静脉血测定餐后2 h血糖(2 h PBG)。血脂系列检测采用全自动生化分析仪(ADVIA 1800型)进行,根据公式计算稳态模型胰岛素抵抗指数(HOMA-IR):HOMA-IR=FINS×FBG/22.5。
1.5.3肠道菌群情况:治疗前后收集两组新鲜粪便1 g,放于无菌便盒内(30 min内检测),每次取0.1 g粪便,先使用0.9%氯化钠注射液稀释100倍,再按照程度每次稀释10倍,稀释6次,分别成为10-2、10-3、10-4、10-5、10-6、10-7、10-8的稀释液,肠杆菌、乳酸杆菌及双歧杆菌分别选择10-4、10-5、10-6的稀释液进行培养,肠球菌选择10-3、10-4、10-5的稀释液进行培养,肠杆菌和肠球菌在常规恒温箱中培养24~48 h,乳酸杆菌和双歧杆菌在厌氧状态下培养48~72 h,计算各个稀释平板内的菌落数。
1.5.4不良反应发生情况:观察两组治疗期间不良反应发生情况,不良反应包括皮疹及因埋线导致的皮肤红肿等。

2 结果
2.1临床研究完成情况及退出原因分析 观察组临床研究完成率为66.67%(40/60),对照组临床研究完成率为73.33%(44/60),两组临床研究完成率比较差异无统计学意义(χ2=0.635,P=0.426)。治疗过程中,观察组因个人原因(不能承担相应医疗费用)放弃治疗10例(16.67%),出现药物过敏反应放弃治疗5例(8.33%),失访5例(8.33%);对照组因个人原因(不能承担相应医疗费用)放弃治疗8例(13.33%),出现药物过敏反应放弃治疗3例(5.00%),失访5例(8.33%)。
2.2T细胞免疫应答指标比较 治疗前,两组T细胞免疫应答指标比较差异均无统计学意义(P>0.05)。治疗后,两组血清TGF-β1和IL-10水平均较治疗前升高(观察组:t=16.327、P<0.001,t=17.549、P<0.001;对照组:t=12.762、P<0.001,t=11.529、P<0.001),血清IL-17水平均较治疗前降低(观察组:t=12.439、P<0.001;对照组:t=9.629、P<0.001),差异有统计学意义。治疗后,观察组血清TGF-β1和IL-10水平高于对照组,血清IL-17水平低于对照组,差异有统计学意义(P<0.01)。见表2。

表2 采用不同方法治疗的肥胖型多囊卵巢综合征不孕症两组治疗前后T细胞免疫应答指标比较
2.3胰岛素抵抗指标比较 治疗前,两组FBG、2 h PBG、FINS和HOMA-IR水平比较差异均无统计学意义(P>0.05)。治疗后,两组FBG、2 h PBG、FINS和HOMA-IR水平均较治疗前降低,差异有统计学意义(观察组:t=11.326、P<0.001,t=12.327、P<0.001,t=11.327、P=0.003,t=13.438、P<0.001;对照组:t=8.439、P=0.006,t=9.528、P=0.005,t=8.327、P=0.006,t=9.432、P=0.005)。治疗后,观察组FBG、2 h PBG、FINS和HOMA-IR水平均低于对照组,差异有统计学意义(P<0.01)。见表3。

表3 采用不同方法治疗的肥胖型多囊卵巢综合征不孕症两组治疗前后胰岛素抵抗指标比较
2.4肠道菌群情况比较 治疗前,两组肠杆菌、肠球菌、乳酸杆菌及双歧杆菌比较差异均无统计学意义(P>0.05)。治疗后,两组肠杆菌均较治疗前降低,乳酸杆菌及双歧杆菌均较治疗前升高,差异有统计学意义(观察组:t=17.823、P<0.001,t=28.327、P<0.001,t=24.437、P<0.001;对照组:t=12.459、P<0.001,t=23.382、P<0.001,t=19.325、P<0.001);两组肠球菌与治疗前比较差异无统计学意义(观察组:t=0.843,P=0.215;对照组:t=0.782,P=0.341)。治疗后,观察组肠杆菌低于对照组,乳酸杆菌和双歧杆菌高于对照组,差异有统计学意义(P<0.01);两组肠球菌比较差异无统计学意义(P>0.05)。见表 4。
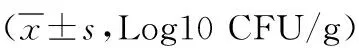
表4 采用不同方法治疗的肥胖型多囊卵巢综合征不孕症两组治疗前后肠道菌群情况比较
2.5不良反应发生情况 治疗期间,两组均未出现严重不良反应,观察组出现皮疹5例(12.50%),因埋线导致皮肤红肿1例(2.50%);对照组出现皮疹5例(11.36%)。两组出现不良反应者均未影响治疗,且皆未行特殊处理好转。
3 讨论
PCOS的发病机制目前存在较大争议,具体原因尚不明确,涉及内分泌、免疫功能失调及代谢异常等方面;近年研究显示肠道菌群异常也是其发生的重要原因,可诱导PCOS发生和发展[12-17]。Lindheim等[18]研究发现,肠道菌群失调可导致肠道黏膜屏障通透性增加,渗透性增强,肠道内毒性物质进入血液增加,激活免疫系统,造成抗原-抗体反应,免疫系统异常导致胰岛素受体功能受损,作用力降低,进而促进体内胰岛素浓度升高,造成胰岛素异常,同时造成卵巢雄激素分泌量增加,进一步导致排卵功能及卵巢功能异常,卵巢早衰造成促卵泡激素进一步升高,致使卵巢过度分泌,加重卵巢细胞凋亡,形成恶性循环。从中医理论的角度上说,脾虚是促进痰湿内生的重要因素,而肥胖型PCOS的主要病理机制是痰湿内生,中医上认为脾的功能涉及现代西医中的胰腺、肝及胃等多个脏器的功能,脾的运化功能失调,导致胰腺与肝脏分泌的消化激素量或者受体敏感性降低,胰腺分泌胰岛素量降低,进而出现血糖升高、胰岛素抵抗,影响消化功能,毒性物质长期在肠道内蓄积,导致黏膜屏障功能大大受损,造成肠道微生物稳态失衡[19-20]。
苍附导痰汤是治疗肥胖型PCOS的经典方剂,可改善PCOS患者的炎症状态和胃肠功能稳态,切中发病机制。其方剂中陈皮、茯苓、半夏及苍术都可以调节脾的生理功能,除积散滞;胆南星燥湿化痰;香附疏肝理气[11]。穴位埋线治疗属于中医中的瑰宝,归类于埋植疗法的范畴,是以中医古典理论(《灵枢·终始》中的“久病者,邪气入深,刺此病者,深纳而久留之”)为基础,利用现代医用技术和材料发展起来的,兴起于20世纪60年代初,随着医疗材料的发展,其应用也越来越广,治疗效果也越来越好,其埋置在体内能够长时间发挥治疗作用,而针灸治疗不能长时间发挥治疗作用,这样很好地弥补了针灸治疗的缺陷[21]。穴位埋线治疗的出现使针灸反复多次刺激模式变成长效刺激模式而减少了患者的痛苦,也给患者带来了很大的便利[22]。穴位埋线选取中脘、足三里、天枢、气海和三阴交可促进肠道的良性蠕动,增强胃动力,促进肠道功能[23]。本研究从生物屏障和免疫屏障的角度研究苍附导痰汤加二甲双胍联合穴位埋线对肥胖型PCOS不孕症患者免疫功能及肠道菌群的影响。
T细胞介导的免疫应答在胰岛素抵抗中有着重要作用[24],其细胞亚群中的Treg和Th17在生理状态下维持着稳态平衡[25]。肠道免疫平衡主要由效应T细胞和Treg细胞调控[26]。转录因子Foxp 3通过Treg细胞群特异性表达[27],可合成和分泌TGF-β1和IL-10,并减轻胰岛素抵抗,抑制IL-17分化成熟[28]。转录因子RORγt通过Th17细胞群特异性表达,可合成和分泌IL-17,并引起胰岛素抵抗,诱导炎症反应[29]。肠道炎症反应增加,黏膜通透性受到影响,使肠道菌群中优势菌如乳酸杆菌、双歧杆菌数量下降,而肠杆菌、肠球菌等条件致病菌数量增加,出现肠道菌群紊乱。
本研究结果显示,治疗前,两组T细胞免疫应答指标、胰岛素抵抗指标及肠道菌群情况比较差异均无统计学意义。治疗后,两组血清TGF-β1、IL-10水平及乳酸杆菌、双歧杆菌均较治疗前升高;血清IL-17,FBG、2 h PBG、FINS、HOMA-IR水平,以及肠杆菌均较治疗前降低,差异有统计学意义。治疗后,观察组血清TGF-β1、IL-10水平及乳酸杆菌、双歧杆菌高于对照组;血清IL-17,FBG、2 h PBG、FINS、HOMA-IR水平,以及肠杆菌低于对照组,差异有统计学意义。治疗期间,观察组出现皮疹5例,因埋线导致皮肤红肿1例;对照组出现皮疹5例。说明苍附导痰汤加二甲双胍联合穴位埋线应用于肥胖型PCOS不孕症可以减少胰岛素抵抗、纠正Treg/Th17失衡、调节T细胞免疫应答、改善肠道微生物稳态失衡,且不良反应较少。
综上所述,苍附导痰汤加二甲双胍联合穴位埋线应用于肥胖型PCOS不孕症可以减少胰岛素抵抗、纠正Treg/Th17失衡、调节T细胞免疫应答、改善肠道微生物稳态失衡,且不良反应较少。临床在治疗肥胖型PCOS不孕症患者时,除了采取传统的改善脂糖代谢和激素紊乱等措施外,还可把肠道菌群看作是治疗的靶点和评估临床疗效的重要指标。

