静动脉二氧化碳分压差对感染性休克液体复苏的指导作用分析
钟振强,赵文超
(深圳市宝安区松岗人民医院,广东 深圳 518105)
感染性休克在临床较为常见,可影响机体灌注,造成代谢紊乱、组织细胞缺氧缺血等,严重者甚至可出现多器官功能衰竭[1-2]。目前,临床治疗感染性休克的关键为早期目标导向的液体复苏(EGDT)。但是,治疗过程中,患者EGDT虽然已达到目标,中心静脉血氧饱和度(ScvO2)≥70%,却仍有证据显示机体组织存在血流动力学异常、血流紊乱、低氧代谢等现象[3]。静动脉二氧化碳分压差(Pcv-aCO2)为临床常用的液体复苏治疗辅助参数,近年来逐渐用于感染性休克患者液体复苏。本研究将Pcv-aCO2用于感染性休克患者液体复苏,旨在进一步探讨其指导作用。
1 资料与方法
1.1 资料
抽取2018年3月至2019年5月收治的88例行液体复苏治疗的感染性休克患者,按照Pcv-aCO2监测与否分为研究组与参照组,每组44例。研究组,男性24例,女性20例;年龄35~78岁,平均(53.75±3.14)岁;肺部感染 19例,尿路感染 10例,腹腔感染10例,其他5例。参照组,男性25例,女性19例,年龄33~79岁,平均(53.69±3.18)岁;肺部感染 20例,尿路感染11例,腹腔感染9例,其他4例。两组患者一般资料比较差异无显著性(P>0.05)。
1.2 纳入与排除标准
纳入标准:符合感染性休克诊断标准,经液体复苏治疗1 h后,仍出现平均动脉压(MAP)<60 mmHg、收缩压<90 mmHg现象,或收缩压下降>40 mmHg,伴意识障碍、少尿等器官组织低灌注表现;患者或家属知情,并签署知情同意书。
排除标准:不可逆临终状态,或预测24 h内死亡者;合并心源性休克、急性心肌梗死者;有血液透析史者;合并严重内脏损伤且未行手术治疗者;临床资料不完整者;治疗6 h未达到预设目标者;妊娠期、哺乳期女性。
1.3 方法
参照组治疗6 h达到以下目标:ScvO2≥70%、MAP为65~90 mmHg、尿量≥0.5 ml/(kg·h)、CVP为8~12 mmHg。CVP<8 mmHg时,继续实施液体复苏治疗直到达标;CVP为8~12 mmHg时,对MAP<65 mmHg者给予针对性补液,对MAP≥65 mmHg者行限制性液体复苏;若CVP>12 mmHg,应严格限制补液量及输注速度,对MAP<65 mmHg者适当给予去甲肾上腺素,按照患者实际情况调整复苏方案。
以参照组治疗方案为基础,研究组实施Pcv-aCO2<6 mmHg治疗6 h。在Pcv-aCO2<6 mmHg时,CVP为8~12 mmHg者,维持液体基础量;CVP<8 mmHg者给予托拉塞米,初始剂量为5 mg/d,之后根据治疗效果调整剂量,每日剂量不超过100 mg;CVP>12 mmHg者,限制液体量,并给予利尿剂。当Pcv-a-CO2≥6 mmHg时,CVP≤12 mmHg者行液体复苏治疗;CVP>12 mmHg者,则限制液体量,同时给予多巴酚丁胺治疗,若患者收缩压<80 mmHg,则应用血管活性药。
1.4 观察指标
对两组治疗前后CVP、ScvO2、心脏指数(CI)进行比较,记录两组液体平衡量、机械通气时间、ICU住院时间。
1.5 统计学方法
2 结果
2.1 两组临床指标差异
治疗前,两组 CVP、ScvO2、CI比较差异无显著性(P>0.05);治疗后,研究组上述指标均高于参照组(P<0.05),见表1。
表1 两组治疗前后临床指标比较(±s)
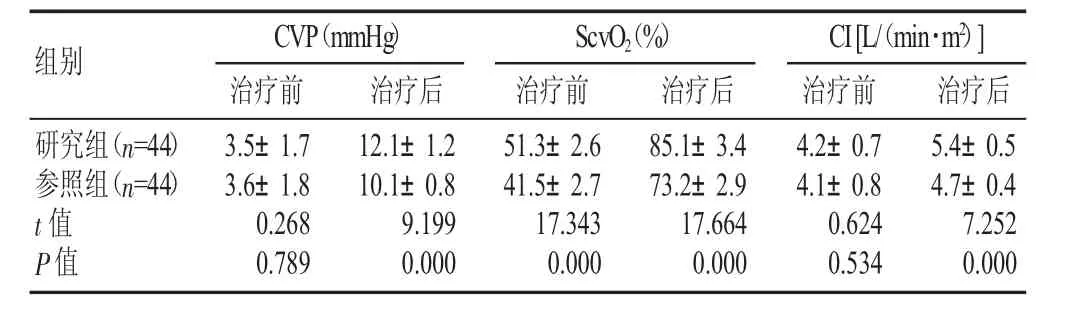
表1 两组治疗前后临床指标比较(±s)
组别CVP(mmHg)ScvO2(%)CI[L/(min·m2)]治疗前治疗后治疗前治疗后治疗前治疗后研究组(n=44)参照组(n=44)t值P值3.5±1.7 3.6±1.8 0.268 0.789 12.1±1.2 10.1±0.8 9.199 0.000 51.3±2.6 41.5±2.7 17.343 0.000 85.1±3.4 73.2±2.9 17.664 0.000 4.2±0.7 4.1±0.8 0.624 0.534 5.4±0.5 4.7±0.4 7.252 0.000
2.2 两组液体平衡量、机械通气时间及ICU住院时间比较
研究组液体平衡量明显少于参照组,机械通气时间、ICU住院时间明显短于参照组(P<0.05),见表2。
表2 两组液体平衡量、机械通气及ICU住院时间比较(±s)

表2 两组液体平衡量、机械通气及ICU住院时间比较(±s)
组别 液体平衡量(L)2.3±0.5 3.2±0.9 5.799 0.000研究组(n=44)参照组(n=44)t值P值机械通气时间(d)11.3±1.8 15.2±2.3 8.858 0.054 ICU住院时间(d)9.1±0.8 13.8±1.9 15.123 0.000
3 讨论
3.1 CVP对感染性休克患者液体复苏的指导效果
通过监测CVP对感染性休克患者血流动力学变化进行观察在临床应用较为广泛。临床上普遍认为CVP可评价液体复苏效果,为判断感染性休克液体复苏成功与否的重要标志之一[4]。但近年来有学者认为,CVP可受心率、正压通气、肺静脉压力等因素影响,导致准确性较低,难以对血管内容量、输液反应性进行评估[5]。亦有研究表示,ScvO2下降不一定为组织灌注不佳所致,可能与心排血量下降相关,对感染性休克患者实施液体复苏治疗,即便ScvO2>70%,仍有部分患者存在血流紊乱、低氧代谢等现象,严重者甚至因多器官衰竭而死亡[6]。
3.2 Pcv-aCO2对感染性休克患者液体复苏的指导作用
程书立等[7]研究认为,Pcv-aCO2升高为感染性休克患者早期复苏不充分的重要指标,可对患者组织灌注、循环血流量等进行动态评价。Pcv-aCO2升高提示组织缺氧后心输出量不足以补偿,毛细血管再灌注不足,难以将生成的CO2清除[8]。本次研究结果显示,研究组CVP恢复情况明显好于参照组,从血流动力学方面肯定了Pcv-aCO2对感染性休克患者液体复苏的指导作用。ScvO2为感染性休克患者行液体复苏治疗的指导性目标,可反映全身代谢状况,当机体尿量、心率、CVP、血压等指标均在正常范围时,ScvO2含量下降为患者组织灌注不足的临床表现[9]。唐慧京等[10]研究显示,A组患者治疗12 h时ScvO2明显高于B组。本次研究结果显示,研究组治疗后ScvO2为(85.1±3.4)%,明显高于参照组的(73.2±2.9)%,与唐慧京的研究结果基本一致。提示监测Pcv-aCO2可为液体复苏提供指导,有利于改善组织缺氧缺血状态,减轻心脏负荷,提高CI值,改善组织灌注[11]。通过监测Pcv-aCO2指导液体复苏,可明显缩短机械通气时间及ICU住院时间,降低液体平衡量,与王滨等[12]的研究结果基本一致。
综上所述,Pcv-aCO2可作为复苏效果的评价指标,监测Pcv-aCO2有利于降低液体平衡量,缩短机械通气时间及ICU住院时间,值得应用。

