温带针阔叶林土壤有机碳动态和微生物群落结构对有机氮添加的响应特征*
曹子铖程淑兰方华军†徐 梦耿 静卢明珠杨 艳李玉娜
温带针阔叶林土壤有机碳动态和微生物群落结构对有机氮添加的响应特征*
曹子铖1,2,程淑兰1,方华军1,2†,徐 梦2,耿 静2,卢明珠2,杨 艳2,李玉娜1
(1. 中国科学院大学资源与环境学院,北京 100049;2. 中国科学院地理科学与资源研究所,生态系统观测与模拟重点实验室,北京 100101)
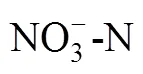
大气氮沉降;SOC物理分组;微生物群落组成;非线性响应;温带针阔混交林
陆地生态系统碳、氮循环过程紧密耦合在一起,分别反映了能量和养分的流动[1]。由于陆地生态系统生产力主要受氮素的限制,大气氮沉降输入会增加生态系统氮的可利用性,进而改变生态系统碳氮的转化速率[2]。在过去145年里(1860—2005),人类活动导致大气氮沉降增加了11.5倍[3]。中国是全球活性氮最大的产生国和排放国,1980—2010年中国的大气氮沉降量增加了60%,平均为21.1 kg· hm–2·a–1(以N计,下同)[4]。大气氮沉降升高会增加、降低或者不改变植物和土壤碳储量[5-7]。
森林是陆地生态系统的主要类型,有机碳储量占陆地生态系统碳储量的2/3,其中81%的有机碳储存在土壤中[8]。施氮对森林土壤有机碳(soil organic carbon,SOC)储量的影响有正有负,长期缓慢的大气氮沉降输入通过改变SOC的输入和输出以及土壤有机质(soil organic matter,SOM)稳定性,进而影响土壤碳的截存(C sequestration)。氮素富集条件下,受氮限制的森林SOC储量很大程度上取决于地上、地下植物残体碳的输入与含碳气体排放、液态淋溶之间的平衡。土壤氮素有效性的增加会导致土壤微生物活性和SOM可分解性的变化。一般而言,低剂量施氮倾向于促进贫氮森林植物生长和凋落物归还[9-10],增加根系自养呼吸[11]和土壤微生物活性[12];但是,长期高剂量施氮会显著抑制富氮森林土壤微生物活性和异养呼吸[13-14]。此外,氮添加倾向于提高C/N的SOM分解,相反会抑制低C/N的SOM分解[15]。因此,氮输入对土壤碳动态的差异性影响可能归因于森林对不同沉降氮形态响应的差异,也可能反映了特定森林土壤碳储量对土壤氮基质响应的多阶段性。氮素富集条件下土壤碳储量增加可能存在一个阈值,超过该阈值土壤碳储量不变甚至会降低。
作为SOM的重要保护机制,土壤团聚体通过形成复杂的土壤结构和限制微生物的接触来促进SOM的积累和稳定[16]。土壤团聚体(> 53 μm)通常较黏粉粒(< 53 μm)储存更多易分解的有机碳,而且微生物一般难以利用土壤团聚体内包裹的有机碳[17]。对不同森林生态系统而言,氮沉降增加会促进[18]、抑制[19]或不改变[20]SOC含量以及SOM的化学稳定性。此外,不同的微生物种群选择性地利用不同来源的有机碳[19]。因此,土壤易分解碳含量的增加有利于土壤团聚体形成,相应地会增加SOC的积累和稳定[21]。虽然科学家们已经认识到土壤碳库的数量、质量与微生物活性之间关系密切,但是鲜有研究揭示氮素富集条件下微生物丰度、群落组成与SOC动态之间的耦联关系。
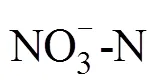
1 材料与方法
1.1 研究区概况
研究区位于中国科学院长白山森林生态系统研究站(图1),森林类型为林龄约200年的阔叶红松林。研究站位于长白山北坡国家自然保护区内,隶属于吉林省安图县二道白河镇(128°28′E,42°24′N)。研究区属于典型的温带大陆性气候,年均温3.6℃,多年平均降水量为745 mm[24],海拔736 m。土壤为发育于火山灰母质上的暗棕壤,0~20 cm表层土壤属性如下:土壤容重为0.53 g·cm–3,全碳为156.6 g·kg–1,全氮为7.17 g·kg–1,全磷为0.97 g·kg–1,pH为5.85,C/N为21.84[23]。
1.2 试验设计
2013年采用完全随机的方式构建了多水平的尿素添加控制试验,以评估生态系统碳、氮过程和碳平衡对有机氮沉降增加的非线性响应。参照长白山实际大气氮沉降速率(10.8 kg·hm–2·a–1)[25]和全国最高氮沉降水平(99 kg·hm–2·a–1)[26],设置了对照(CK,0 kg·hm–2·a–1)、低氮(LN,40 kg·hm–2·a–1)、中氮(MN,80 kg·hm–2·a–1)、高氮(HN,120 kg·hm–2·a–1)等4个施氮水平,每个处理4次重复,样方规格为10 m×10 m,相邻样方间隔至少1 m(图1)。在每个月的第一天,将固体尿素(分析纯,氮浓度为46%)称重并溶解在40 L水中,然后均匀地喷洒到对应的样方中,对照样方喷洒等体积的水,模拟未来大气有机氮沉降增加对温带针阔混交林生态系统碳、氮循环关键过程的影响。
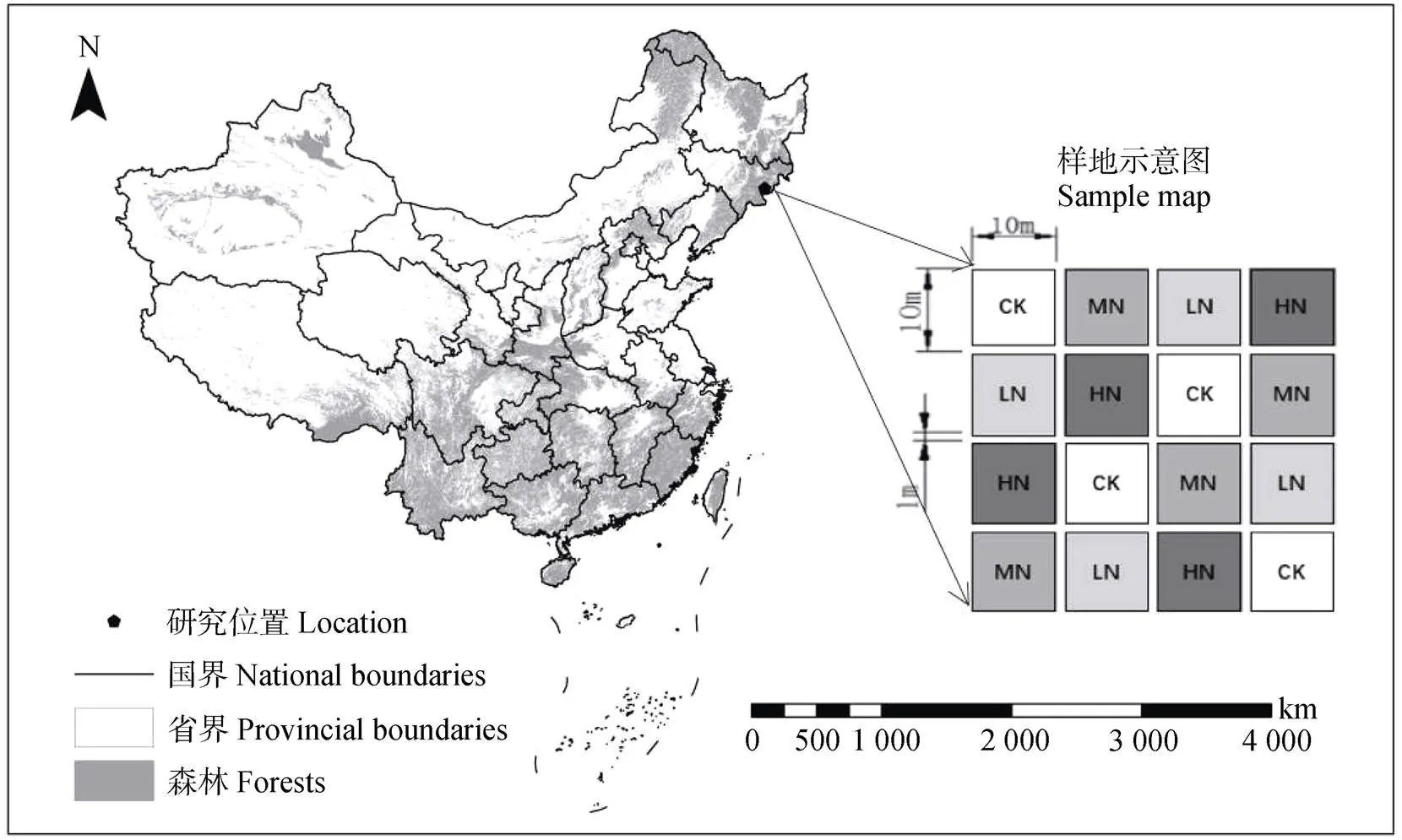
注:CK、LN、MN、HN分别代表对照、低氮、中氮、高氮处理。Note:CK,LN,MN,and HN are control,low,medium,and high rates of N addition treatments,respectively.
1.3 SOC物理分组和碳含量测定
对于每个试验样方,移除地表凋落物层,采集0~10 cm的矿质土壤,同层土壤5钻混合。土壤样品分别进行溶解性有机碳(DOC)、SOC粒径分组和水稳性团聚体分离。DOC测定步骤简述如下:过2 mm筛的新鲜土壤加入去离子水(土/水为1︰10 w/v),室温下振荡2 h后利用0.45 μm玻璃纤维滤膜过滤,浸提液利用TOC分析仪(Liqui TOCII,Elementar,Germany)测定DOC的浓度。
使用Cambardella和Elliott[27]介绍的方法进行SOC粒径分级。简言之,将50 g风干土和100 mL 1%六偏磷酸钠溶液混合于200 mL塑料瓶中,在回旋式振荡器上以200 r·min–1的速率振荡15 h,利用套筛回收粗颗粒态有机碳(CoarsePOC,>250 μm)和细颗粒态有机碳(FinePOC,53~250 μm),POC等于CoarsePOC和FinePOC之和。通过过滤、蒸发回收矿质结合态有机碳(MAOC,<53 μm)组分。将分离各组分在60℃下低温烘干、称重。
相同土样利用团聚体分析仪(Model SAA 8052,Shanghai,China)湿筛法分离水稳性团聚体[28]。将30 g土样置于250 μm和53 μm的套筛上,先在去离子水中浸泡5 min,然后以每分钟30次的频率上下振荡,振幅为3 cm,持续30 min。依次收集大团聚体(>250 μm)、微团聚体(53~250 μm)和粉黏粒(<53 μm),各组分在60℃下烘干称重。所有分离的颗粒组分研磨过100目筛,利用元素分析仪(vario EL III,Elementa,Germany)测定各组分碳浓度,再根据各组分的质量百分比计算出各组分的碳含量(g·kg–1)。
1.4 土壤微生物相对丰度与群落结构的测定
土壤微生物相对丰度与群落结构采用磷脂脂肪酸(PLFAs)的方法测定,主要包括浸提、分馏和定量等过程。首先,称取相当于8 g干土的新鲜土样,利用提取液(CH3OH︰CHCl3︰磷酸缓冲液= 2︰1︰0.8)反复浸提,随后将浸提液、12 mL三氯甲烷和12 mL磷酸缓冲液均倒入分液漏斗中,避光静置过夜。第二天萃取分离分液漏斗下层目标液体,将获取的磷脂脂肪酸进行甲基化处理,氮气吹干并排空氧气后封存于–80℃冰箱待测。利用气相色谱结合MIDI系统(Microbial ID. Inc.,Newark,DE)测定各个脂肪酸的相对含量,所用的参比是C20标准样品。
脂肪酸常用的命名格式为:︰(/),其中,为总碳数,后面跟一个冒号;表示双键数;表示甲基末端;是距离甲基端的距离;表示顺式,表示反式;和分别表示支链的反异构和异构;10Me表示一个甲基团在距分子末端第10个碳原子上;环丙烷脂肪酸用cy表示。用于指示细菌(B)群落相对量的磷脂脂肪酸有:i15︰0,a15︰0,15︰0,i16︰0,16︰1 ω5,16︰1 ω9,i17︰0,17︰0,18︰1 ω7,a17︰0,cy17︰0,cy19︰0[29-30]。用于指示真菌(F)群落相对量的磷脂脂肪酸有:18:2ω6c,18:3ω6c,18:3ω3c[29]。指示革兰氏阳性细菌(G+)的磷脂脂肪酸:i15︰0,a15︰0,i16︰0,a17︰0,i17︰0,而指示革兰氏阴性细菌(G-)的磷脂脂肪酸:16︰1 ω7c,cy17︰0和cy19︰0。好氧细菌(A)PLFAs采用16︰1ω7和18︰1ω7表示,而厌氧细菌(AN)PLFAs采用cy17︰0和cy19︰0表示。放线菌PLFA主要包括含侧链甲基的脂肪酸,如10Me18︰0,10Me16︰0,10Me17︰0,16Me18︰0;原生动物PLFA主要包括20︰3ω6,20︰4ω6[29-30]。此外,G+/G–、F/B以及A/AN用于反映微生物群落结构的变化。
1.5 土壤分析与测试
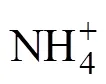
1.6 数据统计分析
利用单因素方差分析评估施氮剂量对土壤基本理化性质、土壤团聚体百分比、不同粒径SOC含量和微生物PLFA的影响,利用Tukey真正显著差法(honestly significant difference,HSD)检验不同处理均值之间的差异。利用线性回归分析方法评估SOC含量的净变化(ΔSOC)与SOC各组分净变化(ΔSOCi)之间的关系[31]。此外,利用Spearman等级相关分析方法研究SOC、SOC组分和微生物PLFA丰度之间的相关关系。所有统计分析基于SPSS软件包(16.0版)进行,显著性水平设置为=0.05。
2 结 果
2.1 土壤溶解性氮、含水量与pH
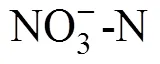
2.2 SOC含量及其组成
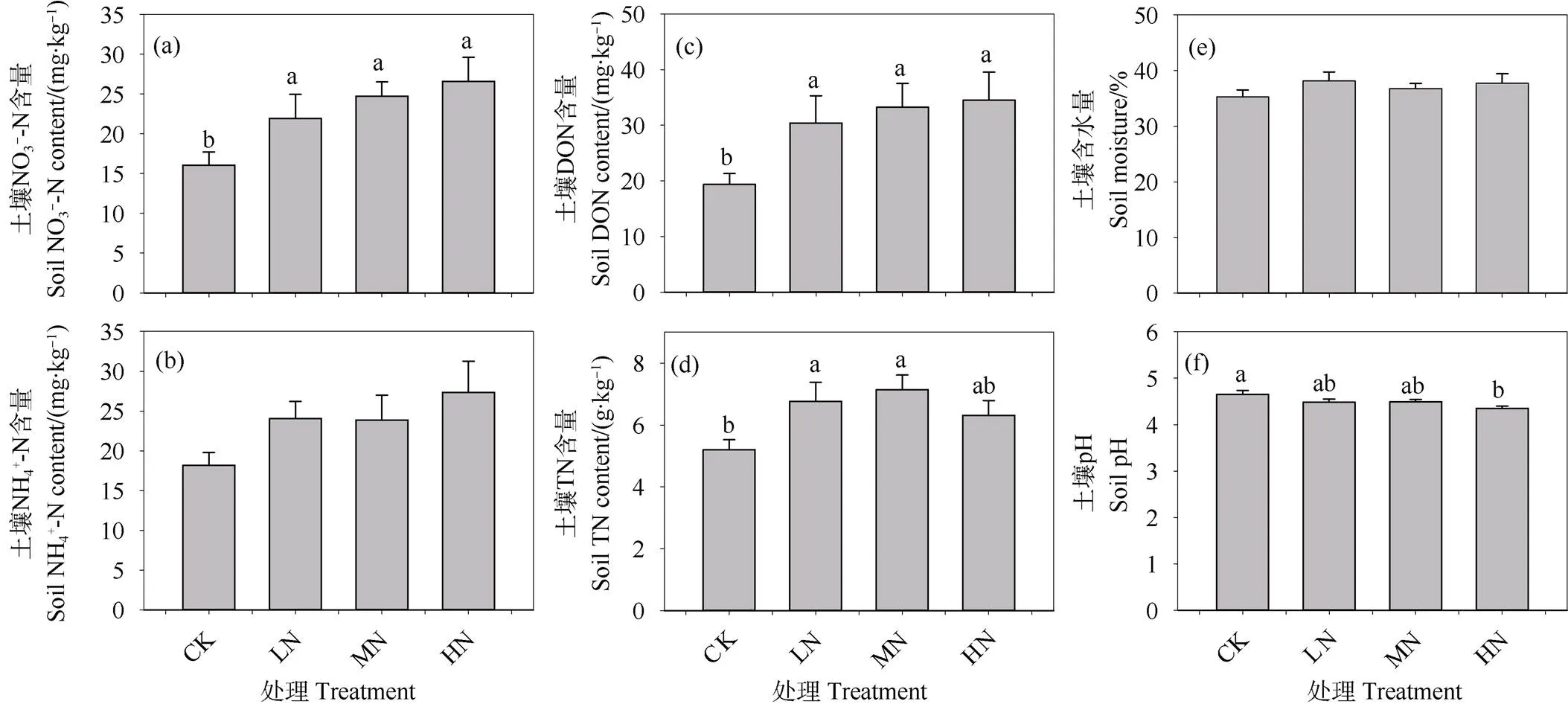
对照处理下,0~10 cm层矿质土壤SOC和DOC的含量分别为78.8 g·kg–1和672.1 mg·kg–1;施氮三年倾向于增加表层土壤SOC和DOC的含量,但是不同施氮处理与对照之间的差异均不显著(图3a~图3b)。对照处理下,粗颗粒态有机碳(CoarsePOC)、细颗粒态有机碳(FinePOC)、矿质结合态有机碳(MAOC)含量依次为20.18 g·kg–1、8.94 g·kg–1和56.27 g·kg–1,分别占总SOC含量的23.63%、10.47%和65.90%,SOC以MAOC为主(图3c~图3e)。土壤粗、细颗粒态有机碳含量随着施氮剂量的增加先增加后降低,中氮处理显著导致土壤粗、细颗粒态有机碳含量增加了96.26%和84.69%,氮沉降临界负荷为80 kg·hm–2·a–1(图3c~图3d)。不同试验处理下表层土壤MAOC含量差异不显著(图3e)。
2.3 土壤团聚体比例及其结合态有机碳含量
对照处理样方大团聚体、微团聚体和粉黏粒比例相当,三个组分的百分比依次为33.41%,30.66%和35.93%(图4a~图4c)。与对照相比,施氮三年倾向于增加表层土壤大团聚体(>250 μm)和微团聚体(53~250 μm)比例,但是只有中氮、高氮处理样方土壤微团聚体比例增加显著,增幅分别为8.45%和9.13%(图4b)。相反,施氮倾向于降低粉黏粒的比例,中氮、高氮处理导致土壤粉黏粒的比例减少了19.57%和21.34%(图4c)。施氮三年倾向于增加大团聚体和微团聚体结合态有机碳(Macroaggregate-C和Microaggregate-C)含量,Macroaggregate-C增幅为37.25%~42.76%,Microaggregate-C增幅介于27.45%~43.99%之间;但对粉黏粒结合态有机碳(Silt+clay-C)含量无影响(图4d~图4f)。此外,氮素富集条件下,土壤Macroaggregate-C和Microaggregate-C含量增幅随着施氮剂量的增加先增加后降低,临界氮沉降负荷也为80 kg·hm–2·a–1(图4d~图4f)。
注:不同小写字母表示处理间差异显著.下同。Note:Different lowercase letters mean significant differences between treatments. The same below.
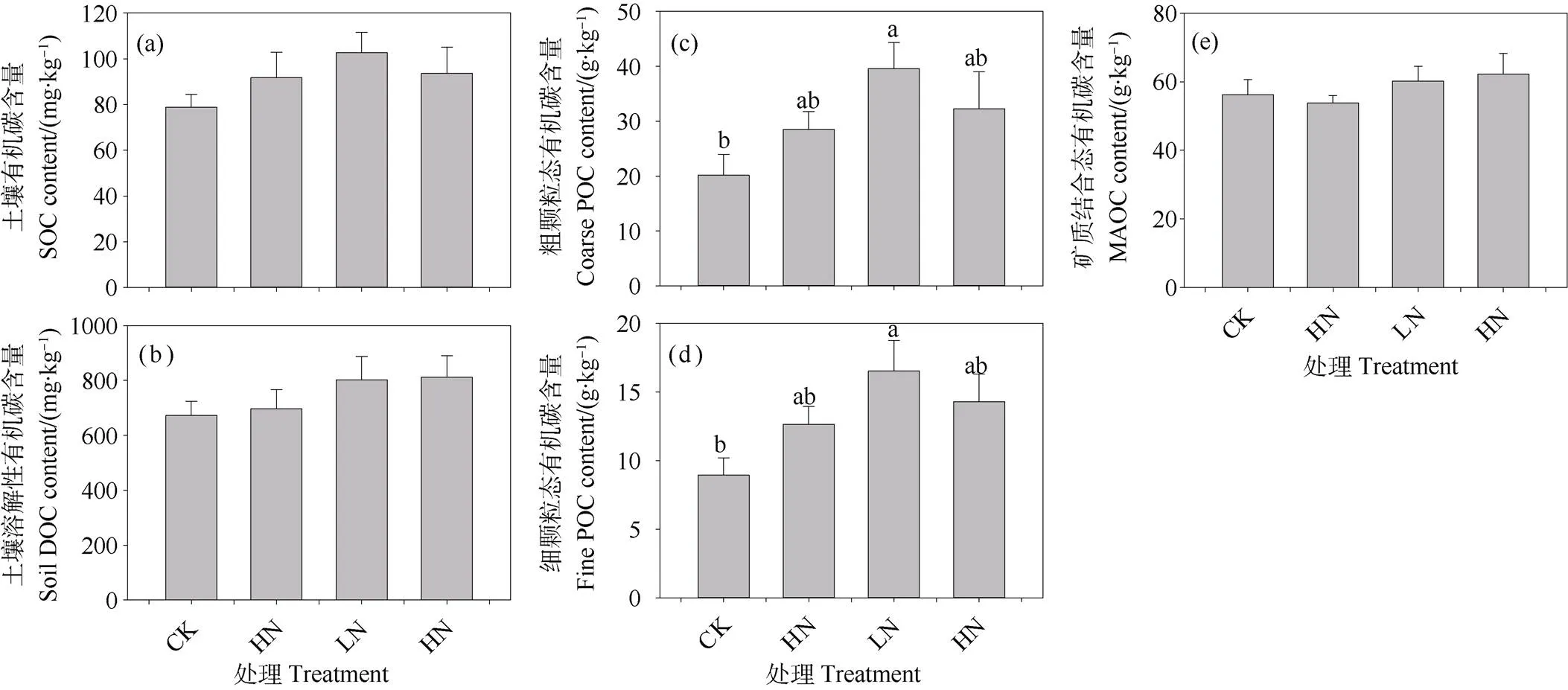
图3 不同施氮水平下0~10 cm矿质层SOC和不同组分含量的差异
图4 不同施氮水平下0~10 cm矿质层土壤团聚体百分比及其结合态有机碳含量的差异
2.4 土壤微生物丰度和群落结构
除了好氧细菌PLFA丰度外,施氮三年未显著改变土壤微生物总PLFA和单个种群PLFA的相对丰度(图5a~图5i),高氮处理导致好氧细菌PLFA丰度显著降低17.55%(图5h)。此外,施氮显著改变土壤微生物群落结构。随着施氮剂量的增加,真菌与细菌PLFA比例(F/B)和G+与G–细菌PLFA(G+/G–)比例倾向于增加,而好氧与厌氧细菌PLFA的比例(A/AN)倾向于下降(图5j~图5l)。
2.5 SOC变化和SOC组分变化之间的关系
氮素富集条件下,SOC含量的净变化(ΔSOC)与大团聚体及微团聚体结合态有机碳含量的净变化(ΔMacroaggregate-C和ΔMicroaggregate-C)之间呈现显著的正相关关系,两者分别解释其变异的88%和78%(图6a~图6b)。相似地,氮素富集条件下,ΔSOC与粗颗粒态有机碳、细颗粒态有机碳含量的净变化(ΔCoarsePOC和ΔFinePOC)之间呈显著的正相关关系,两者分别解释其变异的49%和55%(图6a~图6b)。然而,ΔSOC与粉黏粒结合态有机碳、矿质结合态有机碳含量的净变化(ΔSilt+clay-C和ΔMAOC)之间相关性不显著。研究结果表明,氮素富集条件下短期内SOC含量的变化主要体现在活性组分而非惰性SOC组分。
2.6 团聚体比例、SOC与微生物群落之间的相关关系
大团聚体比例与细菌、G+细菌、厌氧细菌、真菌丰度以及真菌/细菌比例(F/B)显著正相关,与好氧/厌氧菌丰度比例(A/AN)显著负相关,而粉黏粒比例恰好相反;微团聚体比例只与G+/G–比例负相关(表1)。粗、细颗粒态有机碳含量只与厌氧微生物丰度正相关,细颗粒态有机碳与A/AN比例负相关,矿质结合态有机碳与微生物种群丰度、群落结构相关性不显著(表1)。
3 讨 论
3.1 施氮对温带针阔混交林土壤碳、氮累积的影响
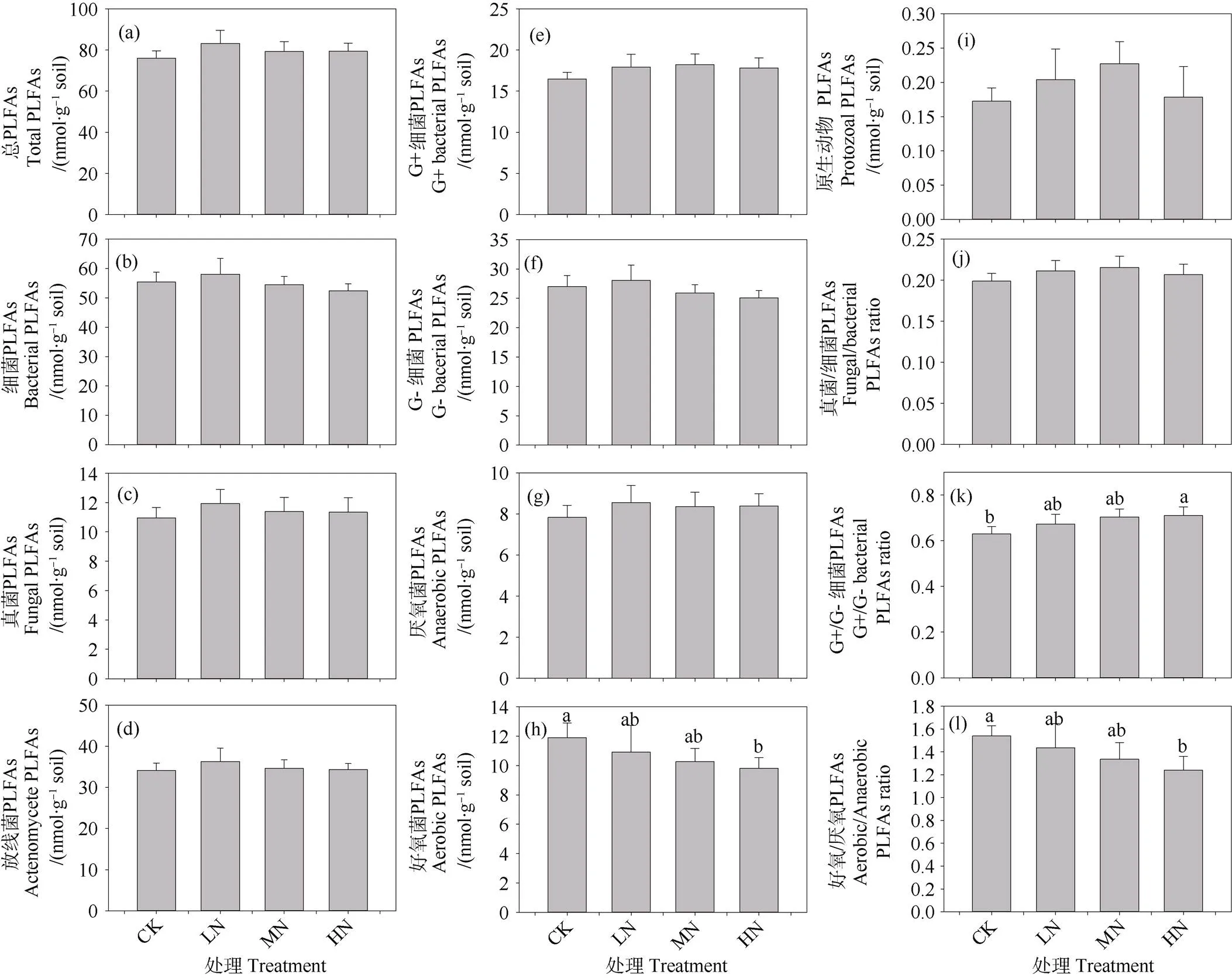
图5 不同施氮水平下0~10 cm矿质层土壤微生物PLFA丰度和群落结构的变化

图6 SOC含量净变化与SOC不同组分含量净变化之间的关系
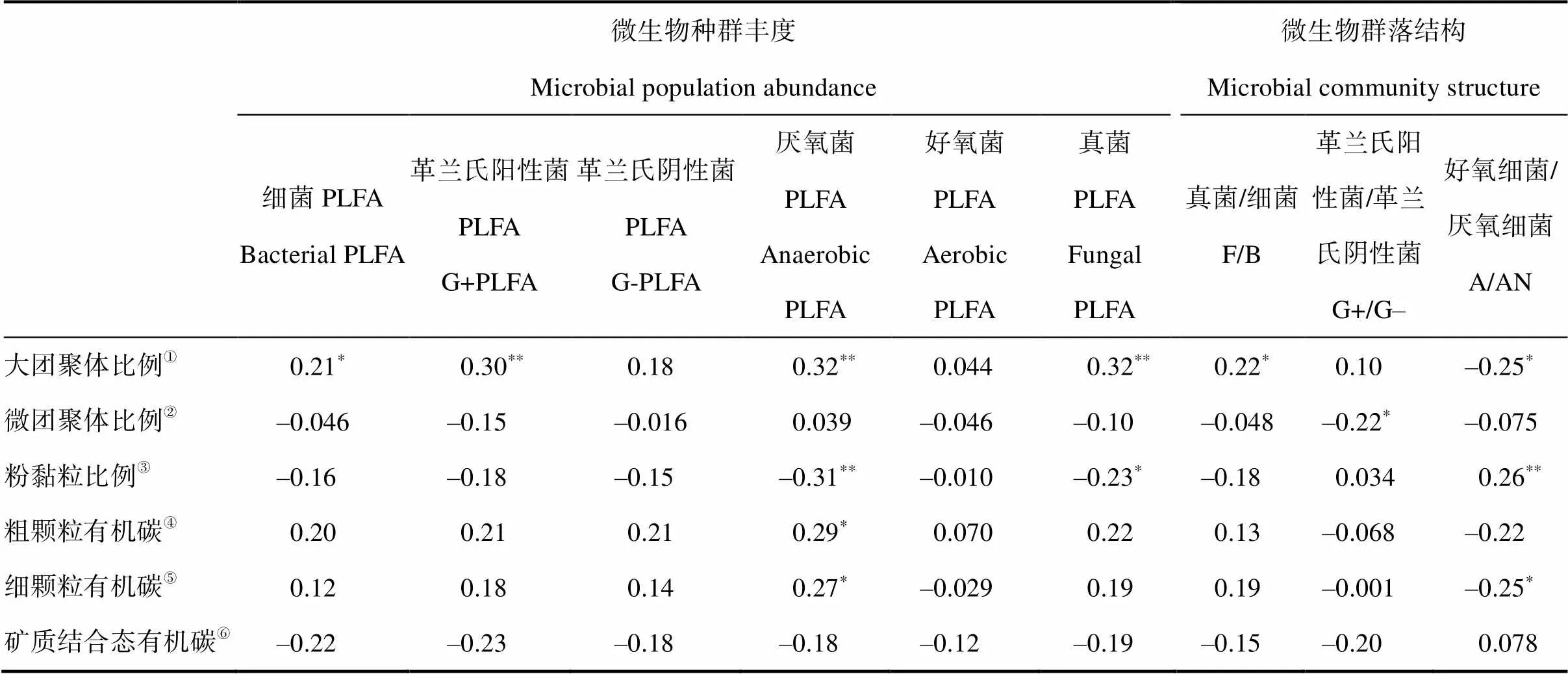
表1 团聚体比例、颗粒态有机碳含量与微生物种群丰度及群落结构之间的相关关系
①Proportion of macroaggregate;②Proportion of microaggregate;③Proportion of silt and clay;④Concentration of coarse POC;⑤Concentration of finePOC;⑥Concentration of MAOC
本研究中,由于没有测定每个样方的土壤容重,因此评估的是土壤碳含量而不是土壤碳储量。连续三年施氮未显著增加0~10 cm矿质层土壤总SOC、DOC和MAOC的含量,但是显著促进了同层土壤粗、细颗粒态碳的累积。研究结果表明,施氮促进了来源于植物碎屑的易分解碳组分的累积,这与氮输入促进植物生长以及凋落物归还的结论相一致[35]。CoarsePOC和FinePOC对氮添加水平的响应呈现先增加后降低的格局,证实了笔者的假设,即来自植物残体碎屑的活性SOC组分对外源性氮添加水平的响应呈现非线性。由于不同试验处理样方土壤颗粒态有机质所占比例平均低于25%,因此大气氮沉降输入对东北地区温带针阔混交林土壤碳截存的影响可能较小。基于全球增氮控制实验数据的集成(Meta)分析,无论是否将农田生态系统考虑在内,氮沉降/施氮不会显著增加矿质土壤SOC的储量[37-38]。氮素富集条件下,地上植物碳库增加会引起土壤碳库产生正的激发效应[12],以及地下植物碳分配的大幅减少[7],可能导致矿质层SOC库没有发生明显累积。在长白山温带针阔混交林区,Wang等[36]报道施氮(50 kg·hm–2·a–1)显著降低了0~20 cm层细根生物量,并且增加了细根生产量和周转速率,表明高氮输入加速了地下的碳循环过程。
粉黏粒组分比例减少与大团聚体、微团聚体组分比例增加是相对应的(图4a~图4c),相应地本研究发现土壤大团聚体和微团聚体结合态碳含量显著增加(图4d~图4e)。上述研究结果表明,活性SOC组分积累会促进土壤从粉黏粒向土壤团聚体的转变,这与许多施氮试验结果一致[37-38]。在氮素富集条件下,团聚体结合态有机碳含量的变化可以解释SOC含量变化的80%(图6a~图6b),表明新形成、半分解的SOC主要累积在大团聚体和微团聚体中,而长白山温带针阔混交老龄林土壤与粉黏粒相结合的SOC可能达到其饱和能力,惰性碳增加潜力有限[39-40]。相似地,一些研究表明,施加无机氮肥增加大、微团聚体结合态有机碳含量,尤其是大团聚体中碳积累显著[41-42];大部分来源于植物残体的有机碳更倾向于固定在微团聚体中[43]。氮素富集条件下,土壤碳截存的潜在机制如下:易分解有机碳含量增加可能会减少土壤孔隙的连通性,增加土壤的持水能力,进而减少了土壤中氧气的有效扩散系数,反过来会降低土壤空气中的氧气浓度,促进厌氧微生境的形成[39]。
3.2 氮素富集条件下SOC积累的微生物学机制
施氮对温带针阔混交林土壤微生物生物量的影响不尽相同,有促进[44]、抑制[45]和无显著影响[46]。除了研究区的环境条件和土壤特性外,SOM似乎控制着土壤微生物生物量的变化。在本研究中,土壤活性有机碳含量(POC和aggregate-C)以及总PLFA对施氮剂量的响应一致(图3~图5),研究结果一定程度上证实了笔者的假设,表明土壤微生物丰度主要取决于活性有机碳而非总SOC的数量。然而,在氮素富集条件下活性有机碳含量所占比例较小,其数量的小幅度增加可能难以支持微生物的大量生长[47]。同样,高剂量的氮输入短期内就可以改变长白山温带针阔混交林土壤部分微生物种群的相对丰度和群落结构。
真菌PLFA的相对丰度、F/B比对施氮剂量的响应与SOC、团聚体结合态有机碳含量一致(图4~图5),反映了真菌在稳定土壤团聚体方面起着至关重要的作用。真菌菌丝将土壤颗粒胶结在一起,形成稳定的团聚体,有助于增加水分渗透和土壤的持水能力[48]。鉴于G+细菌生长依赖于相对活性的有机碳[49],然而由于活性有机碳数量比例较低,导致氮素富集条件下G+细菌PLFA的丰度增加并不显著,但是G+/G–增幅明显。此外,大团聚体比例和活性有机碳组分(CoarsePOC和FinePOC)与厌氧菌PLFAs呈显著的正相关关系,而与好氧/厌氧菌PLFA丰度比(A/AN)呈负相关关系,表明大团聚体的形成有利于厌氧微生境的形成[49]。由于好氧细菌较厌氧细菌更加有效地分解有机碳[50],微生物群落组成的优势种群从好氧细菌向兼性或专性厌氧细菌的演变可能会改变长白山温带森林SOC的积累过程[51]。然而,由于PLFA方法的局限性,本研究测定的微生物群落结构精度较粗,未来的研究应该基于DNA/RNA的聚合酶链扩增(PCR)和高通量测序,深入分析氮素富集情景下土壤微生物群落组成及其转变。
4 结 论
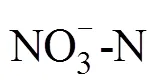
[1] Thornton P E,Doney S C,Lindsay K,et al. Carbon-nitrogen interactions regulate climate-carbon cycle feedbacks:Results from an atmosphere-ocean general circulation model[J]. Biogeosciences,2009,6(10):2099—2120.
[2] LeBauer D S,Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed[J]. Ecology,2008,89(2):371—379.
[3] Galloway J N,Dentener F J,Marmer E,et al. The environmental reach of Asia[J]. Annual Review of Environment and Resources,2008,33(1):461—481.
[4] Liu X J,Zhang Y,Han W X,et al. Enhanced nitrogen deposition over China[J]. Nature,2013,494(7438):459—462.
[5] Liu L L,Greaver T L. A global perspective on belowground carbon dynamics under nitrogen enrichment[J]. Ecology Letters,2010,13(7):819—828.
[6] Lu M,Zhou X H,Luo Y Q,et al. Minor stimulation of soil carbon storage by nitrogen addition:A meta- analysis[J]. Agriculture,Ecosystems & Environment,2011,140(1/2):234—244.
[7] Chen H,Li D J,Gurmesa G A,et al. Effects of nitrogen deposition on carbon cycle in terrestrial ecosystems of China:A meta-analysis[J]. Environmental Pollution,2015,206:352—360.
[8] Lal R. Forest soils and carbon sequestration[J]. Forest Ecology and Management,2005,220(1/3):242—258.
[9] Hyvönen R,Persson T,Andersson S,et al. Impact of long-term nitrogen addition on carbon stocks in trees and soils in northern Europe[J]. Biogeochemistry,2008,89(1):121—137.
[10] Quinn Thomas R,Canham C D,Weathers K C,et al. Increased tree carbon storage in response to nitrogen deposition in the US[J]. Nature Geoscience,2010,3(1):13—17.
[11] Kou L,Guo D L,Yang H,et al. Growth,morphological traits and mycorrhizal colonization of fine roots respond differently to nitrogen addition in a slash pine plantation in subtropical China[J]. Plant and Soil,2015,391(1/2):207—218.
[12] Wang Y S,Cheng S L,Fang H J,et al. Contrasting effects of ammonium and nitrate inputs on soil CO2emission in a subtropical coniferous plantation of Southern China[J]. Biology and Fertility of Soils,2015,51(7):815—825.
[13] Burton A J,Pregitzer K S,Crawford J N,et al. Simulated chronic NO3–deposition reduces soil respiration in northern hardwood forests[J]. Global Change Biology,2004,10(7):1080—1091.
[14] DeForest J L,Zak D R,Pregitzer K S,et al. Atmospheric nitrate deposition,microbial community composition,and enzyme activity in northern hardwood forests[J]. Soil Science Society of America Journal,2004,68(1):132—138.
[15] Smith A P,Marín-Spiotta E,de Graaff M A,et al. Microbial community structure varies across soil organic matter aggregate pools during tropical land cover change[J]. Soil Biology and Biochemistry,2014,77:292—303.
[16] Bossuyt H,Six J,Hendrix P F. Protection of soil carbon by microaggregates within earthworm casts[J]. Soil Biology and Biochemistry,2005,37(2):251—258.
[17] Pregitzer K S,Burton A J,Zak D R,et al. Simulated chronic nitrogen deposition increases carbon storage in Northern Temperate forests[J]. Global Change Biology,2008,14(1):142—153.
[18] Fang H J,Cheng S L,Yu G R,et al. Nitrogen deposition impacts on the amount and stability of soil organic matter in an alpine meadow ecosystem depend on the form and rate of applied nitrogen[J]. European Journal of Soil Science,2014,65(4):510—519.
[19] Zhong X L,Li J T,Li X J,et al. Physical protection by soil aggregates stabilizes soil organic carbon under simulated N deposition in a subtropical forest of China[J]. Geoderma,2017,285:323—332.
[20] Balesdent J,Chenu C,Balabane M. Relationship of soil organic matter dynamics to physical protection and tillage[J]. Soil and Tillage Research,2000,53(3/4):215—230.
[21] Geng J,Cheng S L,Fang H J,et al. Soil nitrate accumulation explains the nonlinear responses of soil CO2and CH4fluxes to nitrogen addition in a temperate needle-broadleaved mixed forest[J]. Ecological Indicators,2017,79:28—36.
[22] Wang Y Y,Hsu P K,Tsay Y F. Uptake,allocation and signaling of nitrate[J]. Trends in Plant Science,2012,17(8):458—467.
[23] Cheng S L,Fang H J,Yu G R,et al. Foliar and soil 15N natural abundances provide field evidence on nitrogen dynamics in temperate and boreal forest ecosystems[J]. Plant and Soil,2010,337(1/2):285—297.
[24] Zhu J X,He N P,Wang Q F,et al. The composition,spatial patterns,and influencing factors of atmospheric wet nitrogen deposition in Chinese terrestrial ecosystems[J]. Science of the Total Environment,2015,511:777—785.
[25] He C E,Liu X J,Fangmeier A,et al. Quantifying the total airborne nitrogen input into agroecosystems in the North China Plain[J]. Agriculture,Ecosystems & Environment,2007,121(4):395—400.
[26] Cambardella C A,Elliott E T. Particulate soil organic-matter changes across a grassland cultivation sequence[J]. Soil Science Society of America Journal,1992,56(3):777—783.
[27] Six J,Paustian K,Elliott E T,et al. Soil structure and organic matter I. distribution of aggregate-size classes and aggregate-associated carbon[J]. Soil Science Society of America Journal,2000,64(2):681—689.
[28] Bossio D A,Scow K M. Impacts of carbon and flooding on soil microbial communities:Phospholipid fatty acid profiles and substrate utilization patterns[J]. Microbial Ecology,1998,35(3):265—278.
[29] Frostegard A,Baath E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils,1996,32(1/2):59—65.
[30] Frostegård,Bååth E,Tunlio A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J]. Soil Biology and Biochemistry,1993,25(6):723—730.
[31] Hoerl A E,Kennard R W. Ridge regression:Biased estimation for nonorthogonal problems[J]. Technometrics,2000,42(1):80—86.
[32] Xu X K,Han L,Luo X B,et al. Effects of nitrogen addition on Dissolved N2O and CO2,Dissolved organic matter,and inorganic nitrogen in soil solution under a temperate old-growth forest[J]. Geoderma,2009,151(3/4):370—377.
[33] Kuzyakov Y,Xu X L. Competition between roots and microorganisms for nitrogen:Mechanisms and ecological relevance[J]. New Phytologist,2013,198(3):656—669.
[34] Gao W L,Kou L,Zhang J B,et al. Ammonium fertilization causes a decoupling of ammonium cycling in a boreal forest[J]. Soil Biology and Biochemistry,2016,101:114—123.
[35] Wei H X,Xu C Y,Ma L Y,et al. Short-term Nitrogen (N)-retranslocation within larix olgensis seedlings is driven to increase by N-deposition:Evidence from a simulated N-15 experiment in northeast China[J]. International Journal of Agriculture and Biology,2014,16(6):1031—1040.
[36] Wang Y Y,Hsu P K,Tsay Y F. Uptake,allocation and signaling of nitrate[J]. Trends in Plant Science,2012,17(8):458—467.
[37] Yu H Y,Ding W X,Luo J F,et al. Effects of long-term compost and fertilizer application on stability of aggregate-associated organic carbon in an intensively cultivated sandy loam soil[J]. Biology and Fertility of Soils,2012,48(3):325—336.
[38] Zhang W,Mo J M,Zhou G Y,et al. Methane uptake responses to nitrogen deposition in three tropical forests in Southern China[J]. Journal of Geophysical Research Atmospheres,2008,113(D11):D11116. DOI:10.1029/ 2007jd009195.
[39] Six J,Conant R T,Paul E A,et al. Stabilization mechanisms of soil organic matter:Implications for C-saturation of soils[J]. Plant and Soil,2002,241(2):155—176.
[40] Gulde S,Chung H,Amelung W,et al. Soil carbon saturation controls labile and stable carbon pool dynamics[J]. Soil Science Society of America Journal,2008,72(3):605—612.
[41] Tripathi S K,Kushwaha C P,Singh K P. Tropical forest and savanna ecosystems show differential impact of N and P additions on soil organic matter and aggregate structure[J]. Global Change Biology,2008,14(11):2572—2581.
[42] Kong A Y Y,Six J,Bryant D C,et al. The relationship between carbon input,aggregation,and soil organic carbon stabilization in sustainable cropping systems[J]. Soil Science Society of America Journal,2005,69(4):1078—1085.
[43] Li Y Q,Xu M,Zou X M. Effects of nutrient additions on ecosystem carbon cycle in atoRican tropical wet forest[J]. Global Change Biology,2006,12(2):284—293.
[44] DeForest J L,Zak D R,Pregitzer K S,et al. Atmospheric nitrate deposition,microbial community composition,and enzyme activity in northern hardwood forests[J]. Soil Science Society of America Journal,2004,68(1):132—138.
[45] Davidson E A,de Carvalho C J R,Vieira I G C,et al. Nitrogen and phosphorus limitation of biomass growth in a tropical secondary forest[J]. Ecological Applications,2004,14(4):150—163.
[46] Hill P W,Farrar J F,Jones D L. Decoupling of microbial glucose uptake and mineralization in soil[J]. Soil Biology and Biochemistry,2008,40(3):616—624.
[47] Tisdall J M. Fungal hyphae and structural stability of soil[J]. Soil Research,1991,29(6):729—743.
[48] Peacock A D,Mullen M D,Ringelberg D B,et al. Soil microbial community responses to dairy manure or ammonium nitrate applications[J]. Soil Biology and Biochemistry,2001,33(7/8):1011—1019.
[49] Wixon D L,Balser T C. Toward conceptual clarity:PLFA in warmed soils[J]. Soil Biology and Biochemistry,2013,57:769—774.
[50] Ding H B,Sun M Y. Biochemical degradation of algal fatty acids in oxic and anoxic sediment-seawater interface systems:Effects of structural association and relative roles of aerobic and anaerobic bacteria[J]. Marine Chemistry,2005,93(1):1—19.
[51] Pregitzer K S,Burton A J,Zak D R,et al. Simulated chronic nitrogen deposition increases carbon storage in Northern Temperate forests[J]. Global Change Biology,2008,14(1):142—153.
Responses of Soil Organic Carbon Dynamics and Microbial Community Structure to Organic Nitrogen Fertilization in the Temperate Needle-broadleaved Mixed Forest
CAO Zicheng1, 2, CHENG Shulan1, FANG Huajun1, 2†, XU Meng2, GENG Jing2, LU Mingzhu2, YANG Yan2, LI Yuna1
( 1. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049, China; 2. Key Laboratory of Ecosystem Network Observation and Modeling, Institute of Geographical Sciences and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101, China)
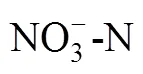
Atmospheric nitrogen deposition; SOC physical fractionation; Microbial community composition; Nonlinear response; Temperate needle-broadleaved mixed forest
Q154
A
10.11766/trxb201908130350
曹子铖,程淑兰,方华军,徐梦,耿静,卢明珠,杨艳,李玉娜. 温带针阔叶林土壤有机碳动态和微生物群落结构对有机氮添加的响应特征[J]. 土壤学报,2020,57(4):963–974.
CAO Zicheng,CHENG Shulan,FANG Huajun,XU Meng,GENG Jing,LU Mingzhu,YANG Yan,LI Yuna. Responses of Soil Organic Carbon Dynamics and Microbial Community Structure to Organic Nitrogen Fertilization in the Temperate Needle-broadleaved Mixed Forest[J]. Acta Pedologica Sinica,2020,57(4):963–974.
* 国家自然科学基金项目(31770558,41977041,41907036)和中国科学院战略先导专项(XDA2002040203,XDA23060401)资助Supported by the National Natural Science Foundation of China(Nos. 31770558,41977041,41907036)and CAS Strategic Priority Program(Nos. XDA2002040203,XDA23060401)
,E-mail:fanghj@igsnrr.ac.cn
曹子铖(1995—),男,河南郑州人,硕士研究生,主要从事土壤碳氮生物地球化学研究。E-mail:448650877@qq.com
2019–07–07;
2019–09–18;
2019–11–13
(责任编辑:檀满枝)

