ZVI/Cu双金属活化双氧水降解甲基橙
马国峰, 刘钰龙, 马 澜
(1. 沈阳大学 a. 辽宁省先进材料制备技术重点实验室, b. 科技创新研究院, 辽宁 沈阳 110044; 2. 沈阳市规划设计院, 辽宁 沈阳 110004)
造纸、纺织和化妆品等行业的生产废水中含有大量的偶氮染料[1],很多具有很强的毒性,对环境存在巨大危害,也对人类的身体健康存在着潜在的隐患.因偶氮染料其偶氮基所连接的芳香基分子结构比较复杂,所以难以降解[2].目前主要有物理法(吸附法、絮凝法等)、化学法(氧化法、还原法等)、生物法(生物、微生物法等)等处理含有偶氮染料废水的方法[3],但也存在着效果不佳、成本高以及二次污染等缺点[4].
目前,零价铁(ZVI)因其所具备的绿色、廉价和易于回收的优点,及相对于普通铁粉,具有活性更强的特点,已作为环境修复材料被广泛应用于去除水中的污染物[5-7].其原理是零价铁作为催化剂活化强氧化剂双氧水产生羟基自由基(·OH),因其极高的氧化电位[8],具有高反应活性与强的氧化能力,可以与绝大多数的有机污染物发生快速的链式反应,从而将有害物质氧化为CO2、H2O或其他无害的矿物盐[9].
ZVI/Cu双金属是以零价铁为基础改进的一种双金属催化剂,以达到改善零价铁催化剂反应性的目的[10-11].在ZVI表面沉积一层过渡金属Cu,可有效提高其反应活性,一方面过渡金属有助于产生吸附在双金属催化剂上的活化原子氢,并通过形成原电池增强ZVI的氧化,另一方面在过渡金属表面上形成的原子氢可使有机污染物的还原性降解增强[12-13].
本试验以m(ZVI)∶m(Cu)=10∶1制备了ZVI/Cu双金属,此双金属催化剂具有较好的均匀性.以具有复杂偶氮结构的甲基橙作为目标对象,探讨ZVI/Cu双金属催化剂对于H2O2的活化性能,考察了各影响因素对于ZVI/Cu双金属催化剂活化H2O2降解甲基橙的影响,为探索含有偶氮染料的废水处理提供理论依据.
1 试 验
1.1 试验药品与器材
本试验所用药品试剂均为分析纯.从天津市恒兴化学试剂制造有限公司购得ZVI 颗粒(平均粒径为120 μm,铁质量分数约为98%);天津博迪化工股份有限公司购得CuSO4、H2O2(质量分数为30%);国药集团化学试剂有限公司购得甲基橙;天津市富宇精细化工有限公司购得无水乙醇;天津市科密欧试剂有限公司购得HCl(质量分数为38%)和NaOH.
试验所用仪器:60目(孔径0.3 mm)检验筛;电子分析天平;PHS-25 pH计;JJ-1电动搅拌器;陶瓷坩埚;干燥箱;恒温水浴锅;Lambda 750S型紫外-可见分光光度计;带有X射线能量色散光谱(EDS)分析仪的扫描电子显微镜(SEM,日立S-4800);X射线衍射(XRD,日本理学D/max-2500PC型).
1.2 方 法
配置200 mL质量浓度为12.5 g·L-1的CuSO4溶液,并使用浓度为1 mol·L-1的HCl溶液将CuSO4溶液pH值调为4.6,向溶液中加入10 g已过60目(0.3 mm)检验筛的ZVI颗粒,使用JJ-1电动搅拌器对CuSO4溶液以400 r·min-1连续搅拌30 min,搅拌后沉淀5 min,分离出ZVI/Cu双金属,并用去离子水冲洗3次,无水乙醇冲洗1次,在干燥箱中100 ℃干燥2 h,即制备了m(ZVI)∶m(Cu)=10∶1的ZVI/Cu双金属催化剂[14].置换反应方程式为

(1)
取50 mg·L-1的甲基橙溶液100 mL于烧杯中,将烧杯置于恒温水浴锅中预热至试验所需温度,调溶液pH值,先加入ZVI/Cu双金属,再加入H2O2,在设定的时间点(0~60 min)取样,采用Lambda 750S型紫外-可见分光光度计,以蒸馏水作为参照进行波长和吸光度检测,同一组实验重复2次取平均值.于λ=464 nm处测定样品的吸光度,通过公式计算其去除率为
x=(c0-ct)/c0×100%.
(2)
式中:x为甲基橙去除率,%;c0和ct分别为反应初始时刻和t时刻甲基橙的浓度,mmol·L-1.
2 结果与讨论
2.1 ZVI/Cu双金属结构表征
为了探究ZVI/Cu双金属活化H2O2生成·OH机制,对制备所得的ZVI/Cu双金属进行了SEM和XRD表征.图1为ZVI/Cu双金属的SEM图和EDS能谱图,可以看到,ZVI/Cu双金属由大小不一的颗粒组成,SEM图中任选一点的EDS图显示,ZVI/Cu双金属中主要含Cu和Fe这2种元素,根据EDS图给出的数据可知,Fe质量分数为3.06%,Cu质量分数为83.51%.

(a) ZVI/Cu双金属放大6000倍的SEM图(b) ZVI/Cu双金属放大12000倍的SEM图(c) ZVI/Cu双金属的EDS图
为进一步表征ZVI/Cu双金属的微观结构,图2为ZVI/Cu双金属的XRD图谱,可以看出ZVI/Cu双金属由Fe、Cu和Fe3O4构成.

图2 ZVI/Cu双金属的XRD图谱Fig.2 XRD pattern of ZVI/Cu bimetallic catalyst
2.2 ZVI/Cu双金属活化H2O2降解甲基橙的机制
ZVI/Cu双金属催化剂在水溶液中活化H2O2产生的·OH是由铁的溶解引起的.ZVI通过化学腐蚀为体系提供了电子(反应(3)).在含氧溶液中,ZVI在酸性条件下腐蚀,除Fe2+外,还会生成过氧化氢(反应(4)).生成的H2O2与Fe2+发生反应,生成高活性的·OH (芬顿反应,反应(5)).ZVI在缺氧条件下的腐蚀表现为反应(6).Fe3+通过类芬顿反应(反应(7))和反应(8)再生Fe2+.

(3)

(4)
为比较ZVI、Cu和ZVI/Cu活化H2O2的降解甲基橙的能力,选取质量浓度为50 mg·L-1的甲基橙溶液100 mL,在温度为30 ℃、pH值为4的条件下,分别向3 g·L-1ZVI、Cu和ZVI/Cu双金属中加入2.0 mmol·L-1的H2O2进行对比试验,结果如图3所示.

图3 ZVI、Cu和ZVI/Cu双金属活化H2O2降解甲基橙的去除率随时间的变化
图3为ZVI、Cu和ZVI/Cu双金属活化H2O2降解甲基橙的去除率对比图,由图3可知,反应60 min ZVI、Cu和ZVI/Cu双金属活化H2O2降解甲基橙的去除率分别为41.2%、30.8%和78.6%.单独添加ZVI和Cu对甲基橙的降解无法达到一个很好的效果,但由于其过渡金属的还原性也起到了对甲基橙一定的降解作用[15].与之相比,ZVI/Cu双金属降解甲基橙的去除率较高,这是由于在ZVI上镀上一层过渡金属Cu有效提升了ZVI对H2O2的活化能力.Cu有助于产生吸附在双金属催化剂上的活化原子氢,并通过与ZVI形成原电池增强ZVI的氧化,并且在过渡金属表面上形成的原子氢可以增强有机污染物的还原性降解能力[16-17].
2.3 ZVI/Cu双金属投加量对活化H2O2降解甲基橙的影响
为探究ZVI/Cu双金属的投加量对甲基橙降解实验的影响,取质量浓度为50 mg·L-1的甲基橙溶液100 mL,在H2O2浓度为2 mmol·L-1、pH值为4的条件下,考察ZVI/Cu双金属的投加量在0~8 g·L-1变化时甲基橙的降解情况,如图4所示.

图4 ZVI/Cu双金属不同投加量对活化H2O2降解甲基橙的去除率随时间的变化
图4表示了ZVI/Cu双金属不同投加量对甲基橙的去除率的影响,如图所示,当不添加ZVI/Cu双金属,仅添加H2O2时对甲基橙的去除率是很低的,随着ZVI/Cu双金属投加量的增加,对甲基橙的去除率也随之增加.添加1~8 g·L-1,反应60 min时,甲基橙的去除率从78%上升到84.2%.当ZVI/Cu双金属投加量从6 g·L-1增加至8 g·L-1时,反应60 min,甲基橙的去除率几乎没有变化,这可能是因为过量的ZVI/Cu双金属在前期消耗了大量的H2O2,因此在反应60 min后甲基橙的去除率没有明显的上升,但前期的反应速率略快[18].当ZVI/Cu双金属的添加量由3 g·L-1上升至6 g·L-1时,反应60 min后甲基橙的去除率仅提升了0.8%.因此考虑到成本因素,本试验均选择3 g·L-1作为ZVI/Cu双金属的投加量.
2.4 ZVI/Cu双金属活化不同浓度H2O2降解甲基橙的影响
为探究H2O2浓度对降解甲基橙的影响,取质量浓度为50 mg·L-1的甲基橙溶液100 mL,在ZVI/Cu双金属投加量为3 g·L-1、pH值为4的条件下,考察H2O2浓度在0~4 mmol·L-1范围内变化时甲基橙随时间的降解情况,如图5所示.
由图5可知,由于ZVI/Cu双金属本身具有还原性,因此在不加入H2O2时,对甲基橙具有一定的降解效果,但是效果并不明显,反应60 min甲基橙的去除率仅达到44%.当向溶液中加入0.5 mmol·L-1的H2O2时,甲基橙的去除率提升了21.3%,这说明H2O2的加入,对整个反应体系的改变很大,此时,在溶液中产生了大量的·OH,对甲基橙的去除率起到了显著作用.随着H2O2浓度的增加,甲基橙的去除率随之不断增加,当加入H2O2的浓度为2 mmol·L-1时,反应60 min甲基橙去除率达到了80.1%,此时继续加大H2O2的浓度到4 mmol·L-1,反应60 min后甲基橙去除率几乎无提升,这可能是因为在反应前期由于高浓度的H2O2产生了大量的·OH,所以加快了反应速率,但在后期由于消耗了大量的·OH后无法持续为反应提供能量[19],所以甲基橙去除率几乎无提升.因此,在本试验中,考虑到试验效果以及试验成本,H2O2的浓度选取为2 mmol·L-1.

图5 ZVI/Cu双金属活化不同浓度H2O2降解甲基橙的去除率随时间的变化
2.5 pH值对ZVI/Cu双金属活化H2O2降解甲基橙的影响
为探讨pH值对甲基橙降解实验的影响,取质量浓度为50 mg·L-1的甲基橙溶液100 mL,ZVI/Cu双金属添加量为3 g·L-1、H2O2浓度为2 mmol·L-1的条件下,考察pH值对甲基橙的降解情况,如图6所示.
图6为在不同pH值条件下ZVI/Cu双金属活化H2O2降解甲基橙的去除率随时间的变化.当调节pH值为3的时候,反应60 min甲基橙去除率为81.8%,当逐渐提升pH值,使反应溶液从酸性转变为中性再到碱性的过程中,甲基橙的去除率也随之不断降低,这是因为pH值过高会产生沉淀,抑制Fe2+的产生,使溶液中Fe2+浓度下降[20-21].当pH值为4时反应60 min甲基橙去除率为80.1%,较pH值为3时降低了1.7%.当反应溶液为中性(pH=7)时,反应60 min甲基橙去除率降低了31.2%.当反应溶液为碱性(pH=10)时,反应60 min甲基橙去除率降低了近60%.由此可见,ZVI/Cu双金属在酸性条件下活化H2O2降解甲基橙的降解效果更好,这可能是因为在酸性条件下,ZVI/Cu双金属会被快速酸化为Fe2+,加快了与H2O2的反应,产生大量的·OH,使反应速率加快.而与此同时,在酸性环境下,也会加快H2O2的酸化,使体系中的·OH增多,氧化性增强.因pH=4时,甲基橙的去除率仅比pH=3时降低了1.7%,考虑到试验条件因素,本试验选取pH=4作为最终试验条件.
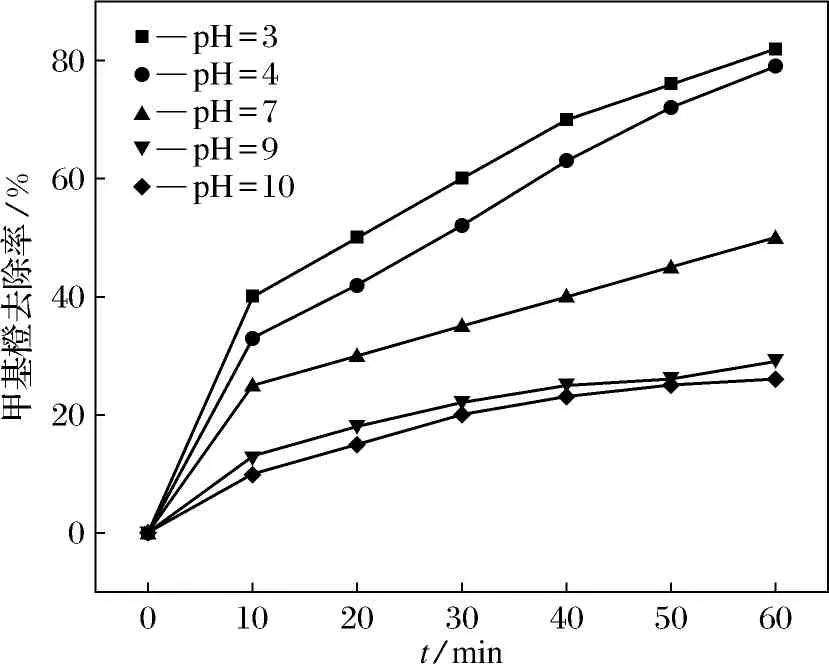
图6 不同pH值条件下ZVI/Cu双金属活化H2O2降解甲基橙的去除率随时间的变化
3 结 论
1) 对制备所得的ZVI/Cu双金属进行的SEM微观结构表征显示,ZVI/Cu双金属由大小不一的颗粒组成,由XRD结果可以看出ZVI/Cu双金属由Fe、Cu和Fe3O4构成.
2) ZVI/Cu双金属对H2O2具有很好的活化能力,与ZVI和Cu粉相比,在相同的条件下,对活化H2O2降解甲基橙的效果更好.
3) ZVI/Cu双金属的投加量、H2O2的浓度及pH值对其降解甲基橙有较大的影响.在甲基橙初始质量浓度为50 mg·L-1、ZVI/Cu双金属投加量为3 g·L-1、H2O2浓度为2.0 mmol·L-1、pH值为4的条件下,反应进行60 min甲基橙去除率可达到80.1%.

