响应面法优化超声辅助提取金线莲多糖工艺研究*
汤须崇,刘希敏,卢绍基,邓爱华,牛文静
(1 华侨大学化工学院,福建 厦门 361021;2 厦门塔斯曼生物工程有限公司,福建 厦门 361027;3 湖南文理学院生命与环境科学学院,湖南 常德 415000)
金线莲为兰科花开唇兰(Anoectochilusroxburghii(wall.)Lindl)的多年生草本药用植物,在民间有“药王”、“乌人参”、南方“冬虫夏草”等美称[1]。其味甘性平,具有清热凉血、祛风利湿、解毒、止痛、镇咳等功效[2]。现代研究表明,金线莲具有治疗肝炎、支气管炎、肾炎、膀胱炎、糖尿病、小儿急惊风等疾病[3]。金线莲化学成分丰富,目前已经从金线莲分离出多糖、黄酮、挥发油、有机酸、甾体、生物碱等多种成分[4-6]。金线莲多糖(Anoectochilusroxburghiipolysaccharide,ARP)是其主要成分之一,由葡萄糖、阿拉伯糖、木糖、半乳糖、鼠李糖和甘露糖6种单糖组成[7]。研究发现金线莲的临床药用价值主要基于多糖的功效,如抗氧化[8]、降血糖[9-10]、抗癌[11]、提高免疫力[12]和保肝护肝[13]等方面药理活性。因此金线莲多糖具有很高的开发价值。
金线莲多糖的提取方法主要有超声波辅助提取[14]、水浸提[15]、酸碱浸提[16]、微波辅助提取[17]、超高压辅助提取[18]和超临界流体萃取[19]。其中超声辅助提取方法具有节约溶剂,节能,省时,产率高等优点,被广泛用于中草药植物的多糖提取中[20-22],相比其他提取工艺更有利于金线莲多糖的高效提取。本研究为了考察金线莲中多糖提取工艺,采用超声波辅助提取技术,运用Box-Behnken响应面法设计以超声温度、超声时间、料液比以及超声功率的四因素三水平实验模型,建立回归方程,以响应面分析法(RSM)[23]对结果进行模拟分析,对金线莲多糖超声辅助提取工艺条件优化,为进一步研究其药理活性、作用机制及多糖产品开发提供一定的技术支持。
1 材料与仪器
1.1 材料与试剂
金线莲,厦门塔斯曼生物工程有限公司;葡萄糖标准品,上海麦克林试剂有限公司;苯酚,上海麦克林试剂有限公司;硫酸,上海国药集团化学试剂有限公司;无水乙醇,上海国药集团化学试剂有限公司。其余试剂均为分析纯。
1.2 仪器与设备
600Y老本行多功能粉碎机,永康市铂欧五金制品有限公司;DHG-9075A鼓风干燥箱,上海一恒科学仪器有限公司;AR1502CN电子分析天平,上海奥豪斯仪器有限公司;KQ5200E超声波清洗仪(功率300 W),昆山市超声仪器有限公司;UV-8000紫外可见分光光度计,上海元析仪器有限公司;Hei-VAP Precision旋转蒸发仪,德国海道夫公司;DK-S22电热恒温水浴锅,上海精宏仪器有限公司;SHB-IIIT循环水式多用真空泵,郑州长城科工贸有限公司。
2 方 法
2.1 金线莲多糖的提取工艺
准确称取5.0 g干燥至恒重的金线莲样品置于具塞锥形瓶中,按料液比加入一定量的水使之溶解,在一定的温度和功率超声处理一定时间,取出待温度降至常温,称重,加水保持原来重量,过滤,收集续滤液测定其多糖含量。
2.2 多糖含量测定
2.2.1 标准曲线的绘制
精密称取标准葡萄糖100 mg,葡萄糖提前经105 ℃干燥至恒重,温蒸馏水溶解并定容至100 mL,配制质量浓度为1 mg/mL的溶液。精密吸取上述葡萄糖溶液0.0、1.0、2.0、3.0、4.0、5.0、6.0 mL至100 mL容量瓶中,蒸馏水定容。分别精密量取上述各浓度标准液2.0 mL于10 mL的具塞试管中,精密加入5%苯酚溶液1.0 mL,摇匀后再精密加入浓硫酸5.0 mL,摇匀;5 min后置于90 ℃的水浴锅中加热15 min取出,待降至常温,于 490 nm的波长测定其吸光度。以葡萄糖浓度(ug/mL)为横坐标,吸光值(A)为纵坐标绘制标准曲线。通过标准曲线得到方程:Y =0.0151X+0.0062,R2=0.9933。

图1 葡萄糖浓度标准曲线
2.2.2 金线莲多糖提取量的计算[24]
精密吸取提取液2.0 mL于10 mL的具塞试管中,精密加入5%苯酚溶液1.0 mL,摇匀后再精密加入浓硫酸5.0 mL,摇匀;5 min后置于90 ℃的水浴锅中加热15 min取出,冷却至室温,于 490 nm的波长测定其吸光值。
按下式计算样品中多糖的提取量:
多糖提取量(mg/g)=C×D/m
式中,C为回归方程计算得到的多糖含量,mg/mL;D为稀释倍数;m为称取金线莲样品的质量,g。
2.3 单因素实验
根据文献报道和预实验结果,分别考察在保证其他因素不变的情况下超声温度、超声时间、料液比以及超声功率中任一因素在选定的范围中变化对金线莲多糖提取量的影响。
2.3.1 超声温度对多糖提取量的影响
称取干燥金线莲样品,根据上述金线莲多糖的提取工艺,按料液比(g:mL)1∶40加入水,分别于温度20、30、40、50、60、70 ℃ 进行超声提取60 min,超声功率设定为240 W,测定提取液中多糖含量。
2.3.2 超声时间对多糖提取量的影响
称取干燥金线莲样品,按照“2.1项金线莲多糖的提取工艺”,按料液比(g∶mL)1∶40加入水,分别超声提取20、40、60、80、100、120 min,超声功率设定为240 W,温度60 ℃,测定提取液中多糖提取量。
2.3.3 料液比对多糖提取量的影响
称取干燥金线莲样品,按照“2.1项金线莲多糖的提取工艺”,按照料液比1∶20、1∶25、1∶30、1∶40、1∶45加水超声提取60 min,超声功率设定为240 W,温度60 ℃,测定提取液中多糖提取量。
2.3.4 超声功率对多糖提取量的影响
称取干燥金线莲样品,按照“2.1项金线莲多糖的提取工艺”,按料液比(g∶mL)=1∶40加入水,设定温度为60 ℃,分别以超声功率0、20%、40%、60%、80%、100%提取60 min,测定提取液中多糖提取量。
2.4 响应面试验设计
按照Box-Behnken试验设计原理,根据单因素考察实验选取温度(A/℃)、超声时间(B/min)、料液比(C/g∶mL)和超声功率(D/W)为因素,金线莲中多糖提取率为响应值(Y),设计四因素三水平的响应面试验。实验设计水平表见表1。
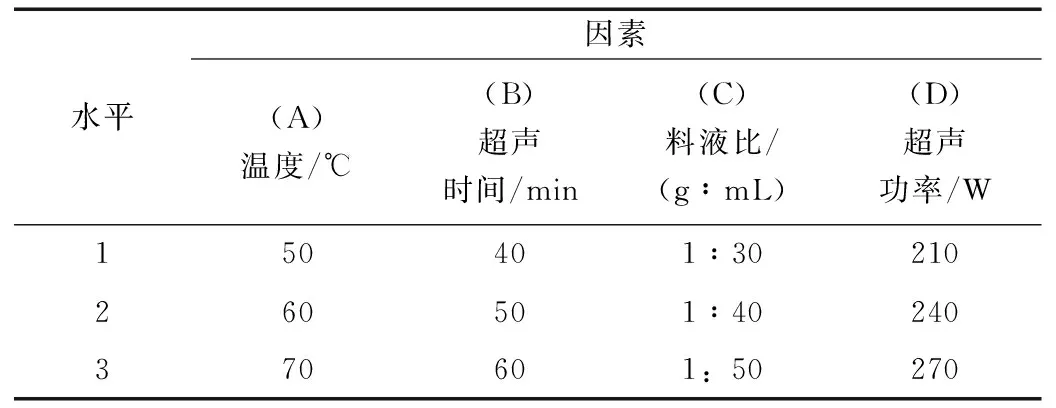
表1 实验设计水平表
2.5 验证实验
称取金线莲药材3份,按照最佳工艺条件进行提取,按照“2.1项金线莲多糖的提取工艺”,按“2.2项多糖含量测定”测定金线莲多糖含量。
3 结果与讨论
3.1 单因素实验结果
3.1.1 温度对多糖提取率的影响
超声波提取温度对金线莲多糖提取效果的影响见图2。由图2可知,在20~60 ℃之间随着温度的升高金线莲多糖提取率逐渐增加,当温度升至60 ℃时,多糖提取率最高,之后到70 ℃其提取率略有下降。这可能由于多糖作为有机物质对温度变化十分敏感。适当的温度可以增加多糖分子动能使其加速溶出,提取率上升。过高的温度则会导致多糖分子结构被破坏,丧失生物活性形成絮状沉淀脱离体系,提取率下降[20]。因此,选择温度设定为60 ℃。
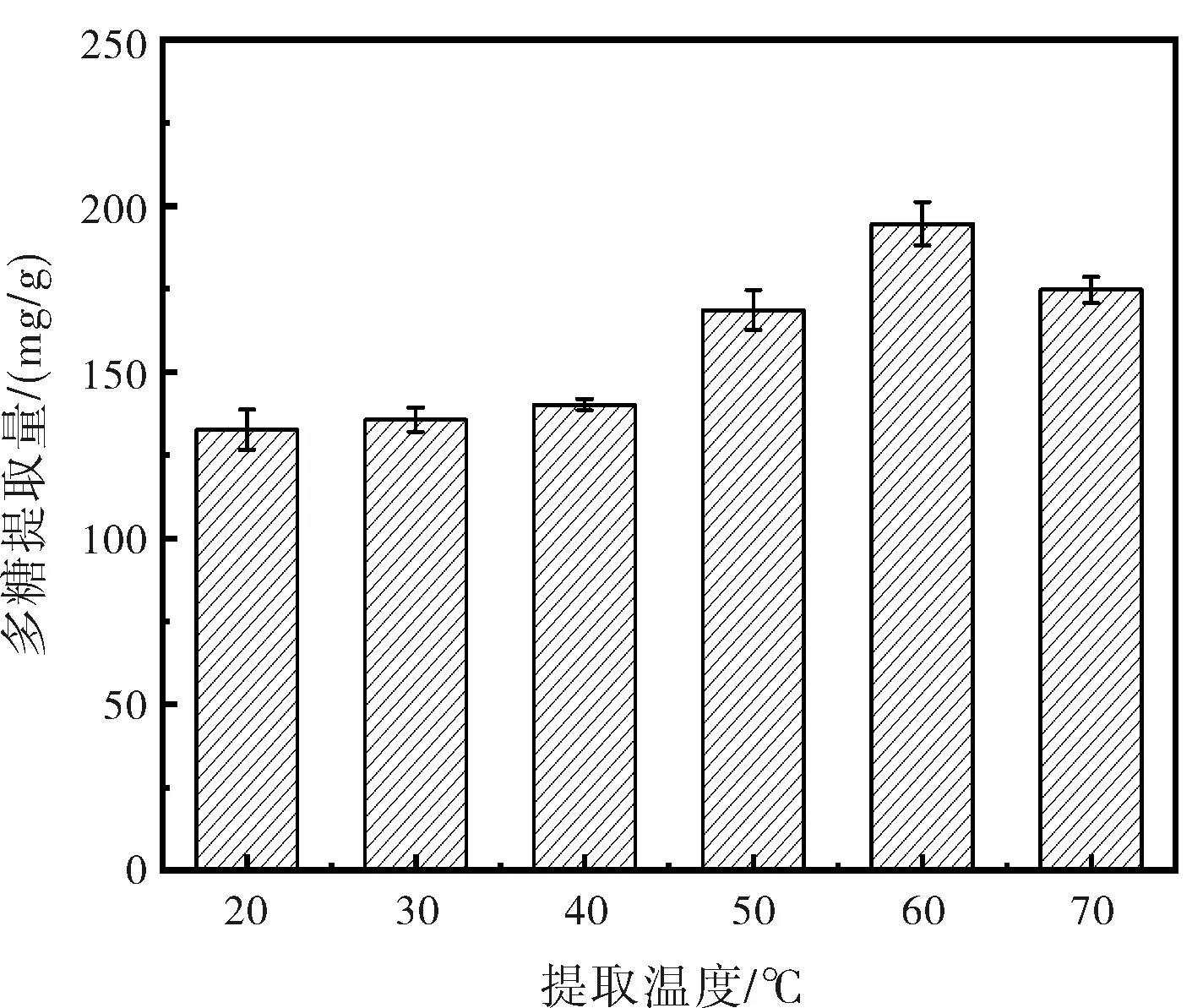
图2 温度变化对多糖提取的影响
3.1.2 超声时间对多糖提取量的影响
实际上,智能矿井是一个复杂的巨系统,生产过程都与地理空间有关,信息化建设必须满足监控实时化、系统集成化、数据海量化、控制协同化和决策在线化的实际需求,很多事故的发生都是多专业、多因素综合作用的结果。所以,结合空间信息技术,如何实现大数据技术与复杂系统具体业务的集成应用,从而开发大数据集成分析平台,使之服务于智能矿井安全生产、减人增效、管理升级等方面,是本文研究的重点和将要解决的问题。
超声波提取时间对金线莲多糖提取效果的影响见图3。超声时间低于60 min,多糖提取率较低;随着时间的增加,多糖提取率有所提高,提取60 min之后,多糖提取率开始下降,这可能是由于超声时间过长导致金线莲中含有的其他物质溶出过多抢占多糖的溶出空间,以及超声波使得溶出的多糖结构损坏降解[24]。从省时、节能的角度考虑,选择超声60 min为宜。
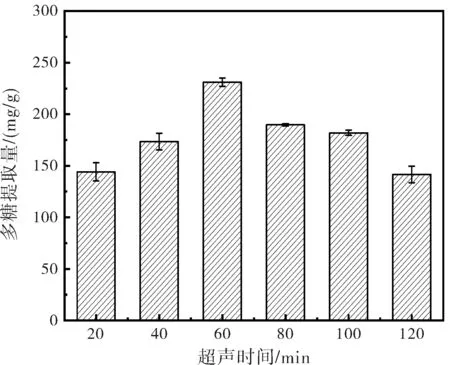
图3 超声时间变化对多糖提取的影响
3.1.3 料液比对多糖提取率的影响
超声波提取料液比对金线莲多糖提取效果的影响见图4。由图4可知,料液比(g∶mL)=1∶20~1∶40之间提取率逐渐增加,料液比较少时,多糖提取率较低,可能由于溶剂较少,细胞破壁水平低不利于多糖的溶出;料液比逐渐增加时,多糖提取率逐渐增加。料液比(g∶mL)=1∶40时,多糖提取率达到最高。之后增加料液比多糖提取率出现下降,可能是因为金线莲中的其他杂质被溶出挤占多糖的溶出空间,且金线莲粉末具有溶胀性,提取剂增加导致胶质量增大,从而降低金线莲多糖提取量[25]。
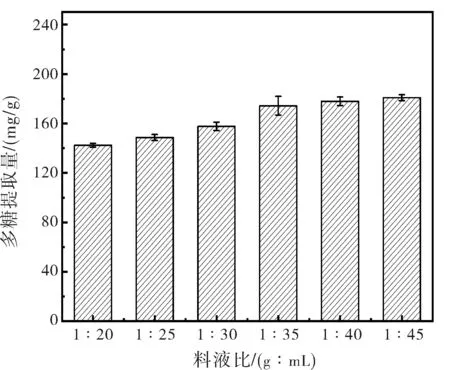
图4 料液比变化对多糖提取的影响
3.1.4 超声功率对多糖提取率的影响
超声波提取功率对金线莲多糖提取效果的影响见图5。由图5可直观看出,金线莲多糖的提取率随着超声功率的增加呈现先上升后下降的趋势。当超声功率为80%时多糖提取率最大。超声功率升高导致多糖提取率降低原因可能是超声波提取多糖是通过空穴效应与机械效应使液体微粒间发生猛烈撞击导致细胞结构破碎,增加多糖的溶出,而超声功率过高会使得多糖分子结构被破坏,多糖被降解。综上,超声提取功率应选择80%,即是240 W。
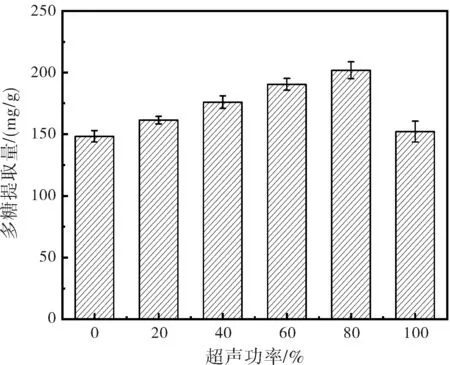
图5 超声功率变化对多糖提取的影响
3.2 响应面实验结果
根据Box-Benhnken 的中心组合设计原理,采用Design Expert 8.0.6统计分析软件进行设计,实验设计方案与结果见表2。
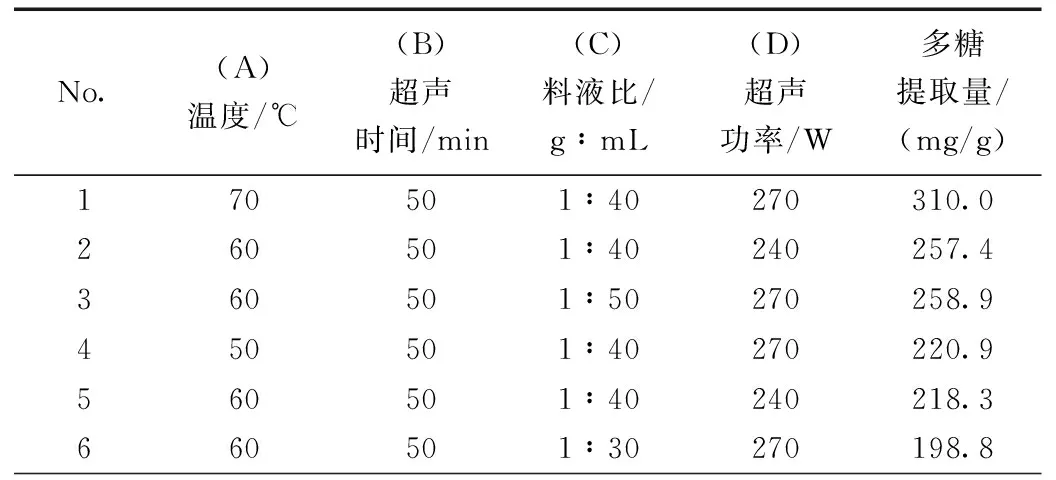
表2 响应面分析方案及实验结果

续表2
对表2中金线莲多糖提取率(Y)及四个因素A、B、C和D的数值由Design Expert 8.0.6 软件进行二次回归模型拟合,回归分析结果分别见表3。
使用Design-Expert 8.0.6软件表3实验数据进行多元回归拟合,得到的二元多项回归方程为:
R=220.06+42.18A+5.67B+4.07C+35.53D+11.92AB-2.38AC+1.15AD+0.90BC+2.05BD+25.35CD+2.36A2+37.25B2-13.98C2+9.21D2
由表3分析结果看,其中回归方程方差P<0.01,表明该二元多项方程模型差异显著。而且方程的失拟项不显著(P>0.05),说明非试验因素对试验结果的影响不大,可对于金线莲多糖提取实验结果准确预测。回归方程系数显著性分析结果表明因素A,D为极显著影响因素,CD,B2为显著影响因素,其余因素对实验结果影响不大。说明超声提取温度或超声功率发生变化就会使金线莲多糖提取效果显著不同。两两因素之间的交互作用中,超声功率和料液比的交互作用对金线莲多糖提取效果影响显著。

表3 响应面分析法方差分析
由结果可知,模型的相关系数R2=0.8804,说明因变量和自变量之间线性关系显著且拟合度较好;模型的校正决定系数Adj R2为0.7607,表明此模型能解释76.07%响应值的变化,即此模型与数据拟合度较高,实验误差影响较小。说明应用响应面法优化的金线莲多糖提取工艺准确可靠。
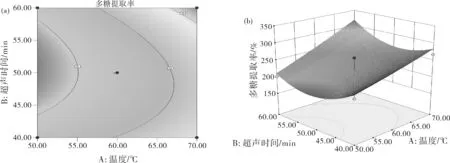
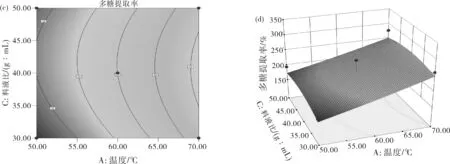
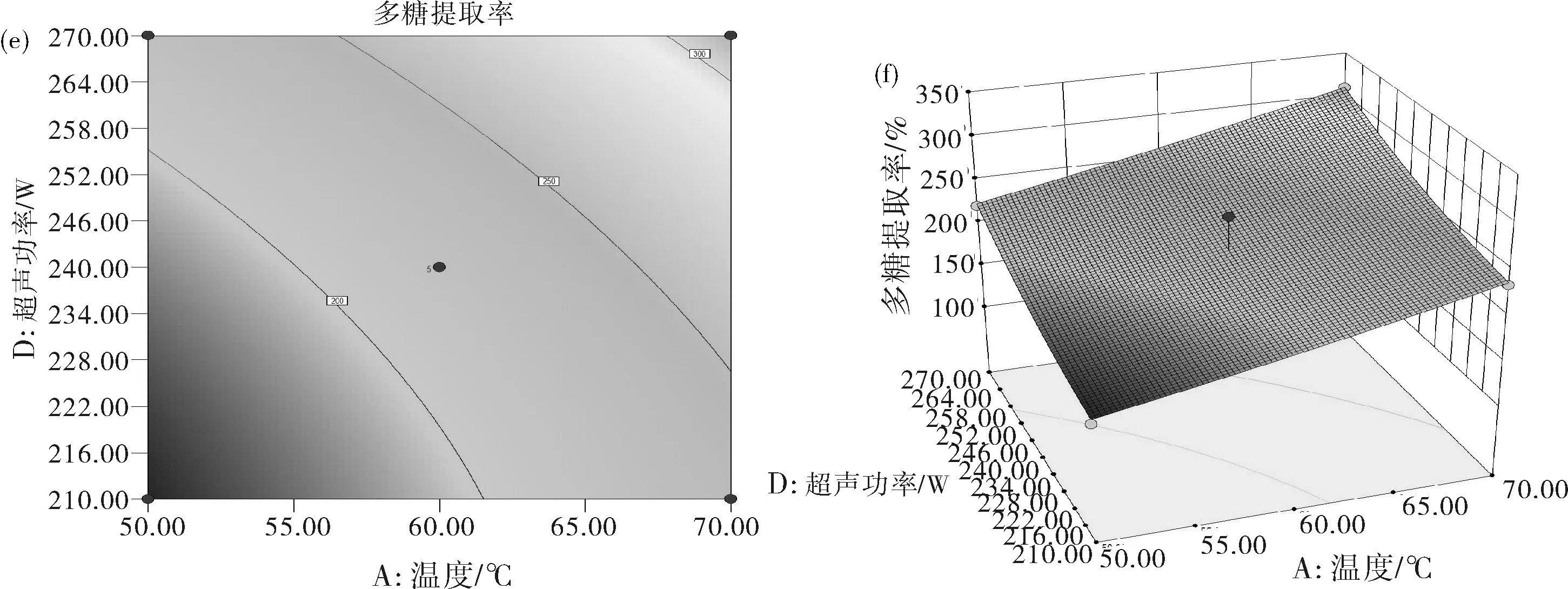



图6 金线莲多糖提取响应面分析等高线(a,c,e,h,j,l)及响应面(b,d,f,i,k,m)
金线莲多糖提取的等高线图与响应面3D图见图6。直观地看交互作用的响应面曲线图就能发现各因素对响应值的影响。在响应面曲线图中交互作用影响多糖提取率的显著性与响应面的坡度相关,曲面图中若曲面坡度陡峭则因素发生较小变化时多糖提取率数值就会改变较大,那么两个因素结合在一起对实验结果影响较大。图6(m)中,控制AB两因素不变,CD交互作用导致曲面坡度陡峭即多糖提取率变化较大。
3.3 最佳提取工艺
根据分析结果,金线莲多糖的最佳提取工艺为:提取温度70 ℃,超声时间60 min,料液比为1∶49.05,超声功率为269.93 W,此条件下金线莲多糖提取率预测值为381.07 mg/g。
3.4 最佳提取工艺验证实验
为确保该工艺的稳定性与合理性,根据最佳提取工艺条件进行三组验证实验,按照2.1项方法制备供试品溶液,测定金线莲多糖含量。为方便实验具体操作,将提取温度设定为70 ℃,超声时间60 min,料液比为1∶49,超声功率为270 W。实际测得金线莲多糖平均提取量为377.4 mg/g,与理论预测值相比无显著性差异(P<0.01)。因此,采用Box-Behnken的中心组合试验设计优化的金线莲多糖提取工艺条件具有较高的可靠性和稳定性。

表4 验证实验结果
4 结 论
本研究采用响应面法(Design-Expert软件)[26]考察金线莲中多糖的提取工艺,并且做出了试验因素间交互作用的三维立体响应曲面和等高线图。结果显示,二次方程的模拟回归差异显著,表明模拟回归方程能够较高程度的拟合影响因素与提取结果之间关系,实验设计合理。
本实验首先通过单因素试验分析四个因素分别对金线莲多糖提取率的影响,选择适当的因素水平;再根据 Box-Benhnken 的中心组合试验设计原理,以金线莲多糖提取率为响应值,温度(A/℃)、超声时间(B/min)、料液比(C/g:mL)和超声功率(D/W)为影响因素设计的响应面分析实验。最终优化得到的金线莲多糖最佳提取工艺为:提取温度70 ℃,超声时间60 min,料液比为1∶49,超声功率为270 W。通过验证实验,实际测得多糖提取率为377.4 mg/g与模型预测值381.07 mg/g相差无显著性差异(P<0.01),证明了该工艺的可行性。
超声辅助提取金线莲多糖工艺简单易行,提取用时短;超声波能较好地击破中药材的细胞壁,有利于物质的溶出;提取过程化学试剂使用量较少,减少试剂的污染;即具有高效、省时、绿色环保等优点。该提取工艺可为金线莲多糖的进一步开发利用研究提供科学依据,具有良好的应用前景。

