柚皮素对于急性放射性皮炎的影响
张倩玉, 许 斌, 金 伟, 周守兵, 李文娟, 张秋君, 胡丹丹, 李文玉, 刘 虎
(1. 中国科学技术大学附属第一医院 西区肿瘤科(安徽省肿瘤医院), 合肥 230000; 2. 武汉大学人民医院 肿瘤一科, 武汉 430060)
恶性肿瘤是我国发病率及死亡率最高的疾病之一,放射治疗作为一种常见的治疗方式常被用于癌症的局部治疗。约有50%~60%的癌症患者接收放射治疗[1]。然而,会有95%的放疗患者会在放疗期间或放疗结束之后出现急性放射性皮炎[2]。急性放射性皮炎是一种常见的放疗并发症,定义为一种由β,γ或X射线所造成的一系列皮肤副反应,通常发生于放疗后90 d之内[3],临床表现为不适感、灼烧感、瘙痒、疼痛等[4],严重者会影响抗肿瘤治疗的顺利进行。因此,越来越多的研究着眼于探讨其发病机制及防治措施。目前尚无标准方法治疗或预防急性放射性皮炎的发生。
柚皮素(4′,5,7-三羟基二氢黄酮)是一种富含于柑橘、葡萄和番茄等水果中的黄酮类化合物[5-6],其已被证实具有抗氧化、抗动脉粥样硬化、抗肿瘤等作用[7-8],但柚皮素对于癌症局部治疗所用放射性所导致的急性放射性皮炎有无作用暂无文献报道。
本研究探讨了柚皮素通过不同给药方式对于接受放射线的SD大鼠是否具有保护作用。同时观察了柚皮素对于在临床中接受头颈部放疗的患者急性放射性皮炎的发生发展所起到的作用。
1 材料与方法
1.1 材料
1.1.1 动物来源 清洁级健康SD大鼠共40只,雄性,质量240~260 g,由湖南斯莱克景达实验动物有限公司提供。
1.1.2 患者一般资料 观察因头颈部恶性肿瘤行颈部放疗或同步放化疗,剂量≥30 Gy,患者11名,9名男性,2名女性,年龄26~73岁之间,其中7人诊断为鼻咽癌,3人诊断为喉癌,1人为鼻腔未分化癌。患者双侧颈部剂量一致,ECOG评分0~1分。
1.2 方法
1.2.1 动物分组
随机平均分为5组,每组8只,分别为预防性使用外用柚皮素(照射前5 d开始涂抹,每天2次)、治疗性使用外用柚皮素(自发生肉眼可见的放射性皮炎后开始涂抹柚皮素乳膏,每天2次)、照射后口服柚皮素组(自放疗完成后第一天开始灌胃,每天1次,200 mg/kg)、模型组(自发生肉眼可见的放射性皮炎后开始使用溶剂乳膏,每天1次)、空白对照组,除对照组不接受放射外,其余各组大鼠均接受臀背部皮肤照射。照射前将所有动物使用电动推刀局部去毛。射线照射时采用异氟烷吸入方式麻醉。
1.2.2 动物照射方法
射线类型:6 MV电子线,45 Gy,照射野为3×3 cm,剂量率300 MU/min,使用1.5 cm补偿膜覆盖于动物皮肤表面,单次照射源皮距为100 cm,每次照射1只。
对照组:局部去毛,麻醉,不照射。
1.2.3 患者试验方法
所有患者注意宣教自放疗开始保持局部皮肤清洁、干燥,避免摩擦及用力清洁等操作,自开始出现I°放射性皮损后以颈部正中线为界限,随机选取一侧涂抹柚皮素乳膏,涂抹在放射野处(试验区的半侧颈部皮肤,外扩1 cm左右),取适量均匀涂抹,直至基本吸收,一日2次。另一侧予以日常基本护理。每日观察并记录患者双侧放射性皮炎程度。无论双侧任何一侧出现4级的皮肤损伤或毒副反应,则中止试验。如果双侧皮肤损伤均维持在小于/等于3级,则一直涂抹受试保护剂至放疗结束。
1.2.4 观察指标与评分标准
1)动物观察指标与评分标准。动物接受照射后每天观察照射区域的皮炎情况并进行评分,采用Douglas and Fowler评分方法[9](如表1)。观察并记录大鼠体重变化情况并记录死亡情况。

表1 Douglas and Fowler放射性皮炎评分[9]
2)患者观察指标与评分标准。使用急性放射性反应RTOG (Radiation therapy oncology group)评价标准:0级:基本无变化;I级:水泡、轻度红斑/脱发/干性脱屑/流汗减少;II级:明显红斑,块状湿性脱屑/中度水肿;III级:皮肤皱褶部位以外的融合的湿性脱屑,凹陷性水肿;IV级:溃疡、出血、坏死。观察出现各级皮肤损伤的时间(RTOG分级标准)以及与未涂抹受试保护剂的对照侧相比,受试保护剂是否对单侧颈部皮肤的放射性损伤降级。
1.2.5 动物取材
照射后20 d,使用1 mm毛细管行大鼠活体眼眶取血,20 min离心(2000 r/min),取上层清液即为血清,标记后于-80 ℃冰箱保存。照射后28 d用2%戊巴比妥钠进行腹腔麻醉,用手术剪剪取照射部位的皮肤组织,大小约1.0 cm×1.0 cm,剪取全层,其中一部分组织用4%多聚甲醛固定,固定时间超过24 h。一部分组织立刻放入液氮中,之后转入-80 ℃冰箱保存。
1.2.6 病理学检测
使用4%多聚甲醛进行固定,石蜡包埋,进行切片,行苏木素伊红(HE)染色,免疫组化(IHC)染色检测CD68,观察CD68在皮肤组织的表达分布情况。
1.2.7 血清学检测
使用酶联免疫吸附测定(ELISA)检测方法检测血清中IL-6及MCP-1的含量。
1.2.8 组织学检测
使用实时荧光定量聚合酶链式反应(qPCR)检测组织中Arg-1含量。
1.2.9 统计学处理
使用SPSS 20.0软件进行分析,用重复测量的方差分析统计皮炎评分与体重变化情况,使用单因素方差分析统计CD68+、IL-6、MCP-1及Arg-1表达情况,P<0.05视为有统计学意义。
2 结果与分析
2.1 动物一般情况
各组动物在观察期间均未出现死亡。动物放疗期间体重情况如图1。对比空白组,各组(预防组、口服给药组、治疗组和照射模型组)动物体重无显著性差异,P值分别为0.750、0.451、0.092和0.192。
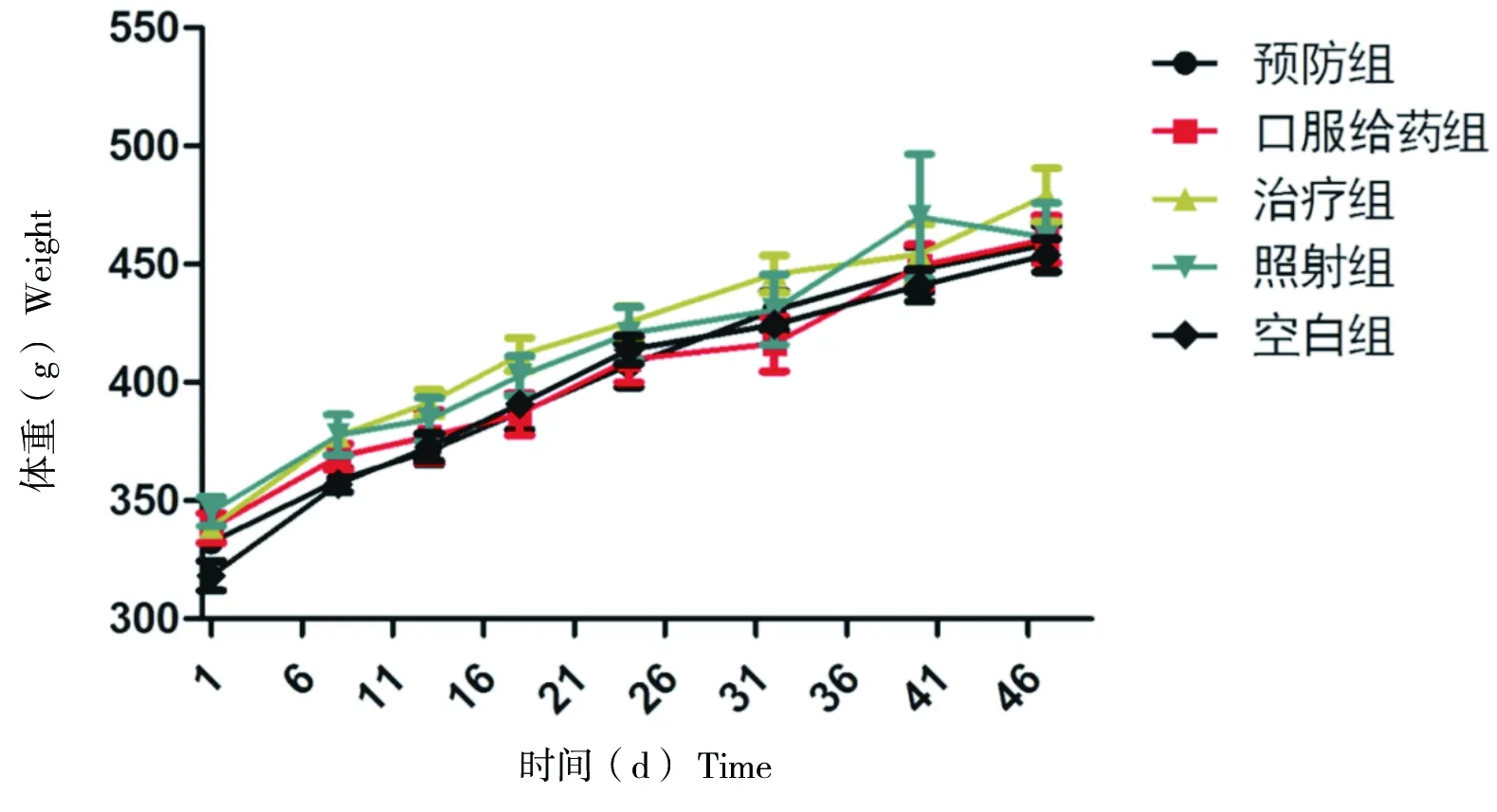
图1 放疗期间动物体重变化
2.2 动物放射性皮炎特征
2.2.1 外观特征
接受电子线照射后的4组大鼠于接受放疗后第9或第10天时出现肉眼可见的急性放射性皮炎表现:红斑、脱毛,进而出现薄纸样改变、痂皮样改变,于第15至第18天达高峰;后皮炎表现逐渐好转,痂皮脱落。各组大鼠臀背部皮肤放射性皮炎表现如图2,其皮炎评分结果如图3。对比模型组,预防组、口服给药组和治疗组动物皮炎较前显著好转,P值分别为0.003、0.030和0.037。
2.2.2 镜下特征
HE染色可见对照组的表皮、真皮结构正常,真皮内存在丰富的毛囊结构,可见正常皮肤褶皱结构;模型组的部分动物表皮层各层结构分界未见,结构紊乱,出现坏死,部分表皮层结构消失。真皮层内可见大量炎性细胞浸润,表皮层与真皮层结构分离,未见毛囊及皮脂腺,未见皮肤褶皱;使用柚皮素的3组表皮层可见,真皮层与其分界清晰,部分出现分离,毛囊及皮脂腺未见,皮肤褶皱未见;表皮层各层细胞结构混乱,真皮层内可见明显炎性细胞浸润。图4为光镜下HE染色结果(100×)。
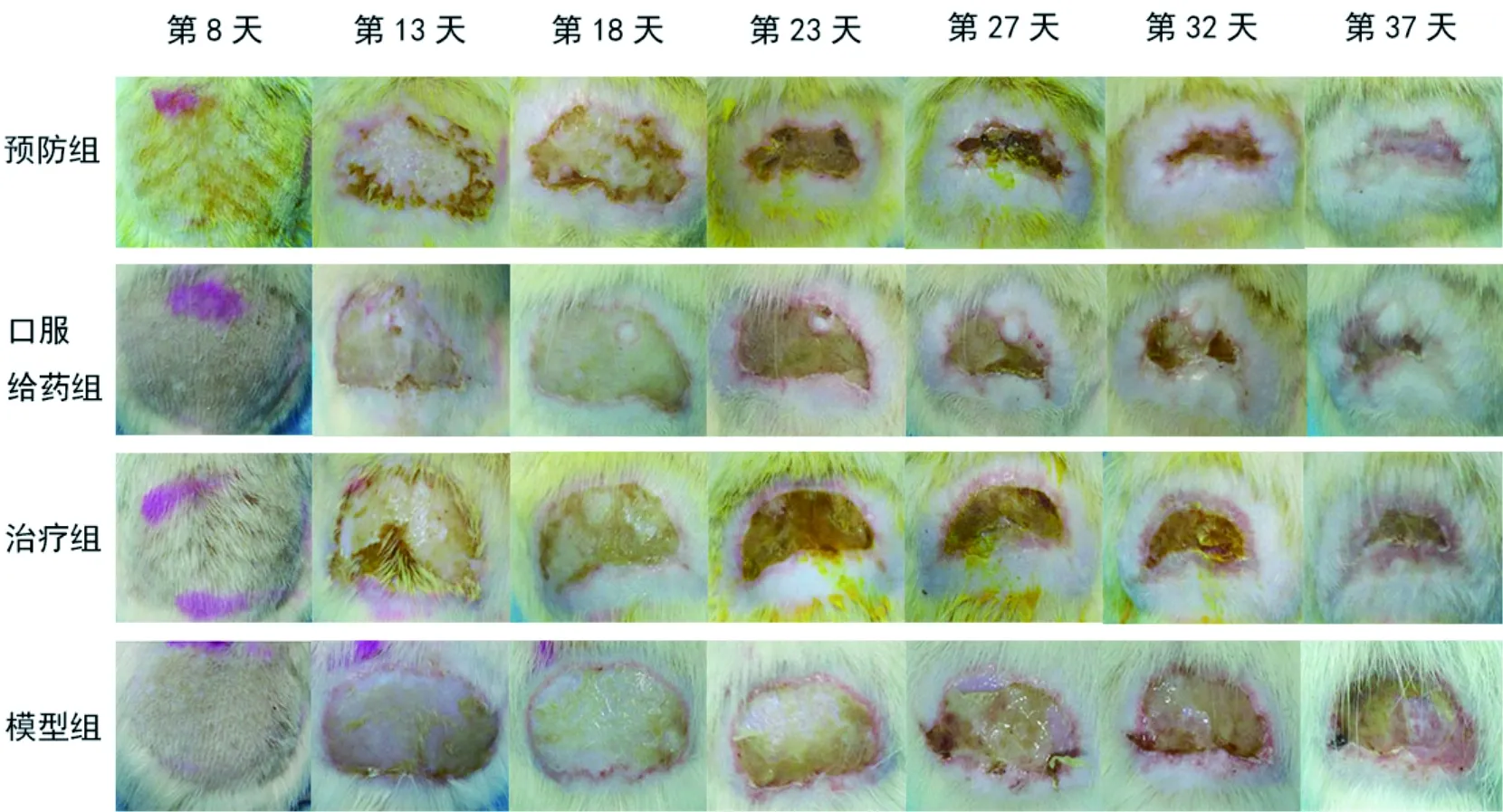
图2 各组动物放疗后不同时间点急性放射性皮炎的表现

图3各组动物放射性皮炎评分
IHC检测局部组织内CD68阳性表达情况:400倍镜下随机取10个视野,计数CD68+细胞数,取均值,空白组、模型组、预防组、口服给药组及治疗组CD68+细胞数分别为:0.75、12.91、7.70、3.13和8.30(图5)。模型组CD68+细胞数较空白组显著增加(P=0.004),使用柚皮素的3组,CD68+细胞数较模型组下降,其中口服给药组具有显著性差异(P=0.005)。光镜下观察用IHC方法检测皮肤组织中CD68+细胞表达(图6,400×)。
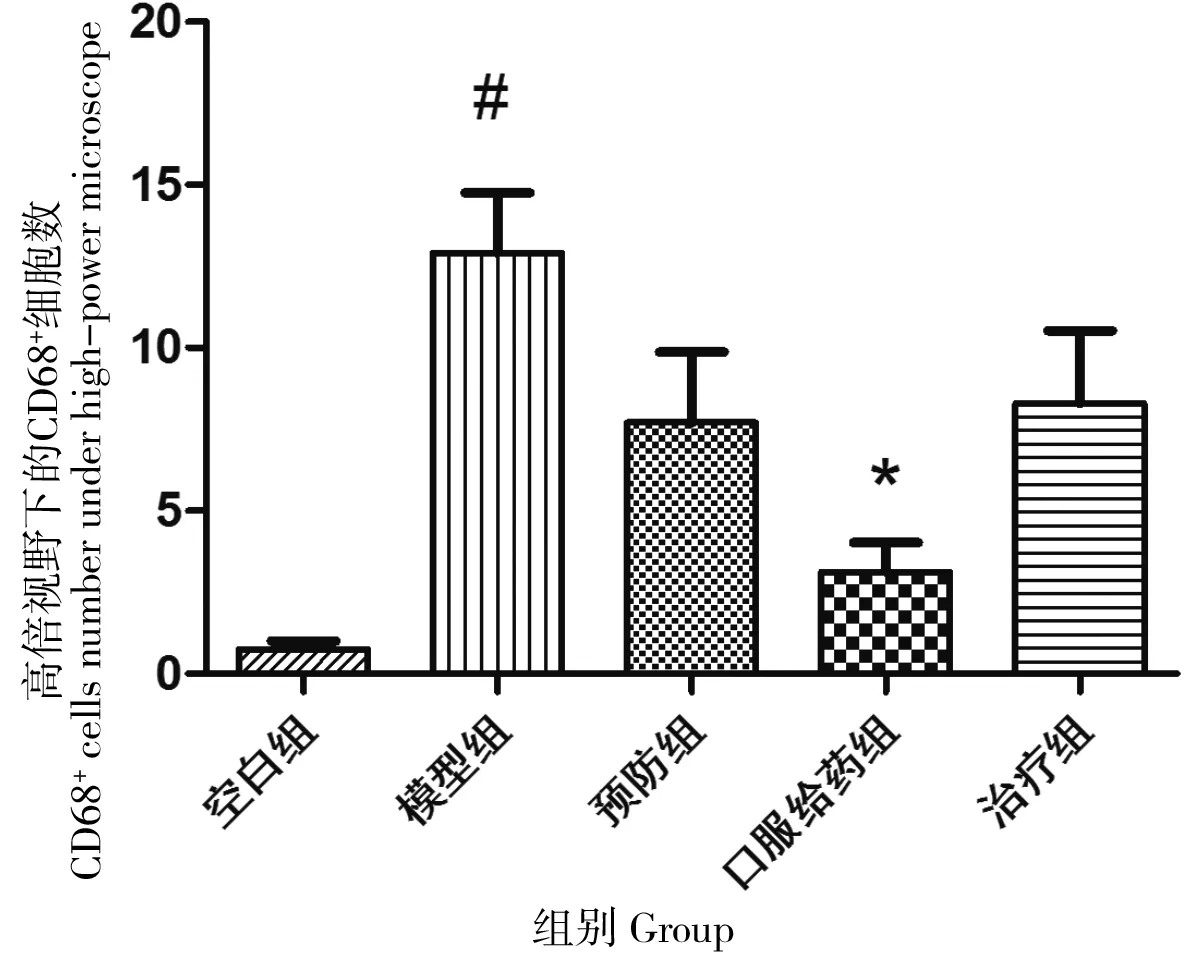
“#”:对比空白组,P=0.004;“*”:对比模型组,P=0.005
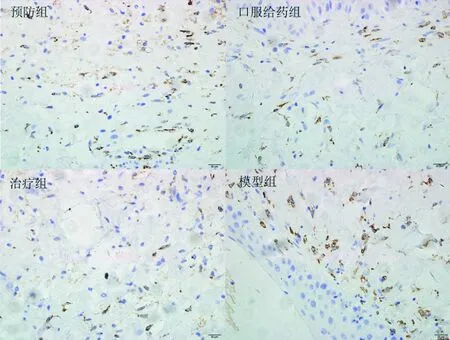
图6 放疗后第28天各组照射区域皮肤CD68免疫组化染色结果(400×)
2.2.3 ELISA检测放疗后第20天动物血清内IL-6含量
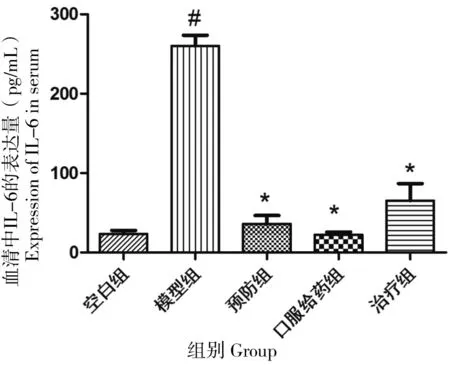
为研究大鼠血清内炎症情况,使用ELISA检测大鼠放疗后第20天血清内IL-6的表达情况,空白组、模型组、预防组、口服给药组及治疗组IL-6平均值分别为23.33、260.21、36.25、22.37和65.35 pg/mL。对比空白组,放射线可以显著增加大鼠体内IL-6的表达(P<0.01),3种使用柚皮素的方式均可以显著降低放射所致的IL-6的升高(P<0.01)(图7)。
2.2.4 ELISA检测放疗后第20天动物血清内MCP-1含量
MCP-1即单核细胞趋化蛋白-1,其对单核细胞具有趋化活性,可激活单核细胞和巨噬细胞。因第一部分结果显示,放疗可导致巨噬细胞在真皮层的聚集,因此我们进一步使用ELISA检测MCP-1在循环中的表达情况。结果显示:空白组、模型组、预防组、口服给药组及治疗组MCP-1平均值为335.73、497.94、389.67、380.11和367.07 pg/mL。对比空白组,放射线可以显著增加大鼠体内MCP-1的表达(P=0.004),3种使用柚皮素的方式均可以显著降低放射所致的IL-6的升高(P= 0.04、0.036、0.021,图8)。
“#”:对比空白组,P<0.01;“*”:对比模型组,P<0.01
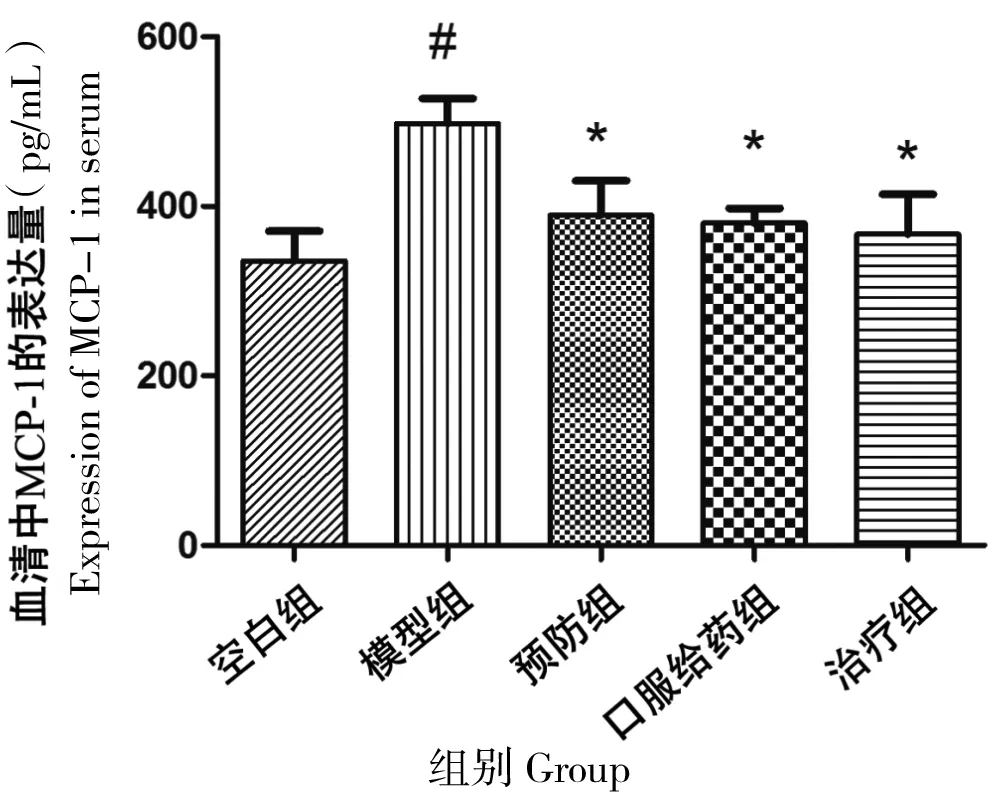
图8 各组大鼠放疗后第20天血清中MCP-1表达量
2.2.5 qPCR检测放疗后第28天动物局部组织Arg1量
Arg1是M2型巨噬细胞的标志分子,可抑制炎症反应。为研究放疗所致的巨噬细胞浸润及柚皮素降低巨噬细胞浸润是否是通过该途径进行调节,我们于放疗后28 d取大鼠放疗区域局部组织,进行qPCR检测,结果显示,5组结果无统计学差异(图9)。
2.3 患者放射性皮炎表现
11名患者均未出现III级以上放射性皮炎。试验侧及对照侧在观察结束时均为II级放射性皮炎表现。即使用柚皮素乳膏一侧放射性皮炎程度较对照侧皮炎程度均无加重。其中1名患者因双侧颈部皮肤疼痛感明显,自行加用其他药物治疗,其余10名患者均每日涂抹柚皮素直至放疗结束。所有患者均未出现无法耐受的副反应。2人用药侧好于对照侧,表现为用药侧颈部皮肤出现II°皮损时间晚于对照侧10 d左右,其余8人双侧颈部皮炎情况未见区别。

图9 各组大鼠放疗后第28天组织中Arg1 mRNA量(P>0.05)
3 讨论与结论
已有的实验及临床研究发现,对于急性放射性皮炎,芦荟[10]、激素[11]、三乙醇胺[12]、水化膜[13]等可能具有一定的防治效果,但是其有效性具有一定的局限,且缺少大样本的随机对照临床试验。对于急性放射性皮炎的治疗尚无标准治疗方式,因此研究人员期望发现更多更有效的药物成分,以更好地防治急性放射性皮炎,而柚皮素作为一种富含于水果中的黄酮类化合物,具有抗氧化、抗肿瘤等作用。已有的动物实验证实,包含柚皮素在内的黄酮类混合物在小鼠体内可起到一定的保护作用[14],可以减少放射线照射对于动物的致死作用,其对于紫外线诱导的放射线皮肤损伤同样具有保护作用[15]。而对于柚皮素的基础研究证实,其可以通过调节机体炎症状态来影响心血管疾病的发生,肺纤维化及肿瘤的转移等疾病过程[16-17]。
本实验发现柚皮素可以降低动物急性放射性皮炎的表现,其中预防治疗组的效果最佳,在机制研究方面,CD68为单核巨噬细胞的表面标志,在使用柚皮素之后,无论何种给药方式,均可以降低其表达。MCP-1即单核细胞趋化蛋白,可激活单核细胞和巨噬细胞。本实验通过检测动物血清中的表达量发现,放射线可以增加其表达,而柚皮素可降低其增加程度,进一步证实了单核巨噬细胞系统在急性放射性皮炎发生中的作用,以及柚皮素降低急性放射性皮炎程度这一过程中所扮演的角色。IL-6是一种由包括单核-巨噬细胞、B细胞、上皮细胞等细胞分泌的具有复杂生理功能的细胞因子,已有的研究发现,放射线可导致炎性因子IL-6的大量释放[18]。Okunieff等[19]研究发现姜黄素对放疗所致的急慢性皮炎具有保护作用,其可以降低放射线所致的皮肤组织中IL-6 mRNA表达。因而,我们猜测柚皮素可以通过降低放疗所致循环中IL-6水平的升高来降低放射性皮炎的表现,结果发现对比空白组,放射线可以显著增加大鼠体内IL-6的表达(P<0.01),3种使用柚皮素的方式均可以显著降低放射所致的IL-6的升高(P<0.01)。因此我们认为柚皮素可以通过降低单核细胞趋化蛋白对于单核巨噬细胞的趋化作用,降低单核巨噬细胞在放射性皮炎中所发挥的作用,进而可以降低以IL-6为代表的炎性因子的释放。巨噬细胞家族在功能方面具有异质性[20], M1和M2型巨噬细胞作为其功能状态的两种极端,在免疫应答功能方面具有相反作用[21]。M1 型巨噬细胞是一种发挥正向免疫应答作用的细胞,可以通过分泌促炎细胞因子及趋化因子,提呈抗原,发挥免疫监视的功能;而 M2 型巨噬细胞功能相反,其仅有较弱抗原提呈能力,并可以通过分泌抑制性细胞因子 IL-10 和/或TGF-β等抑制免疫应答反应[22]。Arg-1是M2型巨噬细胞的表面标志,我们假设柚皮素降低急性炎症反应是通过上调以Arg-1为表面标志的M2型巨噬细胞的表达来下调免疫应答,结果发现各组之间Arg-1无显著性差异,因此柚皮素可能通过其他途径降低其炎症反应。本实验后续需要补充检测M1型巨噬细胞的表达情况来明确其是否可通过降低M1型巨噬细胞的表达来影响巨噬细胞的浸润。
在临床观察中,我们初步证实柚皮素乳膏是安全的,其不会加重患者放射性皮炎程度,但有效性十分有限,需要进一步探究。11名患者中2名患者能延缓出现II°放射性皮炎的时间,但无法停留在I°放射性皮炎。考虑与局部皮肤吸收柚皮素成分有限相关,且每日涂抹2次,操作上可能加重皮损程度,因此柚皮素可否作为临床上治疗甚至预防放射性皮炎的药物,需要进一步的研究及发现,本临床观察纳入患者数目有限,需要更大样本数据来说明柚皮素的安全性及有效性。

