辣根过氧化物酶和荧光碳点的复合物研究
刘 利, 丁海贞, 房 伟, 毕 红,3
(1. 安徽大学 化学化工学院, 合肥 230601; 2. 安徽大学 生命科学学院, 合肥 230601; 3. 现代生物制造安徽省重点实验室, 合肥 230601)
辣根过氧化物酶(HRP)是临床检测试剂中的一种常用酶,它是由棕色的铁卟啉与无色的酶蛋白结合而成的糖蛋白,其辅基活性位点中含有Fe (III)。当HRP与底物孵育时,可产生一种着色、荧光或发光标记的分子衍生物,因此广泛用于多个生化检测项目和免疫类(ELISA)试剂盒[1]。酶作为一类生物催化剂,具有专一性和高效性,但受酸碱度、温度等外界环境条件影响较大,易失活或者变性,这极大限制了酶的应用。因此,酶的修饰和固定化就显得非常重要,酶修饰和固定化后不仅保持酶自身的催化特性,也可改善其反应条件等[2-3]。Shen等[4]将HRP与磁性介孔二氧化硅纳米粒子以及碳点(CDs)复合,提供了一种能消除细胞中应激产生的活性氧(ROS)的方法。Hu等[5]制备了可调节漆酶活性的手性CDs,发现具有左旋结构的CDs与漆酶复合后可以将漆酶的活性提高至20.2%,而右旋结构的CDs与漆酶复合后却将其活性降低至10.4%。CDs这一类碳纳米材料因其表面富含官能团,且具有良好的生物相容性等优点使其易于与HRP等生物大分子复合。
CDs是一类具有10 nm以下尺寸的碳基纳米粒子的总称[6-7]。CDs具有尺寸小、荧光量子产率高、光致发光性能可调和生物相容性好等优良特性,在化学传感、生物显影等方面都有很大的应用潜力[8-9]。CDs中心一般是结晶的碳核,表面含有大量的有机官能团,从而易于对CDs表面进行修饰和功能化,来调节其表面结构和光学性质[10]。杂原子掺杂是改变CDs的光学性质和化学性质的重要手段之一,例如广泛使用的氮(N)元素掺杂[11-12]。Yang等[13]报道了氟(F)原子掺杂可以实现CDs的荧光发射峰(PL)红移,这可能与F-为吸电子基团有关。含F配体通常有生物惰性,这有利于避免蛋白质变性,因此氟元素掺杂也是CDs研究热点之一[14-15]。此外,过氧化氢具有强氧化性可用作防腐剂,是许多生化反应的重要中间体,而且高浓度的H2O2对人体有害[16]。本文研究了H2O2的加入量对F-CDs/HRP复合物催化氧化2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)的影响,旨在为碳点将来用于免疫荧光分析进行前期研究。
1 材料与方法
1.1 试剂及仪器
对苯二胺(分析纯),过氧化氢(H2O2,分析纯)和ABTS(分析纯)购自阿拉丁生化科技股份有限公司;5-氟尿嘧啶(分析纯)购自萨恩化学技术有限公司;油酸(分析纯)和辣根过氧化酶(HRP,分析纯)购自上海麦克林生化科技有限公司。实验过程中所用的水均为经超纯水机(国之源)净化后的超纯水。透射电镜(TEM,JEM-2100型,日本);X-射线光电子能谱仪(XPS,ESCALAB250型,美国);紫外-可见吸收光谱仪(UV-Vis,UV-1800G型,中国)和荧光发射光谱仪(PL,F-7000型,日本)。
1.2 方法
1.2.1 F-CDs的合成
以邻苯二胺和5-氟尿嘧啶为原料,通过一步水热法合成F-CDs,具体合成步骤如下:称取195 mg的邻苯二胺和234 mg的5-氟尿嘧啶(投料摩尔比为1∶1),加入15 mL水后超声,使两者溶解完全且混合均匀。把配制好的反应液转移至内衬四氟乙烯的50 mL不锈钢反应釜中,在马弗炉中200 ℃下反应2 h。待反应结束后得到褐色溶液,经过0.22 μm的滤膜抽滤,以去除产物中不溶的杂质。取30 mL滤液于萃取瓶中,加入100 mL油酸,用力震荡5 min后静置过夜,待溶液分层后取上清液。浓缩该上清液,冷冻干燥,得到褐色的F-CDs粉末样品,待用。
1.2.2 F-CDs/HRP复合物的制备
以醋酸-醋酸钠缓冲溶液 (pH 4.5) 为溶剂,配制浓度为500 mg/mL的HRP溶液,备用。再以超纯水为溶剂,配制一系列不同浓度的F-CDs溶液 (浓度分别为:50、75、100、125、150、200和250 μg/mL )。从每个浓度的F-CDs溶液中各取0.1 mL,另取2 mL HRP溶液,将两者混合,在4 ℃下搅拌24 h,得到一系列的F-CDs/HRP复合物,放置于4 ℃冰箱保存。
1.2.3 F-CDs/HRP复合物催化氧化ABTS的研究
以醋酸-醋酸钠缓冲溶液 (pH 4.5) 为溶剂,分别配制8份浓度为0.5 mmol/L、体积为700 μL的ABTS溶液,置于1.5 mL离心管中;再分别加入20 μL浓度为0.05、0.1、0.25、0.5、1.0、2.5、5.0和10.0 mol/L的H2O2溶液;然后再逐一加入10 μL浓度为250 μg/mL的F-CDs/HRP复合物溶液,混合均匀得到F-CDs/HRP-ABTS-H2O2溶液,待测。用UV-Vis光谱仪依次测试在417 nm处待测溶液的吸光度,经过数据处理,得到横坐标为H2O2浓度、纵坐标为待测溶液吸光度值的曲线。
2 结果与讨论
2.1 F-CDs的形貌表征
图1-A是制备获得的F-CDs的TEM图像,显示F-CDs的形貌和尺寸均一。与之相应的粒径分布统计柱状图如图1-B所示,可见F-CDs的平均尺寸约2 nm。图1-C是单个F-CD的高分辨透射电镜(HRTEM)图像,其中碳核出现明显的晶格衍射条纹,晶面间距为0.19 nm,对应石墨化碳的(100)晶面,表明所合成的F-CDs具有较好的结晶性。
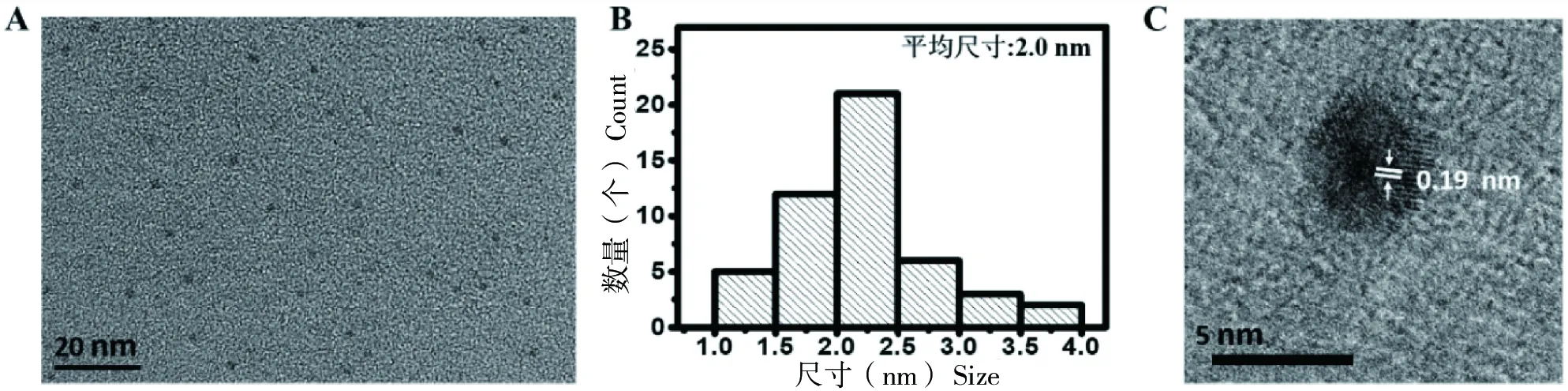
图1 F-CDs的TEM图(A),粒径统计图(B)和HRTEM图(C)
2.2 F-CDs的结构表征和荧光性质
图2-A为F-CDs的XPS总谱,表明F-CDs表面存在C、N、O和F 4种元素,其中F含量为1.78%(原子比),说明有少量F原子被掺杂到F-CDs的表面。图2-B是用高斯函数拟合分峰后的F1s谱图,在684.93 eV[17]和687.95 eV[18]出现两个峰,表明F-CDs表面掺杂的F原子存在两种化学键合方式,分别对应于半离子型C-F键和共价型C-F键。图2-C为F-CDs的UV-Vis吸收光谱(红线)和PL发射光谱(蓝线),显示在262 nm处有一个明显的吸收峰,在429 nm处还有一个较弱的吸收峰。其中262 nm处的吸收峰,可归因于F-CDs碳核中π-π*电子跃迁[19],而429 nm处的弱吸收峰可能与F-CDs表面基团或杂原子掺杂有关。与之相对应的,当激发波长为317 nm时,F-CDs出现两个PL发射峰:位于522 nm的主峰和位于472 nm的肩峰,说明F-CDs可能有两个发光中心。图2-D中F-CDs的水溶液在可见光下呈现基本透明,但在紫外光照射下发出明亮的黄绿色荧光。以硫酸喹啉为参比,采用定波长的方法(激发波长为360 nm),测得F-CDs的相对量子产率达45.6%。
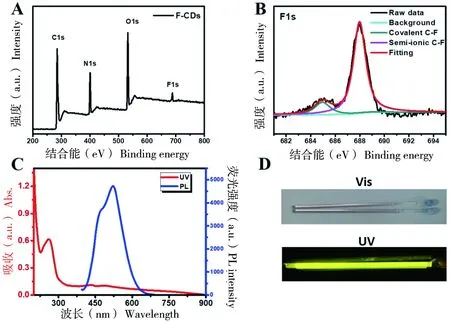
图2 F-CDs的XPS总谱(A)和F1s谱(B),F-CDs水溶液的UV-Vis吸收(C)和PL发射光谱及其在日光和紫外灯照射下的数码照片(D)Figure 2 The survey spectrum and (A) F1s XPS spectra (B)of the F-CDs, UV-Vis absorption and PL spectra (C)and the digital graphs of aqueous solution of F-CDs under daylight and UV-Vis light (D)
图3-A、B显示当激发波长从320 nm逐渐增大到460 nm时,F-CDs的荧光强度先升后降,并且发射波长红移,表明F-CDs的光致发光具有明显的激发光依赖性。图3-C、D显示在激发波长371 nm下,浓度依次为0.1、0.2、0.4、0.6、0.8、1.0、2.0、3.0和4.0 mg/mL的F-CDs水溶液的PL光谱图,可明显看出随着浓度的增加F-CDs的荧光强度先增后减,其发射波长也发生红移,但是当浓度最大增加到4.0 mg/mL时,出现了F-CDs荧光猝灭的趋势。图3-E是F-CDs浓度为200 μg/mL时,与Hela细胞共培养4 h后的激光共聚焦显微镜成像的图片,基于F-CDs优异的光学性能可以实现细胞显影。
2.3 F-CDs与HRP复合物分析
为探究F-CDs与HRP复合的可能性,采用PL光谱研究了F-CDs对12种金属离子的响应性(图4-A),其中阴离子均为氯离子,F-CDs的浓度为0.7 mg/mL,金属离子浓度均为0.9 mmol/L。结果显示F-CDs对Fe3+离子响应性最大(图4-A),当F-CDs与Fe3+离子复合后,其荧光强度下降幅度最大,表明F-CDs与Fe3+离子之间发生了电子转移,这可能是因为F-为强配体,与Fe3+离子形成稳定的复合物。由于HRP活性中心金属离子为Fe3+,因此F-CDs极有可能与HRP中Fe3+复合形成复合物。通过PL和UV-Vis光谱进一步探究了F-CDs与HRP复合前后荧光强度和紫外-可见吸收光谱的变化(图4-B、C)。图4-B是相同浓度下F-CDs、HRP和F-CDs/HRP的PL光谱,可以观察到HRP基本没有荧光,而且与F-CDs相比,F-CDs/HRP的荧光强度略有下降,说明F-CDs与HRP的确发生了一定程度的复合导致F-CDs/HRP的荧光降低,但F-CDs/HRP复合物仍具有较好的荧光性能。图4-C是相同浓度下F-CDs、HRP和F-CDs/HRP的UV-Vis吸收光谱,F-CDs在260 nm和HRP在402 nm分别有明显的吸收峰,而F-CDs/HRP复合物在260 nm和401 nm也出现两个明显的吸收峰,且强度较F-CDs和HRP均有所增强,这个结果进一步证明F-CDs与HRP形成了稳定的复合物。
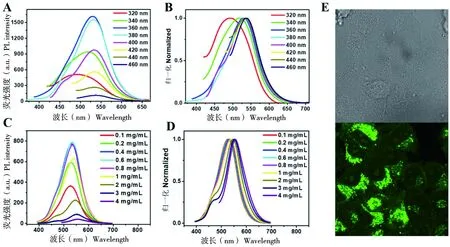
图3 F-CDs在不同激发波长(A、B)和不同浓度下的PL图及归一化图(C、D)和 F-CDs与Hela细胞共培养后的荧光显微镜成像图(E)Figure 3 PL spectra and normalized PL spectra of F-CDs at different excitation wavelengths (A, B)and different concentrations(C, D), fluorescence microscopy images of F-CDs co-cultured with Hela cells(E)
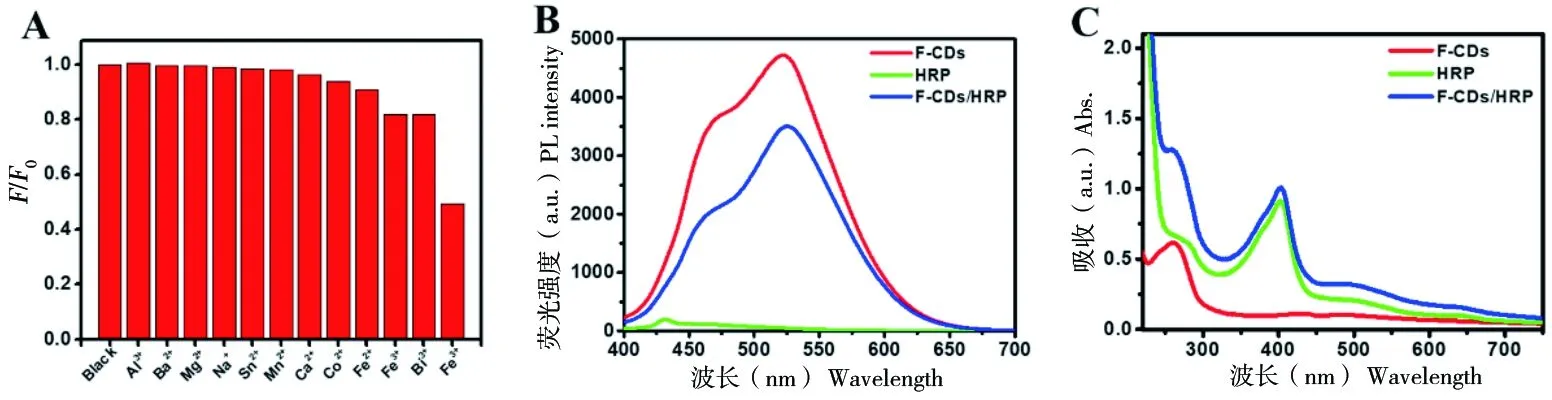
图4 F-CDs对金属离子响应图(A), F-CDs,HRP和F-CDs/HRP复合物的PL发射光谱(B)和UV-Vis吸收光谱图(C)Figure 4 PL response of F-CDs to various metal ions(A), the PL (B) and UV-Vis absorption spectra(C) of F-CDs, HRP and F-CDs/HRP
进一步研究了在较低温度如4 ℃下,H2O2对F-CDs/HRP复合物催化氧化ABTS的影响。当ABTS被氧化为ABTS自由基时,在417 nm附近有明显的吸收峰,且溶液会变成墨绿色,颜色的深浅由溶液中ABTS自由基的数量决定,故可通过溶液的显色程度来表示ABTS被氧化的程度。当加入H2O2的浓度较低时,F-CDs/HRP-ABTS混合溶液在417 nm处的吸光度值与H2O2的浓度基本成线性关系(图5-A),且线性拟合方程为:y=47.26x+0.0384(相关系数R2= 0.995),可定量分析溶液中H2O2的浓度。但随着加入H2O2的浓度越来越高,ABTS被完全氧化,此时H2O2浓度对吸光度的值就没有太大影响。

图5 在不同H2O2浓度下,F-CDs/HRP-ABTS混合溶液在417 nm处的UV-Vis吸收值,内插图为与之相对应的溶液显色情况(A), F-CDs,HRP和F-CDs/HRP催化氧化ABTS的动力学分析曲线(B)
在实验过程中发现,当ABTS和不同浓度的H2O2共存时,混合溶液未变色即ABTS未被氧化。再加入HRP和F-CDs/HRP复合物后,溶液均有不同程度的变色,且F-CDs/HRP-ABTS-H2O2溶液比同样条件下HRP-ABTS-H2O2溶液变色速度快,在此过程中H2O2可能起助引发剂的作用。F-CDs、HRP和F-CDs/HRP 3种物质催化氧化ABTS的动力学分析曲线结果(图5-B)表明,F-CDs没有催化氧化ABTS的能力,且F-CDs/HRP比HRP催化氧化ABTS的速度快,在此过程中F-CDs起保护HRP不变性进而保持HRP较高的催化活性的作用。图5-A中的内插图表明,可通过溶液显色程度来定性分析H2O2对F-CDs/HRP中HRP活性的影响,即可初步判断ABTS被氧化的程度。4 ℃并不是HRP催化的最佳温度,但在H2O2存在时F-CDs/HRP复合物仍然可以迅速氧化ABTS。
3 结论
采用水热法制备出尺寸均一且结晶性好的氟掺杂的F-CDs。F-CDs具有较好的光学性能,荧光发射具有激发光依赖性和浓度依赖性。研究还表明H2O2的量影响F-CDs/HRP催化氧化ABTS的程度。此外,4 ℃、有H2O2存在时,F-CDs/HRP仍具有活性来催化ABTS,可初步通过F-CDs/HRP-ABTS-H2O2溶液的显色程度定性判断F-CDs/HRP中HRP的活性情况。HRP与F-CDs形成复合物后不仅保持酶的活性,也具有一定的荧光性能。此工作结果为碳点下一步用于免疫荧光分析奠定了一定基础。

