青藏高原地区的青杨遗传多样性研究
张 雨, 王久利, 夏铭泽, 张发起
(1. 中国科学院 高原生物适应与进化重点实验室 中国科学院西北高原生物研究所, 西宁 810001;2. 中国科学院大学, 北京 100039; 3. 青海民族大学 生态环境与资源学院, 西宁 810007)
被称为“世界屋脊”和地球“第三极”的青藏高原,是世界上海拔最高和面积最大的高原[1]。它是全球生物多样性热点地区之一,也是我国植物资源重要的“基因库”。青杨隶属于杨柳科杨属,是我国特有的乡土树种[2],它生长迅速,材质优良,并且能较好地适应潮湿和寒冷的环境,对生态保护和环境恢复有着重要的价值[3]。青藏高原是青杨的主要分布区之一,拥有丰富而独特的杨树资源,为杨树的选育提供了有利条件[4-5]。
目前已有研究表明,分布在青藏高原东缘的青杨群体受到地理和空间的大尺度隔离,产生了基因流的隔离,具有中等偏上的遗传多样性水平[6]。利用叶绿体DNA序列开展谱系地理学研究,通过描述物种现存遗传分布格局和谱系关系可推测物种的冰期进化历史,揭示气候和环境变化对其生物地理分布格局的影响[7]。但当前研究仅利用ISSR和SSR开展遗传分析,并没有采用包含更丰富历史演化信息的分子标记(如cpDNA),对青杨的遗传多样性和历史演化分析是不完整的[6]。因此,本文选取cpDNA非编码区atpH-atpI和rbcL片段开展青杨的谱系地理学研究,分析该区域青杨的群体遗传结构和居群历史动态,揭示青杨在第四纪冰期的演化历史和现今生物地理分布格局的成因,为青杨的种质资源评价、遗传保护策略的制订等提供科学依据,并丰富对青藏高原地区生物演化历史的理解。
1 材料与方法
1.1 植物材料
植物材料采自青藏高原及其毗邻地区,共14个居群202个个体(表1)。此外,选取垂柳(SalixbabylonicaL.;凭证号Chen2015601,101°45′N,36°37′E,海拔2290 m)作为外类群。采集生长良好的幼嫩叶片装入DNA材料袋后置于硅胶中干燥,并带回实验室于-20 ℃冰箱保存备用。凭证标本存于青藏高原生物标本馆(HNWP)。

表1 青杨居群采集信息
1.2 基因组DNA提取与PCR扩增
青杨基因组DNA采用N96植物基因组DNA提取试剂盒(TIANGEN,北京)提取。采用叶绿体DNA通用引物对所有个体的atpH-atpI和rbcL片段进行PCR扩增[8-9]。PCR反应体系为50 μL:5.0 μL的10×PCR Buffer(含1.5 mmol/L MgCl2),0.5 μL 10 mmol/L dNTP,正向和反向引物各2.0 μL(5 pmol/L),DNA聚合酶(TaKaRa,大连)2 μL,20~45 ng模板,用ddH2O补足50 μL。PCR扩增反应程序:94 ℃预变性4 min;94 ℃加热变性70 s,52 ℃退火50 s,72 ℃延伸40 s,30个循环;最后72 ℃延伸10 min。PCR扩增产物用1.0%琼脂糖凝胶电泳进行电泳检测,用ABI 3730xl型基因测序仪(Applied Biosystems,加拿大)正反向测序。
1.3 数据分析
利用CLUSTAL X和Sequencher v 5.4(http://www.genecodes.com)对测序序列进行对位排列,并进行手工校正[10]。DNA序列的碱基组成由MEGA 6.0.4软件统计。通过DnaSP V 5[11]统计cpDNA联合序列的变异位点和简约信息位点,并确定单倍型。在Arlequin软件包中,分别计算单倍型多样性(He)、核苷酸多样性(π)和中性检验中的Tajima′s D,并完成歧点分布分析。运用PERMUT软件计算居群内平均遗传多样性(hs)、总遗传多样性(ht)、居群间遗传分化系数(Gst)和(Nst),并用U-统计方法对Gst和Nst进行1000次重复置换检测。通过Arlequin软件包中的分子变异分析(AMOVA)检测青杨的遗传变异水平(居群内/间),并对单倍型分布的固定指数Fst进行1000次重复置换检测评价[12]。以垂柳作为外类群,利用PAUP*4.0软件构建系统演化树[13]。单倍型之间的网络关系通过软件NETWORK以最大简约法为原则构建单倍型中央连接网状图[14]。
2 结果与分析
2.1 遗传多样性
青杨所有个体的atpH-atpI和rbcL片段经PCR扩增、测序后,利用CLUSTAL X软件对位排列后的长度为1514 bp,共鉴定出13个单倍型(H1-H13;GenBank注册号:KU663538-KU663554)。其中,单倍型H2出现的频率最高,有82个个体检测出该单倍型,居群YY、LJ、XG、GH和ND等都仅检测到这种唯一单倍型(表 2)。
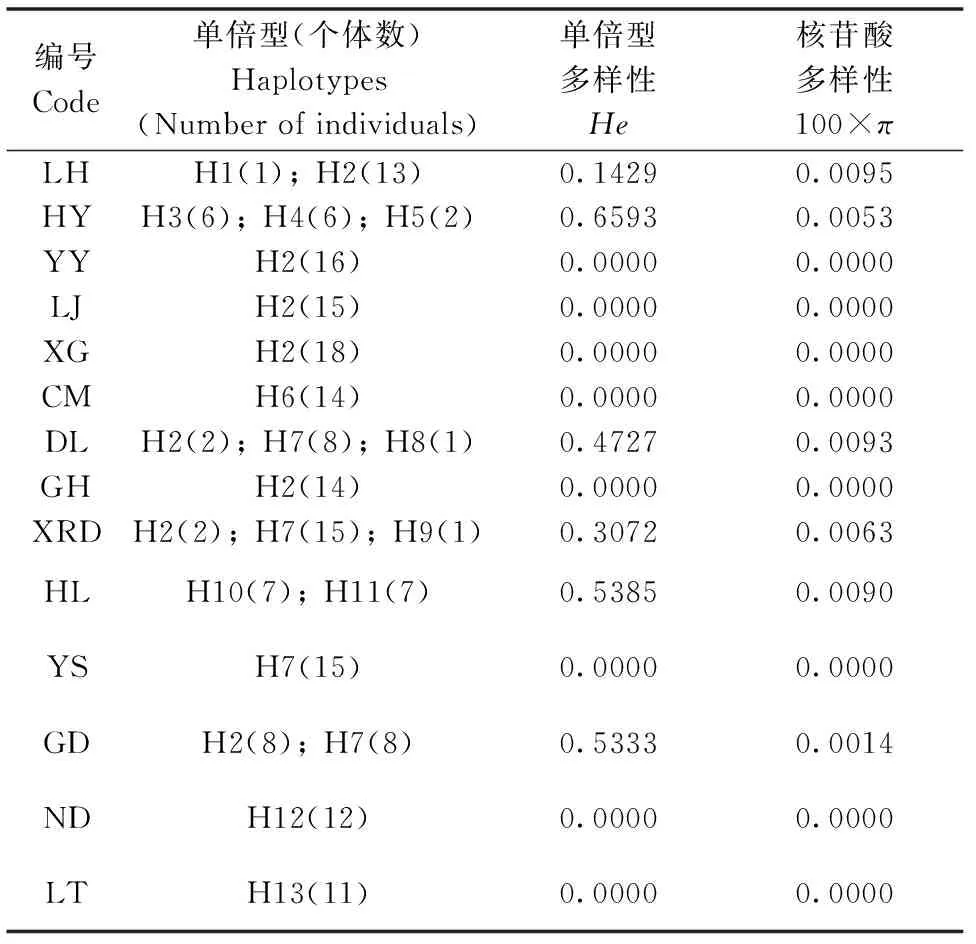
表2 青杨14个居群的单倍型组成、单倍型多样性和核苷酸多样性
2.2 居群遗传结构特征
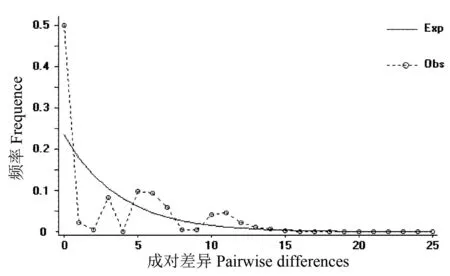
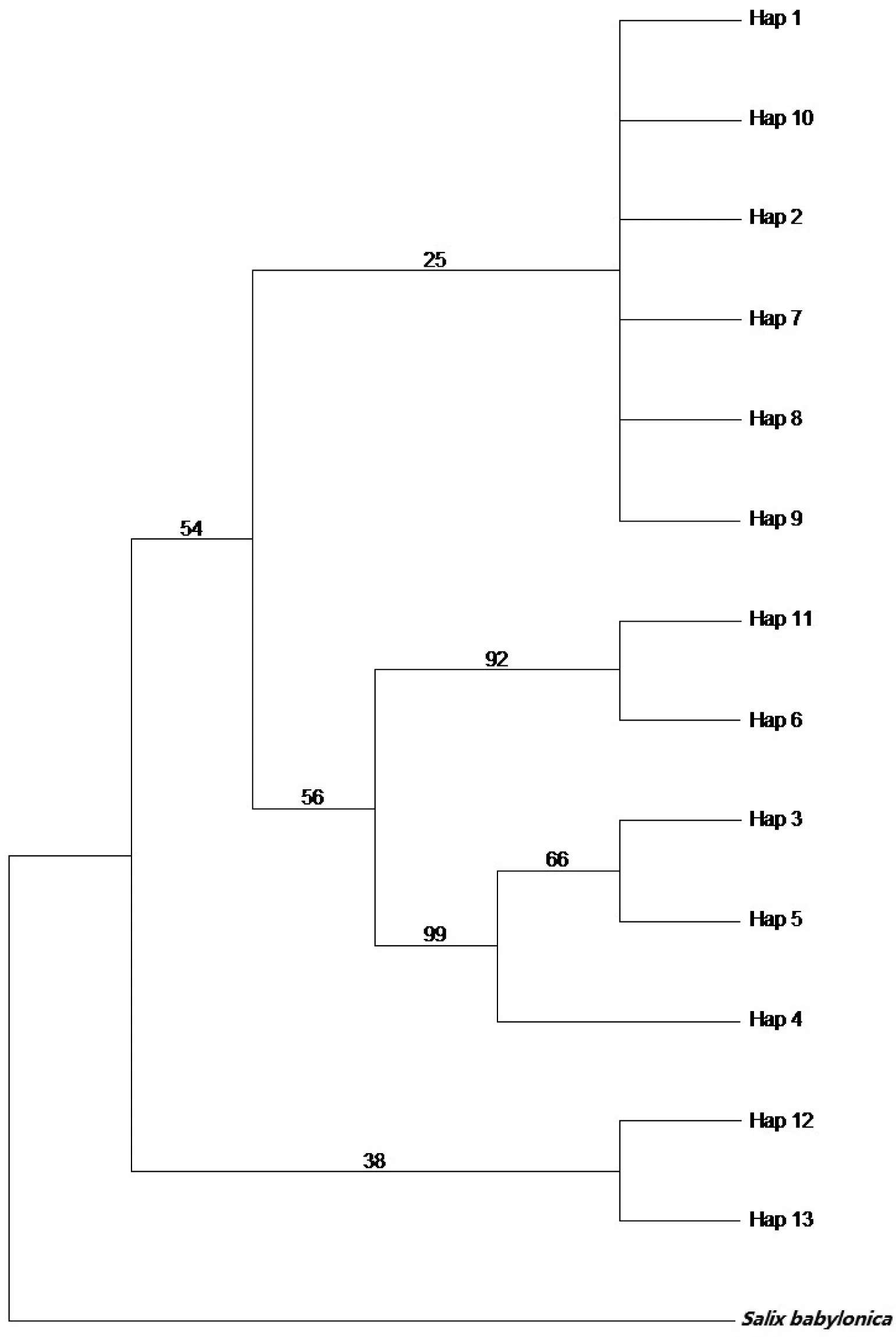
基于cpDNA联合序列13个单倍型的PERMUT分析显示,居群内平均遗传多样性Hs为0.255,总遗传多样性Ht为0.814。而居群间遗传分化系数Nst(0.662) 表3 基于2个cpDNA片段13种单倍型对青杨15个居群的分子变异分析结果 利用atpH-atpI及rbcL片段对青杨的202个个体进行歧点分布分析后,得到的分布曲线为多峰曲线(图1),与快速扩张模型相悖,说明在较长的时间内居群没有发生近期快速扩张,处于一种比较稳定的状态,中性检验的结果[Tajima′sD=-0.443 86(P>0.10)]不显著,符合中性假说,因此也支持歧点分布分析得出的结论。 图1 青杨cpDNA联合片段202株个体进行歧点分布分析的结果 从最大简约树可看出青杨14个居群的13个单倍型分化为3个主要分支(图2):单倍型H12、H13构成第一分支,分别固定于ND、LT这两个居群中;分支二包括单倍型H1、H10、H2、H8、H7和H9,固定在LH、YY、LJ、XG、DL、GH、XRD、HL、YS及GD这10个居群之中;分支三包括单倍型H11、H6、H3、H5和H4,其中H11、H6构成一个小的分支,分别固定在居群ND、LT中,而单倍型H3、H5及H4聚为另外一个小分支,共同固定在HY居群中,且此两个小分支的支持率较高(分别为92%和99%)。单倍型网状关系图(图3)与系统进化树的拓扑结构类似,该图主要以单倍型H2为中心形成了发散状的系统结构,但是比系统进化树所示结果更加清晰明了。 图2 青杨cpDNA联合序列13个单倍型最大简约法分析结果 图3 青杨cpDNA联合序列13个单倍型中央连接网状图 与青藏高原地区多种植物的研究结果一致[15-18],青杨也呈现为较高的总遗传多样性和较低的居群内平均遗传多样性(Ht=0.814;Hs=0.255)。这表明叶绿体基因组在各个居群之间分化较为明显,且绝大多数居群内的单倍型较为单一。在青杨14个居群中,有8个居群只有一种单倍型,另外6个居群表现出单倍型多态性。此外,居群间遗传分化系数Nst(0.662) 近年来青藏高原地区的植物谱系地理学研究主要呈现出两种不同的谱系地理模式,一是“边缘避难所”模式,即冰期高原台面的种群退缩到高原边缘的避难所,其中祁连圆柏(Juniperusprzewalskii)[21]、瑞香狼毒(Stellerachamaejasme)[22]、长花马先蒿(Pedicularislongiflora)[23]等植物均符合该模式。另一种是“微型避难所”模式,冰期高原面的种群退缩到微型避难所(或本地避难所),其中海仙报春(Primulapoissonii)[16]、西藏圆柏(Sabinatibetica)[24]、露蕊乌头(Aconitumgymnandrum)[25]等植物符合该模式。在边缘避难所模式中,植物的遗传多样性水平一般呈现从高原边缘向高原台面递减的趋势[21],青杨的遗传分布模式显然不符。青杨遗传多样性和核苷酸多态性较高的居群零星分布于本研究区域,且特有单倍型的分布也是如此,遗传分布和地理分布之间没有显著相关性,这可能是由于在研究区域内存在多个微型避难所所致。遗传多样性较高居群如LH、HY、DL、HL、GD和XRD,主要分布在祁连山脉和横断山脉地区,这两个地区可能是青杨的冰期微型避难所,其中横断山区也是青藏高原很多植物的重要避难所,是冰期后植物物种回迁和扩散的发源中心[26]。第四纪末次冰期后青藏高原地区的气候和地质条件相对稳定,有利于种群从避难所向周边区域扩散,然而青杨种群主要分布于唐古拉山脉、祁连山脉和横断山脉等地形、地势复杂的高山地区,导致种群扩散受限,基因流水平也较低(Nm=0.12)。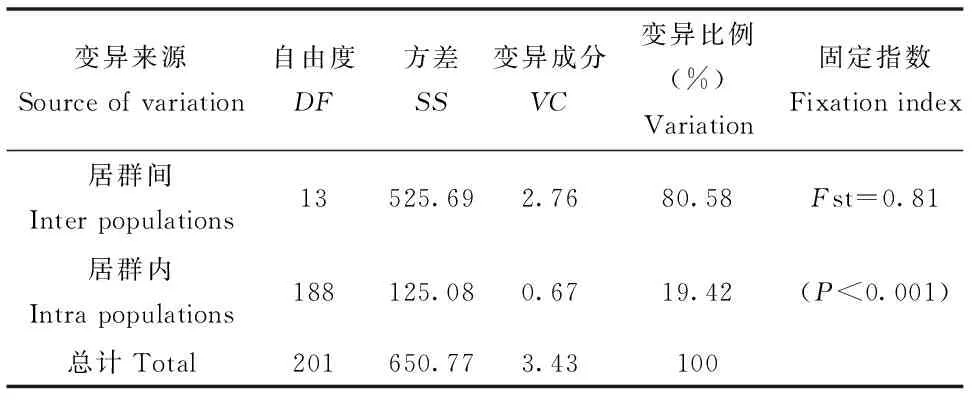
2.3 居群历史动态
2.4 单倍型间的系统发育关系

3 讨论与结论
3.1 遗传多样性和遗传结构
3.2 冰期避难所

