基于正交设计优化兰州百合鳞片埋培环境条件
巨秀婷 梁银娟 唐楠 唐道城 曹彩霞 刘高峰


摘要:【目的】探究兰州百合鳞片基质埋培过程中不同鳞片层次、催培温度及基质湿度对埋培效果的影响,为兰州百合进行规模化快速繁殖提供适宜的环境参数。【方法】以兰州百合鳞片为试验材料,选用L9(34)正交设计表进行不同催培温度、基质湿度、鳞片层次处理,以期明确兰州百合鳞片催培繁殖小鳞茎适宜的环境参数。通过催培过程中鳞片腐烂率、鳞片分化率、小鳞茎分化数、鳞片生根率、小鳞茎生根数及其横径(分级指标)等的观测与分析,探究基质埋培对不同层次鳞片形成小鳞茎的影响。【结果】催培初期,A1B3C3處理腐烂率最高,达18.67%,进入3周时,所有处理的平均腐烂率下降至1.33%。随着鳞片腐烂率下降,鳞片分化率开始逐渐上升,进入小鳞茎生长高峰期,各处理的鳞片分化率为44.16%~86.52%,A1B1C1处理在催培3周时小鳞茎分化数达最大值,为238.67个。除A1B3C3、A2B3C1和A3B3C2处理外,其余各处理的鳞片生根率为20.58%~63.92%。催培结束时,A1B2C2处理二级小鳞茎最多,达53粒/30片;A1B1C1处理的一级小鳞茎最多,为28粒/30片;A3B1C3处理只有三级小鳞茎,且小鳞茎数量仅10粒/30片。催培第3周是兰州百合鳞片埋培的关键时期,也是小鳞茎根系发育的初期。不同处理的催培环境均不同程度的影响着鳞片分化情况,综合各项指标的极差值大小,确定影响小鳞茎形成的主要因素为温度,其次为基质相对水含量,鳞片层次影响最小。9个处理中A1B1C1(外层鳞片+25 ℃+60%基质相对水含量)小鳞茎生长效果最佳,催培结束时鳞片腐烂率为0.33%、鳞片分化率为96.67%、小鳞茎分化数为231.67个、鳞片生根率89.67%、小鳞茎生根数为319.33条。【结论】兰州百合鳞片基质埋培过程中不同层次鳞片在不同环境条件下形成小鳞茎的质量和数量均不同,繁殖效率均有差异。鳞片基质埋培繁殖适宜的环境参数为外层鳞片+25 ℃+60%基质相对水含量,该技术参数可在生产实践中推广应用。
关键词: 兰州百合;鳞片;基质培养;正交设计;小鳞茎
Abstract:【Objective】In order to provide suitable environmental parameters for large-scale and rapid propagation of Lilium davidii var. unicolor, the effects of three factors, scale layer, temperature and matrix humidity, on the effect of L. davidii scale culture by burying substrate were studied. 【Method】L. davidii scale as the experimental material,L9(34) orthogonal design was used to treat different expediting culture temperatures,matrix humidity and scale levels,in order to determine the appropriate environmental parameters for L. davidii scale culture and propagation of bulblets. Through the observation and analysis of the indexes such as the scale decay rate, scale differentiation rate, number of bulblets differentiation, scale rooting rate, number of bulblet rooting and transverse diameter(grading indicator) in the process of expedi-ting culture,the effects of substrate burying culture on the formation of small bulbs by different layers of scales was explored. 【Result】In the early stage of expediting culture, the decay rate of A1B3C3 treatment was the highest, reaching 18.67%. In the third week, the average decay rate of all treatments decreased to 1.33%. With the decline of the decay rate of scales, the differentiation rate of scales began to increase gradually, and entered the peak growth period of bulblet. The differentia-tion rate of scales in each treatment was 44.16%-86.52%. The number of bulblets in A1B1C1 treatment reached the maximum at the third week, which was 238.67. Except for A1B3C3, A2B3C1 and A3B3C2, the rooting rate of scales was 20.58%-63.92%. At the end of accelerated culture, the number of second-grade bulblets in A1B2C2 treatment was 53 bulblets/30 pieces; the number of first-grade bulblets in A1B1C1 treatment was the most, which was 28 bulblets/30 pieces; in A3B1C3 treatment, there were only three-grade bulblets, and the number of bulblets was only 10 bulblets/30 pieces. The third week of accelerated culture was the key period of L. davidiis cale burying culture. At the same time, this stage was also the initial stage of bulblet root development. The results showed that the differentiation of scales was affected by the culture environment of different treatments. According to the range value of each index, the main factor affecting the formation of bulblet was temperature, followed by relative water content of matrix, and the effect of scale level was the least influential. Among the nine treatments, the growth effect of A1B1C1(outer layer scale+25 ℃+60% relative water content of substrate) was the best,at the end of the culture, the decay rate of scales was 0.33%, the differentiation rate of scales was 96.67%, the differentiation number of bulblets was 231.67 bulblets, the rooting rate of scales was 89.67%, and the rooting number of bulblets was 319.33 bulblets. 【Conclusion】In the process of cultivating the scale of L. davidii by burying substrate, the quality and quantity of small bulbs formed by different scales under different environmental conditions are different, and the reproduction efficiency is different. The suitable environmental parameters for the growth of scale media are the external scale+25 ℃+60% relative water content of the substrate, which can be widely used in production experiments.
Key words: Lilium davidii var. unicolor; scale; matrix culture; orthogonal design; bulblet
0 引言
【研究意义】兰州百合(Lilium davidii var. unico-lor)是多年生鳞莖草本植物,百合科百合属川百合的变种,其鳞茎富含糖类、蛋白质和淀粉等营养成分,同时含有百合苷等多种药用成分及维生素、氨基酸等;鳞片质地细腻,味甜鲜美,又名兰州甜百合,具有良好的营养滋补功效。近年来随着兰州百合在全国生产面积的不断扩大,生产区域得到了快速发展,但产量和品质却急剧下降,造成了生产面积增加而总产量和优质商品不增加的现象,导致价格持续上涨。因此,研究兰州百合优质种源繁殖技术,从而提高兰州百合产量和品质成为生产实践中急需解决的问题。【前人研究进展】近年来针对兰州百合的研究主要在代谢机理(孙红梅等,2011)、养分管理(林玉红等,2013)、组织离体快繁(韦莉萍等,2014)、营养成分分析(王乙婷,2016)、遗传多样性(崔文娟等,2018)及栽培繁育(黄钰芳等,2018)等方面。胡秉芬(2003)在兰州百合鳞片繁殖小鳞茎形成过程的研究中表明小鳞茎的形态发生过程属于器官发生,且在不同的扦插基质中分化能力不同。郑爱珍和张峰(2004)提出百合鳞片繁殖法常见的有苗床扦插法、室内砂培法和鳞片气培法。郝瑞杰等(2012)认为百合鳞茎各层鳞片能表现出不同的繁殖效率,NAA浓度为0.5 g/L、浸泡2 min、扦插深度为5 cm,更有利于兰州百合的鳞片扦插繁殖。柳文慧(2012)在对百合鳞茎发育过程的研究中提出影响扦插鳞片生根和小鳞茎形成的重要气象因子是温度。黄钰芳等(2018)认为连作条件下多种次生代谢物引起的自毒作用是导致兰州百合连作障碍产生的主要原因之一。【本研究切入点】兰州百合以无性繁殖为主(李谋强等,2016),其中鳞片是无性繁殖中最常用和繁殖系数最高的材料。基于前人研究资料(王刚等,2002;韦莉萍等,2014;段四喜等,2019),目前兰州百合种源繁殖以鳞片组培快繁的研究居多,而鳞片基质培养的研究较少,对鳞片繁殖小鳞茎最佳环境的筛选鲜见报道。【拟解决的关键问题】从鳞片层次、催培温度和基质湿度3个因素探究兰州百合鳞片基质埋培过程中环境因子对埋培效果的影响,以期得到最佳温湿度组合,并筛选最佳鳞片层次,为兰州百合进行规模化快速繁殖提供适宜的环境参数,为提升兰州百合的种源质量与数量提供理论依据和技术支持。
1 材料与方法
1. 1 试验材料
选用甘肃省七里河地区种植的色泽洁白、品相良好饱满、春季采挖的兰州百合鳞茎为试验材料,剥除最外层带病斑、已污染、不洁净的鳞片,由外向内依次采集,1~2层为外层鳞片,3~4层为中层鳞片,5~7层为内层鳞片。各层次鳞片用0.3%的50%甲基硫菌灵液浸泡30 min后,稍加控水后备用。埋培基质选用进口育苗草炭(Floragard substrate)。
1. 2 试验设计
试验于2019年4—6月在青海省园林植物与观赏园艺重点实验室完成。采用L9(34)正交表进行3因素3水平的正交试验组合,选用3个层次的鳞片(A:外、中、内),在3种恒温(B:25、20和15 ℃)及3种不同基质相对水含量(C:60%、70%和80%)状态下,进行7周(2019年4月29日—6月9日)催培试验(表1)。每处理选取备用的鳞片400片和基质按照1∶1的体积比混合均匀放置在催培盆中,在人工气候培养箱内进行鳞片催培。试验过程中对各处理的基质水含量逐周进行测定,控制基质水含量在相应的水平,以保证在稳定的环境条件下得到准确的观测指标。
1. 3 测定指标及方法
催培开始后每7 d每处理随机选取100片鳞片进行观测,重复3次取平均值,记录数据。观测指标为鳞片腐烂率、鳞片分化率和小鳞茎分化数、鳞片生根率和小鳞茎生根数及其横径。
鳞片腐烂率(%)=腐烂鳞片数/100片×100
鳞片分化率(%)=萌出小鳞茎的鳞片数/100片×100
鳞片生根率(%)=长根鳞片数/100片×100
小鳞茎质量评价:每个处理随机取30片鳞片,并从鳞片上分离小鳞茎,取小鳞茎中值(横径),将小鳞茎平均直径(横径)按一级(>7.0 mm)、二级(3.5~7.0 mm)、三级(<3.5 mm)进行分级;并计算每30片中各级小鳞茎的数量(粒/30片)。
1. 4 统计分析
利用Excel 2010进行数据整理;利用SPSS 17.00进行方差分析与新复极差法(SSR)检验。极差分析分别统计9个处理的鳞片腐烂率、鳞片分化率、小鳞茎分化数、鳞片生根率和小鳞茎生根数,计算出不同因素相同水平的总和(K)和平均值(k),以及相同因素不同水平的极差(R)。
2 结果与分析
2. 1 不同处理对鳞片腐烂率的影响
9个处理的兰州百合鳞片在催培过程中的腐烂率变化情况如图1所示。催培开始1周时,腐烂现象较严重,A1B3C3处理腐烂率最高,达18.67%,A2B2C3处理腐烂率最低,为4.00%;催培2周时除A1B2C2处理外,其余处理的鳞片腐烂率均有所下降,平均腐烂率从1周的9.59%降到5.52%;进入3周时,平均腐烂率下降到1.33%。随着催培时间的延长,腐烂率较第3周变化幅度不大,平均为1.48%,接近平稳状态,直至催培结束。可见催培前3周是腐烂现象高发时期,伴随着鳞片开始分化小鳞茎,各处理虽有不同程度的腐烂现象出现,但对催培效果无影响。
2. 2 不同处理对鳞片分化率和小鳞茎分化数的影响
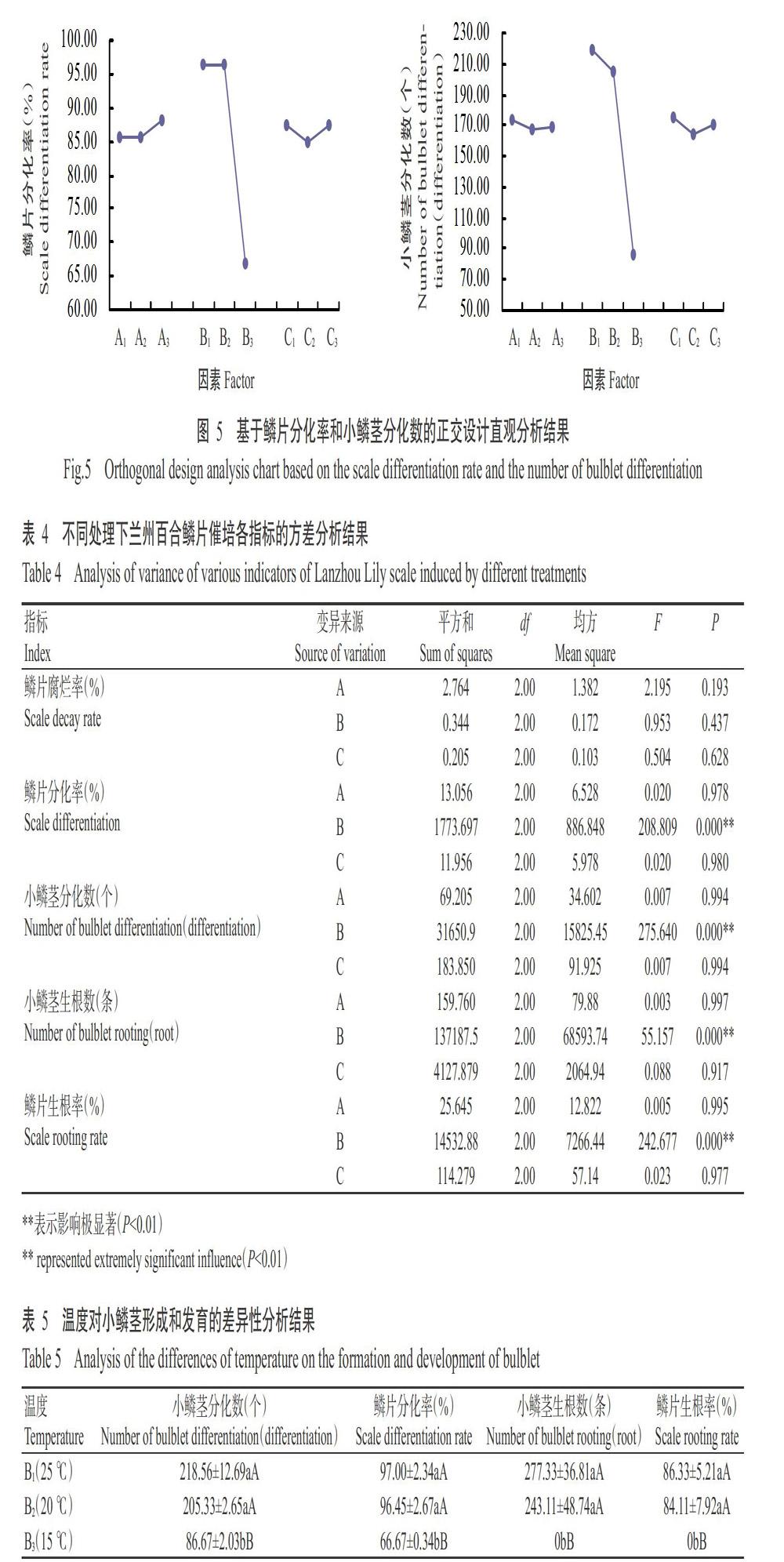
催培2周时鳞片基部位置出现白色小突起,以此作为鳞片始分化和计算鳞片分化率的标准,此时鳞片分化率达30%,为小鳞茎形成期;催培时间在2~3周时,鳞片分化率达50%,进入小鳞茎生长旺盛时期;催培3周后,鳞片分化率大于70%,进入小鳞茎生长高峰期。如图2所示,A1B3C3、A2B3C1和A3B3C2处理小鳞茎分化形成缓慢,至4周时小鳞茎数量才开始上升,到催培5周时数量趋于平稳状态;其他处理均在2~3周时小鳞茎数快速上升,A1B1C1处理在催培3周时小鳞茎数达最大值(238.67个);随着催培时间的增加小鳞茎数趋于平稳状态,进入小鳞茎生长高峰期后,A1B1C1处理在7周时分化形成的小鳞茎数仍最多,为231.67个。从催培开始至结束,9个处理的鳞片分化率为44.16%~86.52%。可见,鳞片分化率和小鳞茎分化数直接决定催培效果,催培环境的变化均不同程度影响鳞片分化情况。
2. 3 不同处理对鳞片生根率和小鳞茎生根数的影响
根系发育是衡量小鳞茎质量的一个重要因素,关系到催培结束后进入看护培养阶段出苗的整齐度。由图3可知,从催培开始至结束,9个处理中除A1B3C3、A2B3C1和A3B3C2外,其余处理在催培3周后鳞片上一致开始长根,且随着催培时间的延长,小鳞茎生根数不断增加,为31.63~195.17条,鳞片生根率为20.58%~63.92%;催培7周时,A1B1C1处理小鳞茎生根数最多,达319.33条,A1B2C2处理小鳞茎生根数最少,为187.00条。因此,催培第3周是根系分化的始期,也是根系分化与否的关键期。
2. 4 不同处理的小鳞茎发育质量
小鳞茎大小可反映不同层次鳞片的分化能力,同时催培环境对分化的小鳞茎大小有一定影响。如图4所示,不同处理分化的小鳞茎大小均有差异,A1B2C2处理的小鳞茎最多,为76粒/30片,其中二级小鳞茎最多,达53粒/30片;A1B1C1处理的一级小鳞茎最多,为28粒/30片;而A3B2C1和A3B3C2处理的三级小鳞茎占绝大多数,一级和二级小鳞茎很少;A3B1C3处理只有三级小鳞茎,且小鳞茎数量仅10粒/30片。
2. 5 正交试验极差分析
对催培结束时统计各处理的催培指标(表2)进行极差分析(表3),通过R值比较此次试验的主次因素,一般情况下,R值越大说明该因素对指标影响程度越大。鳞片分化率各影响因素作用程度为温度>鳞片层次>基质相对水含量,小鳞茎分化数、小鳞茎生根数和鳞片生根率各因素影响程度均为温度>基质相对水含量>鳞片层次。而对鳞片腐烂率而言,在本研究中腐烂率应越低越好,R值越小说明影响程度越大,各因素影响程度为基质相对水含量(1.03)>鳞片层次(1.33)>温度(1.40)。因此综合各项指标的R值大小,确定影响小鳞茎形成的主要因素为温度,其次为基质相对水含量,鳞片层次影响最小。
针对各项指标的k得到最佳处理组合分别是A3B1C3(鳞片腐烂率)、A1B1C1(小鳞茎分化数)、A3B1C1(小鳞茎生根数、鳞片分化率、鳞片生根率)(表3)。鳞片催培效果最终由鳞片繁殖出的小鳞茎数量决定,因此鳞片分化率和小鳞茎分化数是催培繁殖的决定性指标。根据两个指标的正交设计直观分析图(图5),得到3个环境因素的最佳水平组合为A3B1C1和A1B1C1。
2. 6 正交试验方差分析
方差分析结果(表4)表明,温度除对鳞片腐烂率的影响差异不显著(P>0.05,下同)之外,其对小鳞茎分化数、小鳞茎生根数、鳞片分化率及鳞片生根率都具有极显著影响(P<0.01,下同)。鳞片层次和基质相对水含量对5个观测指标的影响均不显著。
通过对不同温度下各指标的新复极差法(SSR)检验(表5),发现15 ℃与25、20 ℃下的处理呈极显著差异,25 ℃与20 ℃处理间无显著差异。因此,温度因素的3个水平中,以25 ℃下催培效果最好,其次是20 ℃。
2. 7 综合评价
根据鳞片催培繁殖的主效因子和大面积催培的混合鳞片综合考虑,认为选择B1C1为最佳处理组合,即在25 ℃、60%基质相对水含量条件下,催培的小鳞茎数量多、鳞片分化率和鳞片生根率高(图6)。在鳞片分层次催培中,由于A3B1C1和A3B3C1在该试验中的正交设计表中未设计出,因此得出最佳处理组合为A1B1C1,即外层鳞片+25 ℃+60%基质相对水含量的催培效果最好,可作为催培处理方案。
3 讨论
杨春起(2016)研究表明,按照影响鳞片催培效果的主次因素,温度是影响小鳞茎繁殖的最关键因素。选用鳞片进行扦插繁殖时环境温度应控制在20~25 ℃。本研究中25 ℃处理的小鳞茎生长、生根情况最佳,15 ℃表现最差。温度过低不利于小鳞茎萌发,且15 ℃低于百合小鳞茎萌发的最低温度;同时温度过低也不利于生根,生根率和根数决定着后期小鳞茎能否继续生长,也是小鳞茎移栽驯化的关键。
整个催培期所有处理均有不同程度的腐烂现象并在催培第1周时出现腐烂率最高值,其主要原因可能是兰州百合鳞片剥离时产生了不可避免的伤口,催培初期鳞片伤口未及时愈合,容易感染病原菌从而使鳞片出现腐烂、变坏现象。腐烂率最高的A1B3C3处理中鳞片层次为外层,分析认为外层鳞片在鳞茎最外面,最易受到机械损伤,同时外层鳞片营养物质丰富(刘仁坤,2010),为病原菌的繁殖提供有利條件。本研究中催培温度范围在15~25 ℃,基质水含量范围在60%~80%,均为病原菌生长的适宜温度和湿度,以上均是造成鳞片出现腐烂现象的直接原因。鳞片的腐烂率伴随着催培时间的延长出现变化,第3周进入小鳞茎分化高峰期时,腐烂率平均稳定在1.48%,直至催培结束。
不同层次鳞片分化小鳞茎的能力和数量均有差异。在本研究中小鳞茎增殖系数排序是外层鳞片>中层鳞片>内层鳞片,该结果与前人在百合组织培养繁殖过程中筛选出的外层鳞片为初代培养的最佳外植体的结果一致(汪有良,1995;王刚等,2002)。外层鳞片淀粉含量高,且从外界环境中吸收养分和水分的能力强于中层鳞片和内层鳞片。
本研究中催培结束时(7周),各项指标表现最好的处理分别是:内层+25 ℃+80%基质相对水含量处理(A3B1C3)的鳞片腐烂率最低,数值接近0;内层+20 ℃+60%基质相对水含量处理(A3B2C1)的鳞片分化率最高,为99.00%,生根率第二高,为88.00%;外层+25 ℃+60%基质相对水含量处理(A1B1C1)的小鳞茎分化数最高,达231.67个,且小鳞茎生根数最多,达319.33条;结合催培效果分析以上4个处理,内层+25 ℃+80%基质相对水含量处理(A3B1C3)虽然腐烂率最低,但对繁殖效果进行评价时腐烂率越低不能决定催培效果越好,因此腐烂率这一指标参考价值不大。极差分析得到两个最佳组合(A1B1C1和A3B1C1),而内层+25 ℃+60%基质相对水含量处理(A3B1C1)未出现在正交设计中。综合催培效果和极差分析两方面结果,评价得出本研究的最佳处理组合确定为外层+25 ℃+60%基质相对水含量(A1B1C1)。在最佳组合中,小鳞茎形成、发育分为形成和体积膨大两个阶段,第一阶段约2周,决定着鳞片分化率和分化小鳞茎的数量;第二阶段大约5周,决定着小鳞茎分化后的发育质量,包括内部鳞片分化和根系分化与发育。
4 结论
在兰州百合鳞片基质埋培过程中不同层次鳞片在不同环境条件下形成小鳞茎的质量和数量均不同,繁殖效率均有差异。鳞片基质埋培繁殖适宜的环境参数为外层鳞片在25 ℃的催培温度下、埋培在60%水含量的基质环境中,可得到最佳的繁殖效果。该结论可为兰州百合工厂化催培繁殖提供技术参数,得到的最佳参数组合可在实际生产中推广应用。
参考文献:
崔文娟,林玉红,石有太,欧巧明,罗俊杰. 2018. 兰州百合(Lilium davidii var. willmottiae)遗传多样性和遗传结构[J].中国沙漠,38(6): 1267-1274. [Cui W J,Lin Y H,Shi Y T,Ou Q M,Luo J J. 2018. Genetic diversity and genetic structure of cultivated Lilium davidii var. willmottiae po-pulations[J]. Journal of Desert Research,38(6): 1267-1274.]
段四喜, 徐春莲, 汤王外, 和寿星. 2019. 2种因素对兰州百合继代组培苗生长的影响[J]. 江西农业学报,31(7):45-50. [Duan S X,Xu C L,Tang W W,He S X. 2019. Effects of two factors on growth of Lanzhou Lily(Lilium brownii) with tissue subculture seedlings[J]. Acta Agriculturae Jiangxi,31(7):45-50.]
郝瑞杰,杜永军,李晶. 2012. 兰州百合鳞片扦插繁殖效率研究[J]. 北方园艺,(23): 65-67. [Hao R. J,Du Y J,Li J. 2012. Study on efficiency of scale cutting propagationg of Lilium davidii var. unicolor[J]. Northern Horticulture,(23): 65-67.]
胡秉芬. 2003. 兰州百合鳞片繁殖及小鳞茎形成过程的研究[D]. 兰州:西北师范大学. [Hu B F. 2003. The study about scale propagation of Lan Zhou Lily and the forming process of small bulbs[D]. Lanzhou: Northwest Normal University.]
黄钰芳,张恩和,张新慧,王惠珍,王琦,刘青林,石雨仟.2018. 兰州百合连作障碍效应及机制研究[J]. 草业学报,27(2): 146-155. [Huang Y F,Zhang E H,Zhang X H,Wang H Z,Wang Q,Liu Q L,Shi Y Q. 2018. Problems associated with continuous cropping of Lilium davidii var.unicolor[J]. Acta Prataculturae Sinica,27(2):146-155.]
李谋强,陈君良,黄彦玮,边小荣,叶树辉,师桂英. 2016. 不同海拔区兰州百合(Lilium davidii. var. unicolor)栽培群体遗传多样性[J]. 中国沙漠,36(4): 1267-1274. [Li M Q,Chen J L,Huang Y W,Bian X R,Ye S H,Shi G Y. 2016. Genetic diversity of cultivated populations of Lilium davidii. var. unicolor at different altitudes[J]. Journal of Desert Research,36(4): 1267-1274.]
林玉紅,石有太,崔文娟,欧巧明,王方,王炜,罗俊杰.2013. 不同肥料配比对旱地兰州百合产量、品质及养分累积的影响[J]. 干旱地区农业研究,31(5): 186-190. [Lin Y H,Shi Y T,Cui W J,Ou Q M,Wang F,Wang W,Luo J J. 2013. Effects of different fertilization ratio on yield,quality and nutrient accumulation of Lanzhou lily in dryland[J]. Agricultural Research in the Arid Areas,31(5): 186-190.]
刘仁坤. 2010. “索邦”百合鳞片扦插繁殖技术研究[J]. 安徽农业科学,38(31): 17419-17420. [Liu R K. 2010. Cutting propagation technique of Lilium orential ‘sorbonne[J]. Journal of Anhui Agricultural Sciences,38(31): 17419-17420.]
柳文慧. 2012. 百合鳞茎发育过程中维管束结构及淀粉代谢研究[D]. 沈阳:沈阳农业大学. [Liu W H. 2012. Study on structure of vascular bundle and starch metabolism of lily bulb during bulb development[D]. Shenyang: Shenyang Agricultural University.]
孙红梅,何玲,王微微,王春夏,李天来. 2011. 兰州百合鳞茎可溶性酸性转化酶活性检测体系的建立[J]. 园艺学报,38(6):1197-1204. [Sun H M,He L,Wang W W,Wang C X,Li T L. 2011. Establishment of detection system for soluble acid invertase activity in Lilium davidii var. unico-lor Bulb[J]. Acta Horticulturae Sinica,38(6): 1197-1204.]
王刚,杜捷,李桂英,梁万福,幸亨泰. 2002. 兰州百合和野百合组织培养及快速繁殖研究[J]. 西北师范大学学报(自然科学版),38(1): 69-71. [Wang G,Du J,Li G Y,Liang W F,Xing H T. 2002. Study on tissue culture and clonal propagation of Lilium davidii var. Unicolor(Hoog) Cotton and Lilium davidii F.E. Brown ex Mielleze[J]. Journal of Northwest Normal University(Natural Science),38(1): 69-71.]
汪有良. 1995. 南京百合快速繁殖[J]. 江苏林业科技,22(1): 35-36. [Wang Y L. 1995. Rapid propagation of Lilium lancigolium[J]. Journal of Jiangsu Forestry Science & Techno-logy,22(1): 35-36.]
王乙婷. 2016. 贮藏条件对兰州百合主要营养成分及抗氧化活性影响的研究[D]. 兰州:兰州理工大学. [Wang Y T. 2016. Study on effects of storage conditions on main nutritional components and antioxidant activity of Lilium[D]. Lanzhou:Lanzhou University of Technology.]
韦莉萍,韦绍龙,苏宾,闭志强,韩沅杉,张进忠. 2014. 兰州百合鳞茎再生繁殖体系的建立[J]. 南方农业学报,45(5): 742-748. [Wei L P,Wei S L,Su B,Bi Z Q,Han Y S,Zhang J Z. 2014. Regeneration propagation system establishment of bulblet derived from scale of Lilium davidii var. Unicolor(Hoog) Cotton[J]. Journal of Southern Agriculture,45(5): 742-748.]
楊春起. 2016. 百合种球生产关键技术与休眠解除中碳水化合物代谢机理研究[D]. 北京:中国农业大学. [Yang C Q. 2016. Study on key technology of bulb production and role of carbohydrate metabolism in bulb dormancy release in lily[D]. Beijing: China Agricultural University.]
郑爱珍,张峰. 2004. 百合的繁殖方法[J]. 北方园艺,(4): 43.[Zheng A Z,Zhang F. 2004. Methods of breeding lily[J]. Northern Horticulture,(4): 43.].
(责任编辑 邓慧灵)

