铝粉与盐酸、氢氧化钠溶液作用机理的探究


摘要:在铝粉与盐酸、NaOH溶液反应的相关实验中发现,除AlCl3或NaAl(OH)4等产物外,同时还能得到聚合氯化铝或Al(OH)3沉淀;在研究铝/水反应破坏保护膜模型的基础上,提出原电池认识模型研究铝/水作用机理,认为其阳极行为控制了铝/水作用的反应速率,详细描述分析了铝与盐酸、NaOH溶液反应存在显著差异的微观原因。
关键词:铝粉; 盐酸; NaOH溶液; 反应机理
文章编号:1005-6629(2020)07-0094-04
中图分类号:G633.8
文献标识码:B
常温下,除去保护膜的铝片与水作用看不到反应现象,是因为铝表面生成的Al(OH)3阻挡了和水的进一步反应,所以很多学者会用铝汞齐等方式,在常温下成功地进行了铝与水的反应[1],这说明常温下铝能与水作用的化学过程无论从其焓变还是熵变上分析都是自发的,反应完全、彻底。一定浓度的盐酸或NaOH溶液都能破坏铝表面的保护膜,因此铝与盐酸、NaOH溶液能持续反应,那么盐酸或NaOH是如何破坏铝表面保护膜的呢?
1 破坏保护膜研究模型
1.1 盐酸溶解铝片表面保护膜的化学过程
Al(OH)3+H+Al(OH) +2+H2O
Al(OH) +2+H+Al(OH)2++H2O
Al(OH)2++H+Al3++H2O
Al(OH)3碱式电离是分步的,高中阶段为了降低学生学习难度,教材把多元弱碱的分步电离合并在一起,为更好地研究有关铝/水反应释出H2的微观过程,采用上述符号表征盐酸溶解Al(OH)3的化学过程更为恰当。盐酸中的Cl-的存在也可以有效破坏保护膜,具体作用机理不再赘述。由于铝在KCl、 NaCl等中性氯化物溶液中无法发生反应,说明仅Cl-对保护膜的作用有限,Cl-只有在酸性或碱性溶液中对保护膜的影响才能很好体现,例如,未除去保护膜的铝粉与CuSO4溶液混合,短时间内无明显现象,但在CuSO4溶液中加入少量的NaCl固体后,铝就与上述混合溶液发生剧烈反应;未除去保护膜的铝粉很难与稀H2SO4反应的事实也说明仅有H+也很难破坏铝表面的保护膜。
1.2 NaOH溶液溶解保护膜的化学过程
金属铝表面的保护膜在初始条件下一般认为主要是氧化物保护膜,但在除去氧化物保护膜后的铝与水作用下,一般形成Al(OH)3或水合氧化铝保护膜,发生的化学过程为Al(OH)3+OH-Al(OH) -4。事实上,pH>11的碱性溶液就能溶解铝表面Al(OH)3保护膜,且无需其他粒子的协同,这一点与Cl-或H+不能单独快速破坏保护膜的情况有所不同。
2 原电池模型研究铝/水反应初探
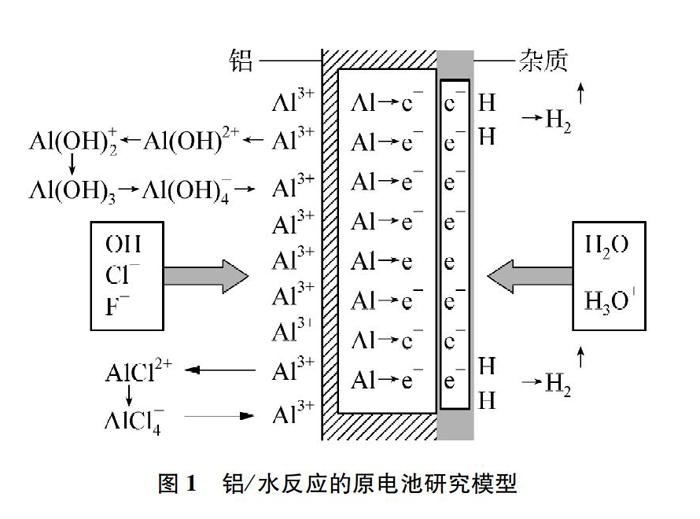
为了更好地研究铝/水反应的微观过程,查阅相关文献[2],分析、研究建立如圖1所示的铝/水反应微观过程的认知模型。
该认识模型基于铝/水反应为原电池反应的背景下构建起来的,首先把铝/水反应看成发生阳极反应和阴极反应的电化学反应过程,具体过程阐述如下。
2.1 阴极行为
溶液中+1价的氢在阴极(如在铝表面的杂质上)得电子,电极过程如下:H++e-H, 2HH2或H2O+e-OH-+H, 2HH2,溶液中不管是H+还是H2O得电子,当阴极得到1mol H2时,阴极区就能释放出2mol OH-或消耗2mol H+,阴极区溶液pH增大,c(H+)减小。
2.2 阳极行为
2.2.1 酸性介质中的阳极行为
金属表面的Al3+在带负电的酸根离子(如SO2-4、 Cl-)等电性作用下离开金属表面,电性作用显然只发生在金属表面靠得很近的阴离子与Al3+之间,阴离子依靠“静电作用”使得Al3+离开金属表面,从结果上看就是Al3+扩散到水中形成水合离子的过程。对于Cl-来说,还可以发生如下过程:Al3++Cl-AlCl2+,即金属表面的Al3+能与Cl-发生配合作用,像这种能与Al3+发生配合作用常见的还有F-(Al3+与F-可以形成AlF3-6等配合离子)。
酸性介质中的OH-也能与Al3+发生配合作用(具体见下文),但由于OH-浓度很低,在酸性较强的环境中可以忽略。
2.2.2 碱性介质中的阳极行为
在碱性介质中,OH-可以成为让铝表面的Al3+扩散到水溶液中的主要粒子,OH-与Al3+之间不但存在一般的“静电作用”,而且能更好地与Al3+发生配合作用,相关化学过程表征如下:
Al3++OH-AlOH2+(Ⅰ); AlOH2++OH-Al(OH) +2(Ⅱ);
Al(OH) +2+OH-Al(OH)3(Ⅲ); Al(OH)3+OH-Al(OH) -4(Ⅳ)。
查阅《兰氏化学手册》(第二版)发现Al3+与OH-的一级和四级稳定常数分别为109.27和1033.03,这些数据表明:OH-与Al3+作用从热力学上说更易发生,反应更完全,更容易使Al3+离开金属表面,同时金属表面还可能发生带负电的Al(OH)-4与Al3+作用得到Al(OH)3,反应式如下:3Al(OH)-4+Al3+4Al(OH)3等。因此,仅依据阳极行为就可以判断铝与同浓度的盐酸或NaOH溶液反应,后者的反应速率更大,事实上铝与NaOH溶液反应也更快。
在铝与盐酸作用的阴极行为的H+浓度远大于铝与同浓度的NaOH溶液作用的阴极行为中的H+浓度,为什么铝与盐酸反应速率反而更小?唯一的解释就是控制铝/水反应的是阳极行为而非阴极行为,金属表面的Al3+扩散进入到溶液中的快慢决定了铝/水反应速率的大小。
由于Cl-也能与Al3+形成配离子,因此含有Cl-的铝与水溶液反应往往要快得多,如铝与H2SO4溶液作用缓慢,而铝与盐酸反应剧烈等类似的实验事实都说明阳极行为控制了反应速率,而溶液中的H+浓度大小对反应速率影响较小,此时的Cl-不但承担破坏保护膜的责任,还控制了上述反应的速率。
2.3 铝与盐酸、NaOH溶液反应现象
[实验1]一定量铝粉分批投入到200mL 3mol/L的盐酸中,反应剧烈,产生大量气泡。随着反应的进行,溶液pH不断升高,反应速率逐渐降低,当pH为3.5左右时几乎无气泡产生,水浴加热并加入铝粉后继续释出H2,长时间后反应停止。
[补充实验]铝粉或铝片与新制2mol/L的AlCl3溶液混合,发现常温下几乎无现象,沸水浴加热AlCl3溶液,其水解速率和程度都显著增大,体系溶液中产生大量气泡,静置后溶液澄清,长时间后反应停止。
值得注意的是,在沸水浴加热条件下,NaCl、 NH4Cl等溶液都难以与铝发生反应,这说明没有一定浓度的H+的配合下Cl-无法快速破坏保护膜,由于AlCl3溶液水解程度较大,加热后溶液酸性较强,在Cl-的协同下能有效破坏保护膜,因此铝与AlCl3溶液在加热条件下能持续发生反应直到停止。
[实验2]一定量铝粉分批投入到盛有200mL 1.0mol/L的NaOH溶液烧杯中,溶液中很快出现大量乳白色浑浊和大量气体,反应剧烈;长时间反应后,烧杯底部出现大量白色沉淀物,此时发现溶液pH保持不变(如图2采用数字化实验测定的0.1mol/L NaOH溶液与足量铝粉反应后的pH变化曲线);铝粉消耗完后,静置一段时间上层液变澄清,烧杯底部出现“片状”沉淀物,取出澄清溶液,加入铝粉后有大量气泡,溶液再次变浑浊,静置一段时间后上层液变澄清,烧杯底部有大量“片状”白色沉淀物,再次测定上层澄清溶液pH与前值相同。当[实验2]中的溶液pH不变时,此时获得的溶液主要就是NaAl(OH)4溶液,该实验说明铝能与NaAl(OH)4溶液反应,往新配制的NaAl(OH)4溶液中投入铝粉或铝片有着完全相同的实验现象。
反应后的pH变化曲线(25℃)
为什么过量的铝与盐酸、NaOH溶液能发生反应,前者最终停止而后者可以不断反应得到白色沉淀物?在铝/盐酸反应体系中是什么原因使铝表面重新形成了保护膜?又是什么原因在铝/NaOH溶液反应体系不会形成保护膜?在铝与NaOH溶液反应中可见有大量乳白色沉淀物现象,经检测这乳白色的主要成分是Al(OH)3,这一事实说明铝/水反应过程中铝表面并无保护膜的形成。
3 铝/盐酸、NaOH溶液反應差异性分析
3.1 铝/盐酸反应体系
反应前期:溶液中的H+与Cl-的共同作用下,铝表面的保护膜被溶解。
反应中期:阳极的Al3+离开金属表面进入溶液,阴极发生还原反应产生H2,消耗H+,发生化学过程就是2Al+6HCl2AlCl3+3H2↑。
反应后期:当一定量的盐酸与铝完全反应得到AlCl3溶液后,由于AlCl3溶液水解呈酸性,理论计算,1mol/L的AlCl3溶液pH约为2.4,此时金属铝表面无法形成Al(OH)3保护膜,反应得以持续;pH<3.5时,反应体系中仍有气泡产生,随着反应的进行,溶液的pH继续增大;当pH>3.5时,由于Ksp[Al(OH)3]较小,溶液中可以存在可观的Al(OH)3,此时在金属铝表面的Al3+不仅仅能与Cl-形成配合物,也能与溶液中的OH-形成配合物,最终在金属铝表面形成保护膜导致反应终止[注:Al(OH)3开始沉淀的pH约为3.3完全吻合,实验所测数据可信]。胡保国[3]详细描述了制备PAC实验,PAC产品指的是聚合氯化铝,这种聚合氯化铝是一种无机高分子聚合物,其化学式可表示为[Al2(OH)n(Cl)(6-n)]m,其中m为聚合度,其单元可以看成Al(OH)Cl2或Al(OH)2Cl等,换句话说,铝与盐酸溶液反应后阶段,通过加热等方式提高溶液的酸性,铝便可以和水反应得到Al(OH)2Cl,发生的化学过程可以表征为2Al+2HCl+4H2O2Al(OH)2Cl+3H2↑,学者范艳花、陈利娟在“铝箔与不同浓度盐酸反应的‘异常现象探究”[4]一文的实验中已经获得类似的无机高聚物,但可惜并未深入研究。
在平时的教学和实验观察中,教师通常并未考虑到AlCl3溶液呈酸性也能破坏保护膜这一问题,也没有意识到溶液中存在Al3+与OH-作用得到Al(OH)2+等相关离子这一问题,使得教师认为铝和盐酸反应的产物只有AlCl3和H2,其原因在于没能真正认识破坏保护膜的微观过程。
3.2 铝/NaOH溶液反应体系
足量铝粉与不同浓度的NaOH溶液反应,在低浓度情况下(浓度小于0.1mol/L)久置后只得到澄清溶液,所得溶液pH<11;在较高浓度情况下(如浓度大于0.5mol/L)久置后得到澄清溶液,且容器底部有“片状”白色沉淀物。
查阅资料[5],这“片状”白色沉淀物可能是晶体Al(OH)3,该沉淀物难以被6mol/L的盐酸或NaOH溶液溶解,其组成才是真正的Al(OH)3,这类晶体Al(OH)3与AlCl3溶液中滴加氨水或NaOH溶液而获得的絮状沉淀物(组成为Al2O3·H2O或Al2O3·3H2O等)是不同的。
采用原电池理论模型来讨论铝与NaOH溶液反应可知:其阴极主要发生的是2H2O+2e-H2+2OH-,而阳极Al3+与OH-作用得到AlOH2+、 Al(OH)+2等,当溶液中还存在NaOH溶质时,发生的化学过程就是2Al+2NaOH+6H2O2NaAl(OH)4+3H2↑。但当溶液中无NaOH溶质剩余时,由于NaAl(OH)4溶液水解程度较大,如0.5mol·L-1的NaAl(OH)4溶液pH实测为12.5左右,因此铝表面的保护膜无法形成,假定溶液中先形成Al(OH)-4也会与铝表面的Al3+相互作用得到Al(OH)3,由于阴极产生H2时所释放的OH-与阳极消耗的OH-个数相同,因此溶液的pH不再变化,此时体系只要有铝和水,反应就可以持续不断发生。
也就是说,过量铝与一定浓度的NaOH溶液反应,在最后阶段,从宏观上讲就是铝和水反应得到Al(OH)3和H2。实际上,铝与NaOH溶液反应过程中有乳白色悬浊液现象,说明铝与NaOH反应的本质就是铝和水之间的反应,只是由于Al(OH)3能与NaOH溶液反应得到NaAl(OH)4溶液而已,因此NaOH也可以看作是铝和水反应的“催化剂”。
4 结论
(1) 铝与一定浓度的盐酸反应除H2外开始的产物为AlCl3,反应后期加热后,溶液继续能与铝反应释出H2,同时得到组成为[Al2(OH)n(Cl)(6-n)]m的无机聚合物,当pH>3.5左右时,铝表面形成了保护膜,反应停止。
(2) 铝与大于0.5mol/L的NaOH溶液反应时,除H2外产物不但有NaAl(OH)4,还有“片状”晶体Al(OH)3生成,该晶体难以被6mol/L的NaOH或盐酸溶解,体系溶液中只要存在铝和水,反应就可以一直持续,铝与NaOH溶液反应本质就是铝与水反应,NaOH或NaAl(OH)4溶液可以认为是铝/水反应的“催化剂”。
(3) 当溶液pH<3.5且有一定浓度Cl-存在時,铝表面难以形成Al(OH)3保护膜,铝/水反应可以持续。当溶液pH>11时,铝表面难以形成保护膜,反应可以持续。
(4) 铝与其他碱性溶液反应也存在类似的化学过程[6],如铝与Na2CO3溶液反应首先得到少量的NaAl(OH)4和NaHCO3,加热后体系中的NaHCO3溶液分解,溶液碱性增强,反应得以持续。
参考文献:
[1]张新平, 宋秀安, 李瑶, 盛莉莉. 氨水腐蚀铝、铁、铜的化学原理初探[J]. 化学教育, 2013, (1):76~79.
[2]吴文中. 原电池模型研究镁与氯化铵溶液反应机理[J]. 中学化学教学参考, 2019, (11):39~42.
[3]胡保国, 蒋晨, 赵海侠, 方晓波, 李松. 铝灰酸溶法制备聚合氯化铝[J]. 化工环保, 2013, (4):325~329.
[4]范艳花, 陈利娟. 铝箔与不同浓度盐酸反应的“异常现象”探究[J]. 化学教学, 2011, (3):42~43.
[5]杨岳洋, 江书安, 李建军等. pH对氢氧化铝晶型影响分析[J]. 无机盐工业, 2017, 49(11):39~41.
[6]沈彩娣, 吴文中. 镁、铝与碳酸钠溶液反应的差异性研究[J]. 化学教育(中英文), 2019, (21):86~89.

