骨质疏松症与其相关危险因素的文献回顾
骆华松 彭松明 刘克斌 易洋 陈廖斌
骨质疏松症在中老年人群中有着较高的发病率,目前我国的骨质疏松症病人大约有9 000万人,其中年龄超过60岁的老年人占到了56%,且60%~70%的病人均为绝经后的女性[1]。当骨质疏松症发展至严重阶段时,将会发生脆性骨折,给家人以及社会带来沉重的负担,一旦并发心脑血管疾病,会对中老年人的生命健康造成极大的威胁。有关骨质疏松症的危险因素有很多,主要有:物理及环境因素、营养物质与特殊嗜好、影响骨代谢的相关激素、一般因素、微量元素[2](例如钙、锌、磷、铜等)、血生化指标、骨转换标志物等[3]。骨质疏松症与其相关危险因素密切相关,本文在此就骨质疏松症与相关危险因素的文献进行回顾分析。
一、文献检索策略
目前有关骨质疏松症、骨密度(bone mineral density,BMD)与相关危险因素关系的研究并不多,本文通过中文检索词“骨质疏松症”、“骨密度”、“危险因素”、“成骨细胞”、“破骨细胞”以及英文检索词“osteoporosis”、“bone density”、“risk factors”、“osteoblast”、“osteoclast”在中国知网、万方数据库、维普数据库、PubMed等平台进行检索,筛选发表时间为近十年内。
文献纳入标准为:①已正式发表的期刊文献;②文献内容与可能引起骨质疏松症发生的危险因素密切相关;③同类研究中质量、证据等级较高的文献;④语言为英文的文献。文献排除标准为:①文献质量、证据等级较低的文献;②学位论文、会议类文献;③非英文的文献;④无法获得全文的文献。
共检索到文献436篇。根据纳入与排除标准,最终纳入文献48篇,均为英文文献(图1)。
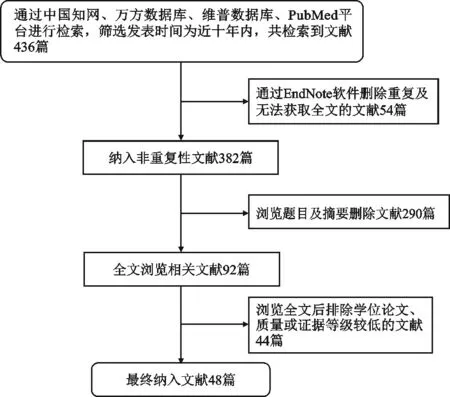
图1 文献筛选流程图
二、物理及环境因素
(一)睡眠
睡眠是一种常见的,也是至关重要的生命活动,涉及到了多个病理、生理过程。对于健康的人群,如果缺乏睡眠的时间连续超过一周则会发生明显的内分泌代谢紊乱。若睡眠不足的情况持续存在,则会通过外周或者中枢途径对人的身体健康产生长期的不利影响。相关研究结果显示,女性睡眠时间长期不足,其皮质BMD 会明显下降[4]。Sasaki 等[5]的一项研究也证实,骨质疏松症可能与睡眠质量差有关,特别是睡眠障碍可能是加重骨质疏松的危险因素。虽然目前还未明确睡眠时间与骨之间相互影响的机制,但是推测其与可的松分泌增加有一定的关系。与睡眠时间比较充足者相比,睡眠时间不足者的可的松水平会在下午以及夜晚出现明显的增多[6]。可的松水平升高后会对骨髓间质干细胞产生抑制作用,阻止其分化为成骨细胞,同时还会使破骨细胞的间歇性骨吸收转变为持续性骨吸收,使骨吸收作用增强,导致骨量的丢失[7]。另外,相关荟萃分析表明,睡眠持续时间过长也可能增加中老年人骨质疏松症的风险[8]。
(二)运动
在骨代谢中,运动也发挥着重要的作用,运动可以使骨骼的结构得到改善,骨强度及骨量增加[9]。体育锻炼是预防和治疗骨质疏松症的重要刺激因素,有助于骨骼的生长。当运动量减少时会导致骨量的减少,通过运动、锻炼,骨细胞会对骨量与骨强度进行局部调整,以满足承载负荷的需要[10]。运动对成年人的主要影响为维持骨量的平衡或者增加骨量,而运动对老年人的影响主要表现为减慢骨量丢失的速度。运动对骨骼产生影响的机制主要为间接的肌肉牵拉负荷以及直接的机械负荷。运动强度的不同也会对BMD 造成影响。低强度的运动对BMD 并没有明显的影响,而中等强度的运动则可以明显增加BMD,改善骨代谢,高强度运动将会对BMD造成不良影响,因此在通过运动预防骨质疏松症时,应当注意运动持续时间及运动强度。
(三)日照
充足的日照可以提高机体内的维生素D 水平。在现代社会环境下,人们普遍、大量地使用防晒用品,因此即使有充足的日照,也普遍存在维生素D缺乏的现象。在使用了防晒霜之后,局部皮肤所生成的维生素D 水平将会显著降低[11]。维生素D 可以促进肠道对钙的吸收,增加血钙水平,有助于骨骼的矿化;增强成骨细胞活性,抑制成骨细胞凋亡,对骨形成有明显的促进作用。并且维生素D可以通过多种途径来影响骨骼的代谢。相关研究发现,维生素D的长期缺乏会导致肌无力的发生,在适当补充维生素D后可降低发生跌倒的风险,因此维生素D对预防骨质疏松性骨折具有重要意义[12]。
(四)工作与学历
受教育的程度与骨质疏松症相关知识的掌握程度有一定关系。在我国,老年人的受教育程度通常要低于中青年人。随着年龄的增长,其记忆力与认知能力均有所下降,不容易掌握新的知识。而脑力劳动者的受教育程度通常又高于体力劳动者,且其摄入的钙量也通常高于体力劳动者,可能是因为体力劳动者的受教育程度较低,经济水平相对较差,缺乏相应的保健意识。文化程度高者摄入的钙量高,说明掌握骨质疏松症相关知识可以影响到钙的摄入量。由于工作性质的原因,体力劳动者的运动量要多于脑力劳动者运动,这也会对BMD 造成一定的影响。一项有关台湾地区的骨质疏松症发病趋势的长期研究显示,对于此类疾病的认知能力及相关政策的干预能够明显影响骨质疏松症的流行趋势[13]。
三、营养物质与特殊嗜好
(一)吸烟
吸烟与骨质疏松症密切相关,Ayo⁃Yusuf 等[14]通过问卷调查的方式,在一项对南非40 岁及以上女性的流行病学研究中发现,联合吸鼻烟和吸烟与骨质疏松症呈正相关,长期吸鼻烟和吸烟可能会增加患骨质疏松症的概率。另外,Tho⁃rin等[15]指出,无论是戒烟者还是吸烟者,发生骨折和骨质疏松性骨折的风险都会明显增加。大部分吸烟者从青少年时期就开始吸烟,这一时期是骨骼生长发育至关重要的时期,此时吸烟将会对骨峰值产生不利影响,从而增加了日后骨质疏松症的患病率[16]。Christos 等[17]对400 例骨质疏松症高风险人群的研究发现,吸烟对于骨质疏松症的发展是一项重要的风险因素。Bijelic 等[18]的一项多变量Logistic 回归研究结果显示,多种与生活方式相关的因素影响BMD,其中吸烟是绝经后妇女骨质疏松症的独立危险因素。
(二)饮酒
饮酒与骨质疏松症间也存在相关性,且较为复杂,饮酒量的不同会对骨质疏松症产生不同的影响。Cho 等[19]在一项对于韩国老年人口酒精消费与BMD值的相关性调查研究中发现,过量的酒精摄入可能与男性BMD值下降有关,而轻度酒精摄入可能会增加女性的BMD 值。Hyeon 等[20]在一项横断面的研究工作中发现,校正年龄和其他混合因素之后,饮酒与BMD 之间没有显著的关系。LaBrie 等[21]的研究则提出,在女性青少年时期过量不定期饮酒的频率与成年期年轻女性骨骼健康呈负相关。
(三)牛奶
在日常食物中,牛奶的含钙量较高,并且容易被人体吸收,因此普遍认为其为最好的钙源。现有的科学证据[22]总体上支持牛奶和乳制品的摄入有助于满足营养需求,并且可以预防最普遍的慢性疾病。当摄入较多钙时,其吸收率较低;当摄入钙不足时,其吸收率较高,当体内的钙上升至一定水平时,钙的吸收将会达到平台期,不会再增加。一般钙水平处于800~1 200 mg 时,钙的吸收就不会再增加[23]。Gui[24]等的研究表明,在18 个月内每天摄入含250 mg 钙的牛奶可有效防止绝经后中国妇女髋部和股骨颈的BMD 的丢失。Fardellone 等[25]指出,虽然牛奶对骨质疏松症的影响是多方面的,但是到目前为止,还没有确凿的证据表明我们应该改变目前牛奶的高消费量的现状。
(四)豆类
Ishimi等[26]指出,大豆内含有大豆异黄酮类物质,该物质具有微弱的雌激素活性及潜在骨特异性作用,可能有助于促进骨骼健康,对骨质疏松症的预防也起着一定作用。同时,Yu 等[27]认为大豆异黄酮在体内具有抗骨吸收作用,研究表明大豆异黄酮能促进成骨细胞的增殖和分化,可能是一种治疗骨质疏松症有效的药物。
(五)肉类
高动物蛋白的摄入将会增加骨质疏松性骨折的风险。在Rizzoli等[28]的研究中,动物蛋白摄入量高者的股骨颈骨量丢失明显增多,且明显增加了发生髋关节骨折的风险。体内固定酸的产生即主要来源于动物蛋白,随着摄入的动物蛋白的增多,尿中净酸排出量也会随之增加。而且动物蛋白质中所含的古硫氨基酸较多,因此相比于植物蛋白,动物蛋白诱导高钙尿的能力明显增强,使尿钙的排泄增多。减少动物蛋白的摄入量,增加植物蛋白的摄入量,可以对骨质疏松症的预防产生有利的影响。
(六)咖啡
一项针对中国男性人群的调查研究发现,咖啡的摄入作为一项独立因素与骨质疏松症的发生明显相关,中等频率的咖啡摄入具有较低的骨质疏松症发生率[29]。然而,在另一项Meta 分析中发现,每天饮用咖啡会增加女性骨折的风险,而男性则会降低患病的风险[30]。
四、影响骨代谢的相关激素
(一)雌激素
女性绝经以后,其卵巢功能开始衰竭,雌激素水平也开始降低。雌激素水平的降低会使破骨细胞的活性增强,增加骨转换。同时,雌激素水平的降低还会导致甲状旁腺激素分泌的减少,使1α-羟化酶的活化发生障碍,从而减少了1,25-双羟维生素D的合成,使血钙浓度降低,骨量丢失,最终引起骨质疏松症的发生。Xiang 等[31]的研究表明,雌激素受体的多态性可能是造成中国汉族女性易患骨质疏松症的重要因素。Shang等[32]认为雌激素受体的基因多态性可能与骨质疏松症相关,并可用作筛选中国妇女绝经后骨质疏松症高危人群的标志物。
(二)糖皮质激素
体内糖皮质激素水平的变化与骨质疏松症的发生具有明显的相关性。在骨质疏松症的病因中,糖皮质激素所造成的骨质疏松症排在第三位,仅次于因绝经及年龄因素所导致的骨质疏松症。在长期、大量使用糖皮质激素治疗后,病人的骨矿物质密度会明显降低,从而增加发生骨质疏松性骨折的风险。相关研究证实,糖皮质激素诱导的骨质疏松症是继发性骨质疏松症最常见的形式,也是年轻人骨质疏松症最常见的原因,骨丢失和骨折的风险与糖皮质激素治疗的剂量和治疗时间成正比[33⁃34]。
五、一般因素
(一)性别
对于女性而言,随着年龄的增长,其体内的雌激素水平降低,骨质疏松症的患病率也逐渐上升,特别是在绝经后的5~10 年内,其体内的雌激素水平下降幅度最大,在50~69 岁的女性人群中,骨质疏松症的患病率达到了50%。骨量的丢失从女性绝经后的第一年就已经开始,且随着年龄的增加而不断丢失。但对于50~69岁的男性人群,其骨质疏松症的患病率仅为27.5%[35⁃36]。
(二)年龄
骨质疏松症是一种常见的老年性疾病,与年龄因素密切相关。年龄越大,则骨质疏松症的发病率就越高。随着年龄的增加,骨质疏松症发生的风险也增加,已经有大量的流行病学调查研究证实了这一结论[37]。虽然伴随着年龄的不断增加,还在进行骨重建循环,但是总体趋势为骨吸收作用增强,明显超过了骨形成,造成骨量的减少。
(三)骨质疏松及骨折家族史
骨量的峰值、骨量的丢失情况均会受到遗传因素的影响,并且可以评估病人发生骨折的风险。相关研究发现[38],对于青年女性,其BMD 水平与其母亲的BMD 水平存在着明显的相关性,通过研究双胞胎的BMD后也发现,骨量的形成与丢失均会受到遗传因素的影响。骨转换的调控与骨量的获取可能受到了多组基因的影响,基因的多态性或者发生突变可能会增加发生骨质疏松症的风险。
(四)身高、体重及腰围
Mpalaris 等[39]的研究指出,BMD与身高间没有明显的相关性,而与体重间存在着较为明显的相关性,由于体重较大者可以承受更大的机械负荷,故其BMD 相对更高。并且对于绝经后的女性,体重较重或体型肥胖者的雌激素转换更多,肥胖是特定骨骼部位骨折的危险因素。人体腹部的脂肪可以通过腰围的测量结果反映出来,也是中心型肥胖的主要诊断指标。相关研究结果显示[40],腰围与BMD 间呈现出负相关的关系,认为脂肪的增多会使BMD降低,但目前并没有统一的结论。
(五)血压
目前关于高血压与BMD间的相关性并没有得到统一的结论。通过对骨代谢及BMD 与高血压间的相关研究发现,BMD 与血压间呈现出负相关的关系。相比于正常人,高血压病人的BMD 显著下降[41]。但在Mizrahi 等[42]的研究中,通过研究骨质疏松症及BMD 与高血压间的相关性后发现,BMD与高血压之间并不存在明显的相关性。
六、微量元素
微量元素在人体中的含量极少,仅占人体体重的0.01%,主要的微量元素有铁、铜、锌、锰、铬、氟、硒等,一旦缺乏将会对人体健康造成不利影响[43]。有研究结果[44]显示,铁的过量摄入或者铁缺乏均会对骨的发育造成影响。肌肉与骨骼中含量最多的微量元素为锌,锌在骨的代谢过程中对骨胶原酶及碱性磷酸酶(ALP)均有着明显的调控作用。铜会对胶原中羟脯氨酸及赖氨酸的交联作用产生影响,从而使骨胶原纤维的力学强度减弱,降低骨强度。锰可以影响骨骼以及软骨中糖蛋白的粘多糖合成酶活性,影响骨代谢过程,与骨质疏松症密切相关。
七、血生化指标
成骨细胞可以产生40%~75%的ALP,磷酸盐化合物在其作用下分解为游离磷酸,磷酸在结合细胞间质中的钙后形成磷酸钙,若成骨活动减弱,则ALP 的活性也会随之下降[45]。维生素D3通过肝脏,经25位上羟化作用形成25⁃OHD3,然后再通过肾脏经1 位上羟化形成1,25⁃(OH)2D3。因此当肝功能受损时,维生素D不能在肝脏进行25位上的羟化作用,从而使肾脏合成的1,25⁃(OH)2D3不足,导致经肠道吸收的钙量减少,增加发生骨质疏松症的风险[46]。在骨质疏松症与血脂代谢相关性方面,国内外学者却没有得到统一的结论。相关研究发现[47],对于绝经后女性,其BMD 与甘油三酯、胆固醇间呈现出正相关的关系,而对于老年男性,其BMD与血脂水平间却没有显著的相关性。
八、骨转换标志物
目前骨生化标志物的种类较多,主要有骨形成特异标志物与骨破坏特异标志物两大类,其中骨形成特异标志物主要有骨特异性ALP、护骨素、骨钙素、Ⅰ型前胶原氨基/羧基末端前肽、基质金属蛋白酶、羧化不全骨钙素、细胞核因子-κB受体活化因子配体/细胞核因子-κB受体活化因子系统。骨吸收特异标志物主要有Ⅰ型胶原氨基端/羧基端末肽、羟赖氨酸糖苷、抗酒石酸酸性磷酸酶、羟脯氨酸、吡啶啉、脱氧吡啶啉。Eastell等[48]指出,骨转换标志物不用于骨质疏松症的诊断,但可能有助于评估对合成代谢和抗吸收治疗的反应,评估治疗依从性,或者预测可能的继发性骨质疏松症。
综上,吸烟、饮酒、雌激素、糖皮质激素、性别、年龄、微量元素的缺乏或过剩、骨质疏松症及骨折家族史是影响骨质疏松发生的危险因素,咖啡、身高、体重及腰围是否是骨质疏松发生的危险因素暂无统一结论,血压及血生化指标与骨质疏松的发生无显著的相关性,而牛奶、豆类及肉类对骨质疏松症的预防产生有利的影响。总之,骨质疏松症受到各种体内外因素的影响。探索骨质疏松症发生的相关危险因素,并对骨质疏松症BMD 相关危险因素进行深入的研究,明确骨质疏松症的发病机制,有利于对高危人群进行筛查并采取积极有效的干预措施,从而降低骨质疏松症所造成的危害。

