宫颈癌患者中神经钙黏素和转铁蛋白受体1的表达情况及临床意义
陈鸿志,陈金玲
1信阳职业技术学院附属医院妇产科,河南 信阳 464000
2信阳市中心医院妇产科,河南 信阳 464000
宫颈癌是生长于宫颈部位的恶性肿瘤,是最常见的妇科恶性肿瘤之一,疾病早期患者出现阴道不规则出血、接触性出血等现象,随着病情的不断发展,肿瘤不断扩大,侵犯至血管后会导致出血量增多[1]。近年来,宫颈癌的发病趋势呈年轻化,而肿瘤细胞的生长与增殖是患者治疗及预后效果不理想的重要影响因素[2]。相关研究显示,神经钙黏素(N-cadherin,N-cad)在肿瘤细胞的分化、黏附及病变早期中发挥了不可忽视的作用,其表达情况与肿瘤的发展及转移紧密相关[3]。转铁蛋白受体1(transferrin receptor type 1,TfR1)被证明在肺癌、卵巢癌组织中呈高表达状态,与肿瘤的发展具有密切联系,而关于其在宫颈癌中表达水平的研究仍较少[4]。本研究分析了宫颈癌患者中N-cad、TfR1的表达情况及临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选择2017年6月至2019年6月信阳职业技术学院附属医院收治的宫颈癌患者。纳入标准:①经病理检查确诊为宫颈癌[5];②术前未接受过化疗、放疗或其他治疗;③临床资料完整。排除标准:①合并严重肝、肾功能不全;②合并其他严重并发症;③合并其他恶性肿瘤。依据纳入和排除标准,本研究共纳入65例宫颈癌患者作为宫颈癌组,年龄为22~70岁,平均(42.38±5.28)岁。选择同期诊断为慢性宫颈炎的患者38例作为慢性宫颈炎组,年龄为21~73岁,平均(41.89±5.53)岁;选择同期体检的健康体检者37例作为对照组,年龄为23~72岁,平均(42.97±5.34)岁。3组研究对象的年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2 仪器与试剂
10%甲醛溶液、石蜡、磷酸盐缓冲液(phosphate buffered saline,PBS)均购自赛默飞世尔生物化学制品(北京)有限公司、免疫组化二抗试剂盒购自武汉博士德生物工程有限公司,鼠抗人TfR1多克隆抗体和N-cad抗体均购自英国Abcam公司。
1.3 免疫组织化学染色方法
取受检者的宫颈黏膜组织,30 min内将黏膜组织置于10%甲醛溶液中固定浸泡,予以石蜡包埋、切片、二甲苯脱蜡、梯度乙醇脱水,并使用枸橼酸盐修复液对组织进行3 min的高压修复。修复完成后用免疫组化笔在受检组织1~2 mm外划圈,再加入3%H2O2,置于恒温箱中孵育20 min,以阻断内源性过氧化物酶的干扰,并采用PBS漂洗3次。然后加入适量的10%正常羊血清,于室温下密闭15 min,弃血清,以1∶500的稀释比例滴加TfR1或N-cad抗体,置于4℃恒温箱中过夜,再用PBS漂洗3次,然后加入二抗,孵育后PBS漂洗3次并予以二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。以PBS代替一抗作为阴性对照,以被证实含有肿瘤细胞的宫颈黏膜组织作为阳性对照。
1.4 免疫组织化学染色结果判定标准
由两位病理科医师在400倍光镜下随机选取10个视野。依据阳性细胞百分数评分:<1%为0分,1%~10%为1分,11%~50%为2分,51%~75%为3分,75%以上为4分;依据染色程度评分:无色为0分,黄色为1分,浅棕色为2分,棕褐色为3分。阳性细胞百分数与染色程度评分相加,0~2分为阴性,>2分为阳性[6]。
1.5 随访方法
采用电话或门诊随访的方式对患者随访2年,记录患者的病情变化及生存情况。
1.6 统计学方法
采用SPSS 18.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。相关性分析采用Spearman相关分析法;采用Logistic回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.13 组研究对象N-cad、TfR1阳性表达率的比较
宫颈癌患者中N-cad和TfR1的阳性表达率均高于慢性宫颈炎组和对照组,差异均有统计学意义(P<0.05)。慢性宫颈炎组患者中N-cad和TfR1的阳性表达率均高于对照组,差异均有统计学意义(P<0.05)。(表1)
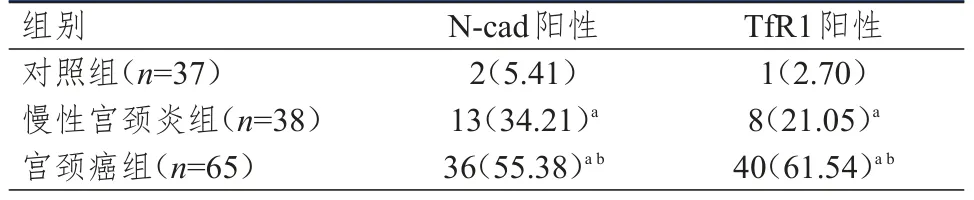
表1 3组研究对象中N-cad和TfR1阳性表达情况的比较[n(%)]
2.2 不同临床特征宫颈癌患者宫颈癌组织中N-cad、TfR1表达情况的比较
不同年龄、肿瘤直径的宫颈癌患者宫颈癌组织中N-cad、TfR1的阳性表达率比较,差异均无统计学意义(P>0.05)。不同临床分期、淋巴结转移情况、病理分化程度的宫颈癌患者宫颈癌组织中N-cad的阳性表达率比较,差异均有统计学意义(χ2=15.879、29.276、35.117,P<0.05)。不同临床分期、淋巴结转移情况、病理分化程度的宫颈癌患者宫颈癌组织中TfR1的阳性表达率比较,差异均有统计学意义(χ2=27.121、25.656、24.265,P<0.05)。(表2)
2.3 宫颈癌患者中N-cad、TfR1的表达与临床特征的相关性
Spearman相关性分析结果显示,宫颈癌患者中N-cad、TfR1的表达与淋巴结转移和临床分期均呈正相关,与病理分化程度均呈负相关(P<0.05)。(表3)
2.4 宫颈癌患者预后影响因素的单因素分析
65例宫颈癌患者的2年生存率为75.38%(49/65)。不同年龄、肿瘤直径的宫颈癌患者的2年生存率比较,差异均无统计学意义(P>0.05)。不同临床分期、淋巴结转移情况、病理分化程度、N-cad和TfR1表达情况的宫颈癌患者的2年生存率比较,差异均有统计学意义(P<0.05)。(表4)

表2 不同临床特征宫颈癌患者宫颈癌组织中N-cad、TfR1表达情况(n=65)
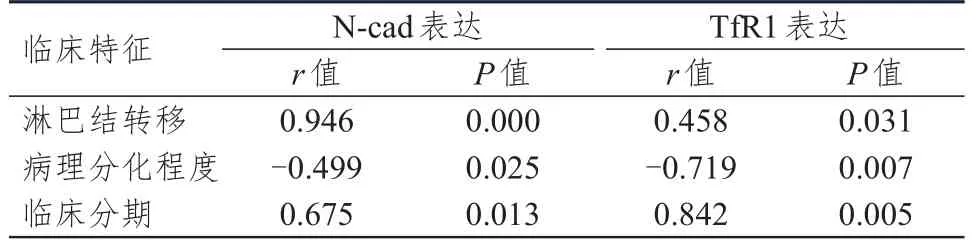
表3 宫颈癌患者中N-cad、TfR1的表达与临床特征的相关性(n=65)
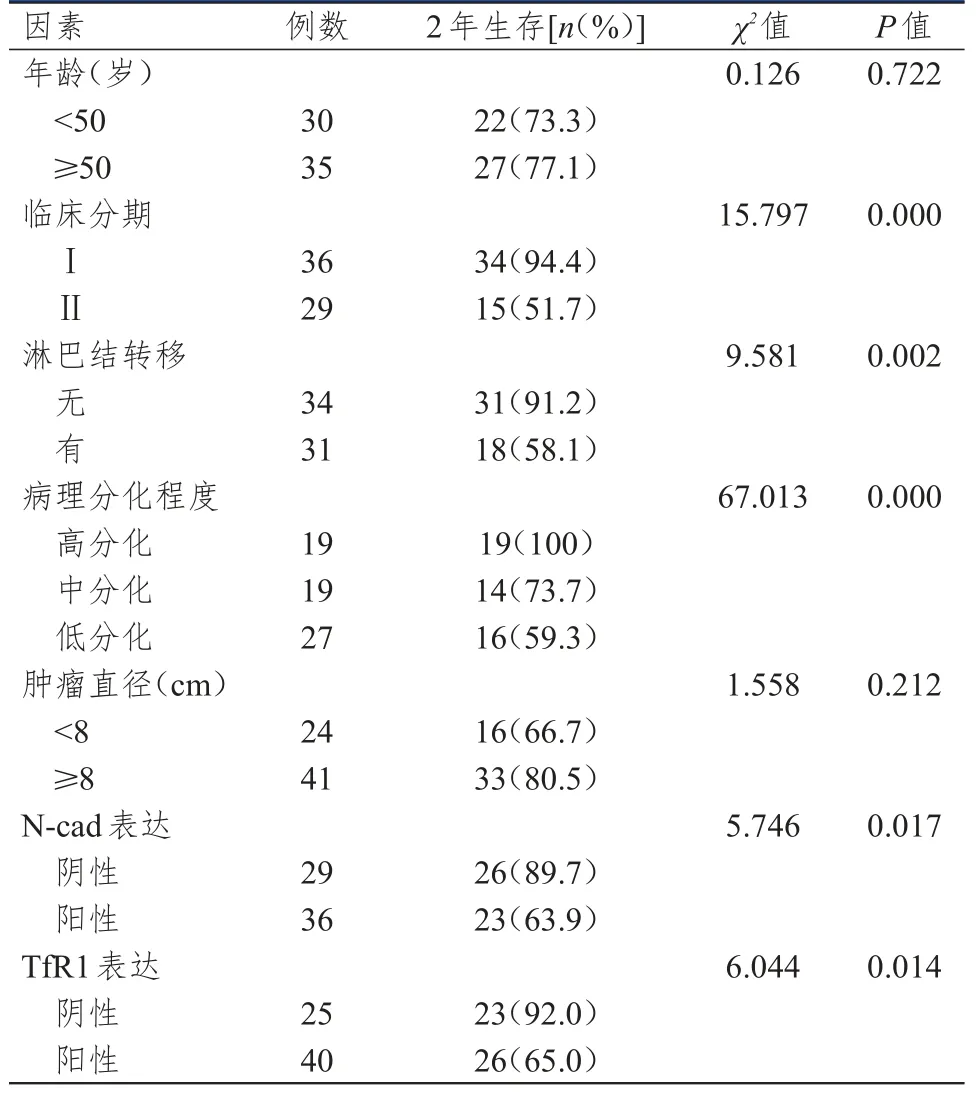
表4 宫颈癌患者预后影响因素的单因素分析(n=65)
2.5 宫颈癌患者预后影响因素的多因素分析
多因素Logistic回归分析结果显示,低分化、临床分期为Ⅱ期、有淋巴结转移、N-cad阳性、TfR1阳性均是宫颈癌患者预后的独立危险因素(P<0.05)。(表 5)
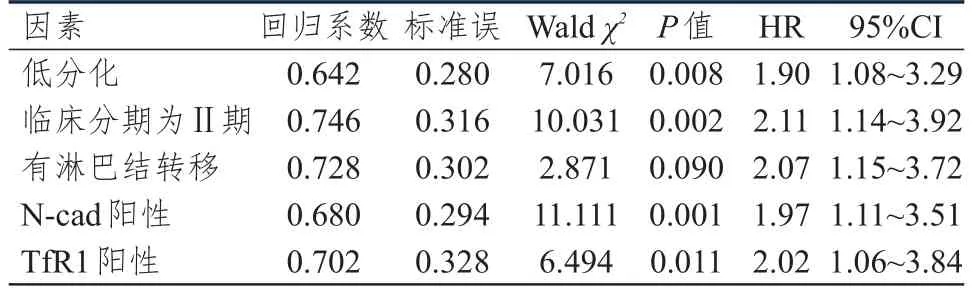
表5 宫颈癌患者预后影响因素的多因素分析(n=65)
3 讨论
宫颈癌是严重危害女性生命健康的恶性肿瘤之一,是全球女性中仅次于乳腺癌的第二大常见的恶性肿瘤,主要分布于30~35岁和50~55岁的女性中,占女性生殖系统恶性肿瘤的50%以上[7]。据相关数据统计,全世界每年新发宫颈癌患者约46万人,每年有超过20万的女性死于此病[8]。随着近年来宫颈癌疫苗及宫颈筛查的广泛普及,宫颈癌的发病率呈下降趋势,但仍有部分女性未进行疫苗接种,而临床上对于宫颈癌无指导性的治疗方法,因此,对宫颈癌发生发展过程中的相关分子进行深入的研究具有重要意义[9-10]。
铁元素在人体生命活动中发挥着至关重要的作用,不但参与细胞DNA的合成,还与电子传递具有一定的联系[11]。TfR是一种由转铁蛋白受体基因产生的跨膜糖蛋白,是调节细胞生长所需的蛋白质之一,包括TfR1和TfR2两种亚型[12]。其中TfR1在机体内大多数细胞中均有表达且与生命体的存活具有紧密联系。越来越多的文献表明,TfR1在大多数肿瘤细胞中异常表达,参与了肿瘤的发生发展。而近年来也有研究发现,TfR1基因敲除可引发小鼠死亡[13-14]。N-cad是一种在细胞黏附过程中依赖钙发挥作用的跨膜糖蛋白,可促进细胞间发生粘连,并诱导细胞发生聚集反应[15]。目前关于肿瘤细胞中N-cad的作用机制仍存在争议,但大部分学者认为,N-cad对肿瘤细胞的侵袭和迁移具有促进作用,该蛋白可激发上皮细胞转化为间质细胞,并加强细胞间的黏附能力,促进肿瘤细胞的转移和侵袭[16-17]。本研究结果显示,宫颈癌患者中N-cad和TfR1的阳性表达率均高于慢性宫颈炎患者和健康体检者。说明N-cad和TfR1在宫颈癌的发病过程中发挥了不可或缺的作用,随着病情的发展其表达水平可能逐渐升高。
本研究分析了不同临床特征宫颈癌患者宫颈癌组织中N-cad和TfR1的表达情况,结果发现,不同临床分期、淋巴结转移情况、病理分化程度的宫颈癌患者宫颈癌组织中N-cad和TfR1的阳性表达率比较,差异均有统计学意义(P<0.05)。Spearman相关性分析结果显示,宫颈癌患者中N-cad、TfR1的表达与淋巴结转移和临床分期均呈正相关,与病理分化程度均呈负相关(P<0.05)。研究表明,N-cad和TfR1的表达水平越高,患者病情越严重,可将二者作为肿瘤细胞的特异性靶向受体[18]。本研究结果说明N-cad和TfR1参与了宫颈组织病变的过程,在一定程度上可能对肿瘤细胞的增殖及相关因子的分泌起到了推进作用,这与孙新超等[19]研究结果一致。
本研究结果还显示,低分化、临床分期为Ⅱ期、有淋巴结转移、N-cad阳性、TfR1阳性均是宫颈癌患者预后的独立危险因素(P<0.05)。提示上述因素可在一定程度上影响患者的生存率,为宫颈癌的治疗及预后提供了参考价值。本研究中患者的2年生存率达75.38%,高于陈媛媛等[20]的研究结果,考虑与样本量或随访时间不同有关,还需进一步探究。
综上所述,宫颈癌患者中N-cad和TfR1的阳性表达率较高,且其表达与宫颈癌患者的淋巴结转移情况、病理分化程度、临床分期有关。低分化、临床分期为Ⅱ期、有淋巴结转移、N-cad阳性、TfR1阳性均是宫颈癌患者预后的独立危险因素。临床上可根据N-cad和TfR1的表达情况对病情变化做出有效的评估,并作为临床诊断、治疗及指导预后的依据。

