表皮生长因子、雄激素受体和表皮生长因子受体在肝癌组织中的表达及影响因素分析
王纪传,戴英增,王婷婷
淄博市第一医院感染性疾病科,山东 淄博 255200
肝癌的发生、发展是一个多因素、多步骤的复杂过程,与多种细胞因子密切相关[1]。表皮生长因子(epidermal growth factor,EGF)是由53个氨基酸残基组成的低分子多肽,可与其受体结合并促进靶细胞DNA的合成及有丝分裂[2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)是酪氨酸激酶受体家族成员,可与EGF结合并启动细胞核内与有丝分裂相关的基因,最终促进细胞增殖、分裂[3]。雄激素受体(androgen receptor,AR)是核受体超家族成员,可与雄激素结合,结合产物能与特异DNA序列相互作用,并介导靶细胞的雄激素特异反应基因的表达,AR在膀胱癌、前列腺癌中呈高表达。本研究采用免疫组织化学染色法检测EGF、AR、EGFR在肝癌组织和非肝癌组织中的表达情况,探讨EGF、AR、EGFR在肝癌发生、发展过程中的临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年2月至2018年8月淄博市第一医院收治的肝癌患者。纳入标准:年龄≥50岁;经病理检查确诊为肝癌;无其他严重基础疾病。排除标准:临床资料不全;合并其他免疫系统疾病。根据纳入和排除标准,共纳入90例患者,其中,男55例,女35例;年龄为53~80岁,平均年龄为(70.47±4.38)岁。取90例肝癌患者的肝癌组织。选取同期接受病理检查的90例非肝癌患者,年龄为55~73岁,平均年龄为(72.45±4.01)岁;男50例,女40例;均经病理检查确诊为肝良性肿瘤,无其他原发恶性肿瘤。取90例肝良性肿瘤患者的肝良性肿瘤组织(非肝癌组织)作为对照。两组患者的性别、年龄比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 免疫组织化学染色方法
常规石蜡包埋组织标本,4 μm厚切片,采用免疫组织化学染色方法检测EGF、AR、EGFR的表达情况,具体方法:脱蜡处理后梯度酒精水化,冲洗2次后,滴入与组织等量的抗原修复液进行抗原修复,取出后冲洗2次,滴入1 ml 3%过氧化氢进行灭活,反应5 min后再次冲洗2次,滴入80 μl山羊血清进行封闭,室温条件下静置30 min,选用对应抗体进行一抗,4℃冷藏过夜,取出后冲洗2次,滴入山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)进行二抗,反应2 h后取出,冲洗2次,二氨基联苯胺(diaminobenzidine,DAB)显色后使用苏木素复染,随后封片并进行镜检。从每个切片中随机挑选5个高倍视野并对阳性染色细胞数量进行统计。依据染色强度和阳性细胞所占百分比进行评分。
1.3 观察指标
观察两组患者组织中EGF、AR、EGFR的表达情况,比较不同临床特征肝癌患者肝癌组织中EGF、AR、EGFR的表达情况,分析肝癌患者肝癌组织中EGF、AR、EGFR表达的影响因素。
1.4 统计学方法
采用SPSS 11.5软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。肝癌患者EGF、AR、EGFR表达的影响因素分析采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同组织中EGF、AR、EGFR 阳性表达情况的比较
肝癌患者肝癌组织中的EGF、AR、EGFR的阳性表达率均明显高于非肝癌组织,差异均有统计学意义(χ2=48.400、96.800、67.430,P<0.01)。(表1)

表1 不同组织中EGF、AR、EGFR的阳性表达情况[n(%)]
2.2 不同临床特征肝癌患者肝癌组织中EGF、AR、EGFR阳性表达情况的比较
有肝炎史、Ⅲ+Ⅳ期、中低分化、有淋巴结转移的肝癌患者肝癌组织中EGF的阳性表达率均高于无肝炎史、Ⅰ+Ⅱ期、高分化、无淋巴结转移的肝癌患者,差异均有统计学意义(χ2=6.235、10.368、5.256、3.867,P<0.05);有肝炎史、Ⅲ+Ⅳ期、中低分化、有淋巴结转移的肝癌患者肝癌组织中AR的阳性表达率均明显高于无肝炎史、Ⅰ+Ⅱ期、高分化、无淋巴结转移的肝癌患者,差异均有统计学意义(χ2=10.087、15.246、14.052、18.947,P<0.01);有肝炎史、Ⅲ+Ⅳ期、中低分化、有淋巴结转移的肝癌患者肝癌组织中EGFR的阳性表达率均明显高于无肝炎史、Ⅰ+Ⅱ期、高分化、无淋巴结转移的肝癌患者,差异均有统计学意义(χ2=8.689、13.097、16.148、24.632,P<0.01)。不同年龄、性别、肿瘤直径的肝癌患者肝癌组织中EGF、AR、EGFR的阳性表达率比较,差异均无统计学意义(P>0.05)。(表2)
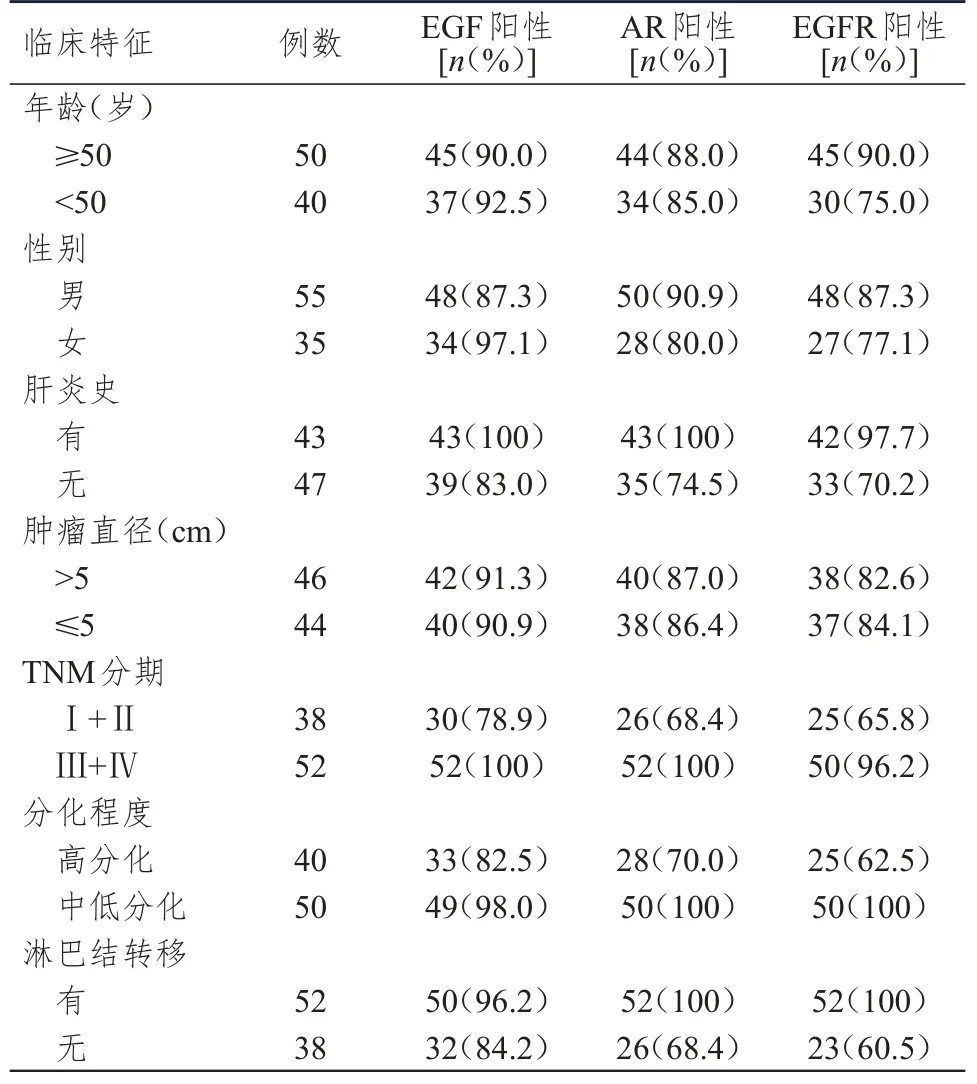
表2 不同临床特征肝癌患者肝癌组织中EGF、AR、EGFR的阳性表达情况(n=90)
2.3 肝癌组织中EGF、AR、EGFR 表达影响因素的多因素分析
将单因素分析中有统计学意义的因素作为自变量,将EGF、AR、EGFR表达情况作为因变量进行Logistic回归分析(赋值:无淋巴结转移=0,有淋巴结转移=1;TNM分期为Ⅰ+Ⅱ期=0,TNM分期为Ⅲ+Ⅳ期=1),结果显示,淋巴结转移、TNM分期是肝癌组织中EGF、AR、EGFR表达的独立影响因素。(表 3~5)
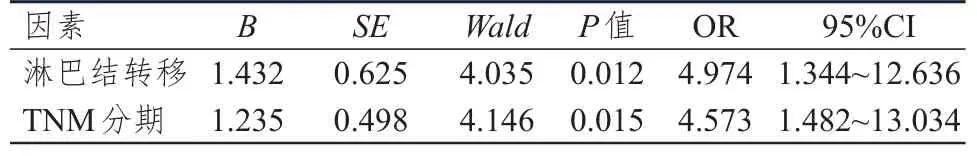
表3 肝癌组织中EGF表达影响因素的多因素分析(n=90)
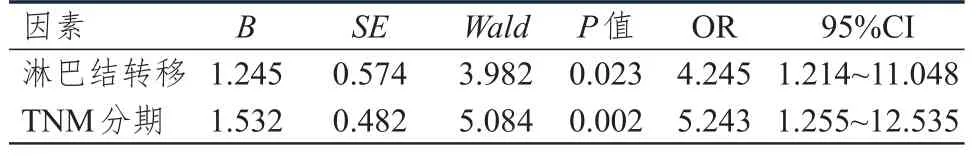
表4 肝癌组织中AR表达影响因素的多因素分析(n=90)
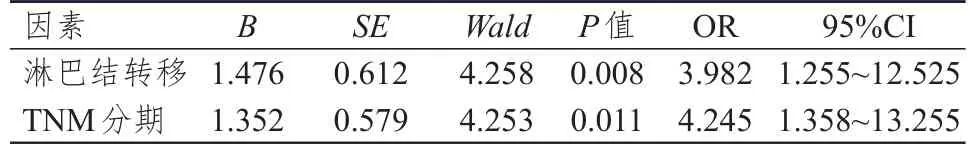
表5 肝癌组织中EGFR表达影响因素的多因素分析(n=90)
3 讨论
EGF的分子量约为6.040 kD,其分子N端结构域主要负责与受体结合,C端与促细胞生长活性功能有关[4]。EGF可被多种器官合成,其产生、释放主要受神经及激素的影响,如生长抑素、胃泌素等。EGF可促进多种细胞分裂、增殖,并可促进蛋白合成,改变细胞骨架,诱导C-myc、C-fos等原癌基因的表达。多种恶性肿瘤存在EGF异常表达的情况,且其表达水平与患者的分化程度及预后密切相关。EGFR作为EGF的主要受体,分子量约为170 kD,主要存在于细胞膜表面。EGFR与EGF等配体结合后,可由单体转化为二聚体,并诱导细胞内Y992、Y1068等激酶路径活化,促使细胞自磷酸化,并介导下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、蛋白激酶 B(protein kinase B,PKB,也称AKT)以及c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路,最终诱导细胞增殖、分裂[5]。研究表明,EGFR是多条信号通路的交汇点,是细胞生长、增殖、分化及黏附等生理活动的重要介质[6-7]。健康组织中的EGFR表达水平较低,而乳腺癌、肾癌、结肠癌和肝癌等肿瘤细胞内的EGFR呈明显高表达[8]。高表达的EGFR将参与肿瘤细胞增殖、血管新生、细胞凋亡抑制以及肿瘤侵袭、转移等病理变化过程[9],其可能机制:①EGFR高表达可强化下游信号的传导,促使细胞异常增殖、分裂[10];②突变型EGFR配体如EGF等的异常表达将诱导EGFR持续活化,并参与肿瘤细胞凋亡抑制过程;③EGFR高表达还可增强细胞的自分泌环作用,促进细胞增殖[11]。AR是由918个氨基酸组成的核蛋白,可与雄激素反应元件的顺式增强子序列结合,并调节基因的转录水平[12-13]。AR的转录激活功能可被核受体辅助因子介导,这些辅助因子可借助多级作用诱导组蛋白甲基化、乙酰化,从而修饰染色体,并促进RNA聚合酶Ⅱ转录起始复合物与启动子相互作用,激活基因转录进程,诱导蛋白质生成,最终调控细胞生长[14-15]。临床研究表明,肝癌细胞细胞质中AR的浓度明显高于癌旁组织和正常肝组织[16]。
本研究中,肝癌患者肝癌组织中EGF、AR、EGFR的阳性表达率均明显高于非肝癌组织(P<0.01),表明EGF、AR、EGFR高表达与肝癌的发生、发展密切相关;进一步研究发现,有肝炎史、TNM分期为Ⅲ+Ⅳ期、分化程度为中低分化、有淋巴结转移的肝癌患者肝癌组织中EGF、AR、EGFR的阳性表达率较高,表明EGF、AR、EGFR与肝癌患者是否有肝炎史、TNM分期、分化程度和淋巴结转移情况密切相关。多因素分析结果显示,淋巴结转移情况和TNM分期是肝癌患者EGF、AR、EGFR表达的重要影响因素。
综上所述,EGF、AR、EGFR高表达与肝癌的发生、发展密切相关,且其表达与患者的淋巴结转移情况和TNM分期密切相关,临床可通过对其进行检测从而评估肝癌患者的TNM分期和淋巴结转移情况。肝癌病机复杂,EGF、AR、EGFR等细胞因子与肝癌的关系亦复杂多变,本研究仅分析了EGF、AR、EGFR异常表达与肝癌的关系,其具体机制尚待进一步研究。

