腹腔镜经括约肌间切除术对低位直肠癌患者肛门功能及预后的影响
张伟,唐文慧,赵磊
北京市大兴区人民医院1普外科,2呼吸与危重症医学科,北京 102600
直肠癌是一种常见的消化系统恶性肿瘤,其中低位直肠癌发生率最高,占总发生率的70%~80%,直肠慢性炎症、饮食与致癌物质及遗传易感性等是直肠癌发生的主要原因,可导致腹泻、血便、便秘等症状,甚至发生大小便失禁、下肢浮肿等,严重影响患者生活质量[1-2]。保肛治疗是低位直肠癌治疗的关键,其中经括约肌间切除术是常见的保肛治疗方法,可游离直肠至肛提肌平面,经内外括约肌间隙将肛管皮肤切除,分离至括约肌外侧间隙,并将其拖出并切除,然后进行结肠肛管吻合[3]。既往多采用开腹手术进行治疗,但术中需广泛切除,无法较好的恢复肛门功能。近年来,随着腹腔镜技术水平的不断提高,经括约肌间切除术治疗中腹腔镜技术得到广泛使用,且获得较好的效果[4-5]。因此,本研究对进一步探讨腹腔镜经括约肌间切除术在直肠癌治疗中的应用效果,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年7月至2017年11月北京市大兴区人民医院收治的92例低位直肠癌患者。纳入标准:①术前均经直肠腔内超声和盆腔磁共振(MRI)检查确诊,且肿瘤未侵犯肛管直肠环;②肿瘤下缘距肛管直肠环<2 cm,距齿状线≥2 cm;③非同时性多发性原位癌,无需联合切除脏器。排除标准:①已发生远处转移;②术前肛门括约肌松弛;③组织类型为未分化癌;③TNM分期为T4期;④术前已出现大便失禁肛门功能障碍;⑤肿块侵及耻骨直肠肌或肛门外括约肌。随机数表法将92例低位直肠癌患者分为观察组和对照组,各46例。对照组中男25例,女21例;年龄40~75岁,平均年龄为(58.81±8.75)岁;TNM分期:Ⅰ期18例,Ⅱ期19例,ⅢB期9例;分化程度:低分化7例,中分化28例,高分化11例。观察组中男26例,女20例;年龄40~76岁,平均年龄为(58.76±8.62)岁;TNM分期:Ⅰ期15例,Ⅱ期21例,ⅢB期10例;分化程度:低分化5例,中分化32例,高分化9例。两组患者性别、年龄、TMN分期及分化程度比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医学伦理委员会批准,所有患者及家属均对本研究知情同意并签署知情同意书。
1.2 治疗方法
对照组患者接受传统开腹手术治疗,全身麻醉后,在耻骨向上绕脐部下腹部正中部位做一3~4 cm切口,结扎肠系膜系动、静脉,保持距肿瘤上缘10~15 cm。彻底切断乙状结肠和系膜,同样沿着Waldeyer筋膜面及前部间隙Denonvillier筋膜游离于整个直肠处,手术助手将肛门自坐骨结节处推送至盆腔内部,保持位移3~4 cm。临床医师根据盆腔内的直肠裂孔情况,向下压迫肛提肌,完全分离内外部括约肌,直至切除直肠。观察组患者接受腹腔镜经括约肌间切除术:全身麻醉后,在脐下缘处开一个直径10 mm的孔,然后左右下腹约麦氏点处各做一个直径为5 mm及10 mm的小孔,置入手术器械。建立二氧化碳气腹,并保持压力为12~14 mmHg。中央处入路,处理肠系膜下静脉及动脉。沿直肠后部间隙Waldeyer筋膜面及前部间隙Denonvillier筋膜游离整个直肠,保证直肠完整。手术过程中全面保护输尿管及盆腔部位神经,同时在向上分离内外括约肌时,在腹腔内引导直肠和肛提肌的相交处,准确切除直肠。两组患者均接受结肠肛管吻合术。
1.3 观察指标
①比较两组患者住院时间、肛门排气时间、手术时间和术中出血量等手术相关指标。②术前及术后3个月,比较两组患者肛门直肠指标,包括排粪频率、肛管静息压(anal resting pressure,ARP)、直肠最大耐受容量(rectal maximum tolerable,RMTV)和肛管最大收缩压(anal maximum squeeze pressure,AMSP)。③术前、术后3个月、6个月及12个月,采用肛门失禁评分(Wexner continence grading scale,Wexner)评分评估肛门功能,共包含5个项目,每项0~4分,得分越高表示肛门功能越差。④比较两组患者术后并发症情况,包括术后吻合口瘘、吻合口狭窄、肺部感染、直肠阴道瘘和切口感染发生情况。
1.4 统计学方法
采用SPSS 18.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以例数和率(%)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 手术相关指标
观察组患者术中出血量明显少于对照组患者,手术时间、肛门排气时间和住院时间均明显短于对照组患者,差异均有统计学意义(P<0.01)。(表1)
表1 两组患者手术相关指标比较(±s)

表1 两组患者手术相关指标比较(±s)
注:*与观察组比较,P<0.01
指标术中出血量(ml)手术时间(min)肛门排气时间(d)住院时间(d)对照组(n=46)185.68±16.34*281.38±23.87*5.67±0.68*14.53±0.59*观察组(n=46)82.37±10.23 210.35±21.37 2.38±0.24 10.29±0.58
2.2 肛门直肠指标
术前,两组患者排粪频率、ARP、RMTV和AMSP比较,差异均无统计学意义(P>0.05)。术后3个月,两组患者排粪频率均高于本组术前,ARP、RMTV和AMSP均低于本组术前,且观察组患者术后排粪频率高于对照组患者,ARP、RMTV和AMSP均低于对照组患者,差异均有统计学意义(P<0.05)。(表2)
2.3 Wexner评分比较
术前、术后12个月,两组患者Wexner评分比较,差异均无统计学意义(P>0.05);术后3、6个月,观察组患者Wexner评分均低于对照组患者,差异均有统计学意义(P<0.05)。术后3、6、12个月,两组患者Wexner评分均高于本组术前,差异均有统计学意义(P<0.05)。(表3)
2.4 并发症发生情况比较
观察组患者术后并发症总发生率为10.87%(5/46),低于对照组患者的28.26%(13/46),差异有统计学意义(χ2=4.420,P=0.036)。(表4)
表2 术前和术后3个月两组患者肛门直肠指标比较(±s)
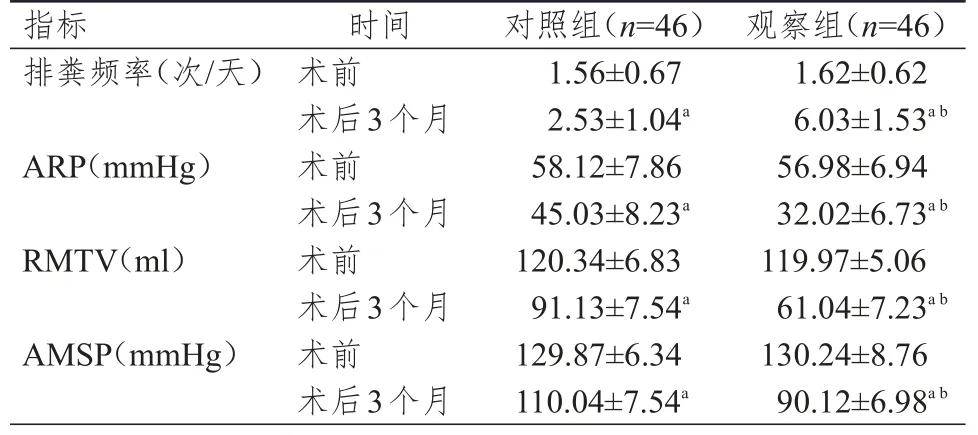
表2 术前和术后3个月两组患者肛门直肠指标比较(±s)
注:a与本组术前比较,P<0.05;b与对照组比较,P<0.05
指标排粪频率(次/天)ARP(mmHg)RMTV(ml)AMSP(mmHg)时间术前术后3个月术前术后3个月术前术后3个月术前术后3个月对照组(n=46)1.56±0.67 2.53±1.04a 58.12±7.86 45.03±8.23a 120.34±6.83 91.13±7.54a 129.87±6.34 110.04±7.54a观察组(n=46)1.62±0.62 6.03±1.53a b 56.98±6.94 32.02±6.73a b 119.97±5.06 61.04±7.23a b 130.24±8.76 90.12±6.98a b
表3 手术前后两组患者Wexner评分比较(±s)

表3 手术前后两组患者Wexner评分比较(±s)
注:a与本组术前比较,P<0.05;b与对照组比较,P<0.05
时间术前术后3个月术后6个月术后12个月对照组(n=46)1.34±0.56 5.03±0.96a 4.03±1.13a 2.43±0.87a观察组(n=46)1.41±0.53 2.93±1.21a b 2.34±0.86a b 2.13±0.76a
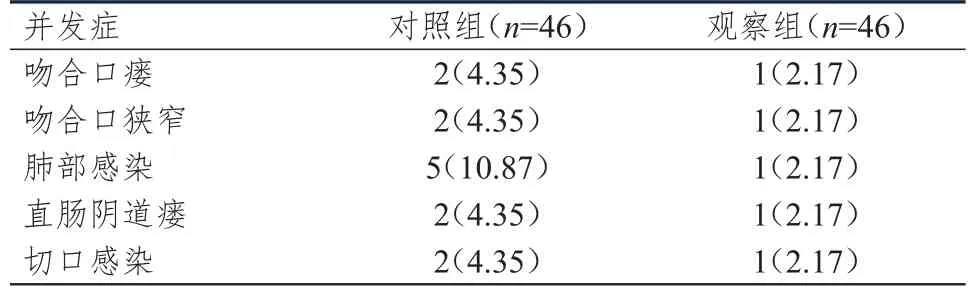
表4 两组患者术后并发症发生情况[n(%)]
3 讨论
直肠癌是发病率仅次于肺癌及胃癌的恶性肿瘤,目前,手术是治疗直肠癌的常用方法,既往多采用开腹手术治疗[6]。但随着低位直肠癌发病率的不断升高,多数患者被发现时病情已处于中晚期,常规开腹手术易对影响患者术后肛门功能恢复情况,预后较差[7-8]。随着微创手术水平的不断提高,腹腔镜在临床治疗中得到推广使用,且获得较好的效果。
经括约肌间切除术可通过切磋直肠壁延续增厚的肛管内括约肌,待获得阴性切缘后,可在一定程度上保留肛门功能,并保持肛门外括约肌的控粪功能[9]。而本研究结果显示,观察组患者术中出血量明显少于对照组患者,手术时间、肛门排气时间和住院时间均明显短于对照组患者,差异均有统计学意义(P<0.01),表明腹腔镜经括约肌间切除术可有效降低术中出血量,有利于患者术后恢复。
既往临床多采用开腹手术治疗低位直肠癌,但手术创伤较大、出血量多,导致术野不清,无法对病理解剖结构进行准确判断,常进行广泛切除,从而增加了出血风险,导致多种并发症,不利于患者术后恢复。而腹腔镜经括约肌间切除术可在腹腔镜辅助下分离直肠周围血管、神经等,切除病变直肠[10-11]。同时,在腹腔镜下手术可放大术野,准确定位筋膜脏层及壁层间的间隙,有效提高手术入路的稳定性,有助于医师对盆腔内自主神经、组织进行准确辨认,减少损伤输尿管及肛门器官,有助于恢复患者术后肛门排气及排便功能[12-13]。
ARP是安静时肛管内的压力,其中肛门内外括约肌产生的压力约占70%;AMSP是指患者最大力量收缩肛门时产生的压力,肛管横纹肌收缩是其发生原因的主要原因[14]。本研究中,术后3、6个月,观察组患者Wexner评分均低于对照组患者;术后3个月,观察组患者术后排粪频率高于对照组患者,ARP、RMTV和AMSP均低于对照组患者,差异均有统计学意义(P<0.05),表明腹腔镜经括约肌建切除术可有效改善肛肠动力学情况,改善近期肛门功能。这可能是因为腹腔镜经括约肌间切除术治疗在盆腔的操作细致、损伤小,还可有效保护自主神经,有助于较好的保留和恢复肛门功能。同时该术中可尽可能保留括约肌,有助于术后残余括约肌功能恢复,改善术后排便情况[15-16]。本研究中,观察组术后并发症发生率低于对照组患者,表明腹腔镜经括约肌间切除术可有效减少术后并发症发生,改善患者预后。腹腔镜经括约肌间切除术操作过程中可在放大直视的情况下准确切除局部病灶,精确定位边缘,避免发生开腹手术肿瘤边缘定位盲目性吻合障碍情况,极大地降低吻合口瘘、切口感染等并发症发生率[17-18]。
为顺利完成腹腔镜经括约肌间切除术,还需注意以下七个方面:①保持肛管切除线垂直于肛管,将内括约肌全层切透至内外括约肌间隙,然后向腹部游离,方向与间隙方向一致。②为使患者术后控便功能更好,在根治的情况下尽量保留齿状线及部分内括约肌[19]。③为避免术中肿瘤细胞脱落至创面增加转移风险,应在全周切离内括约肌后缝合闭锁断端。④外括约肌呈红色、肌纤维粗大,电刀切割时有肌肉收缩;内括约肌呈粉白色、肌纤维纤细,电刀切割时出现无肌肉收缩。⑤若不能保证切线安全,则应进行术中快速冰冻病理检查,若切缘肿瘤细胞阳性可追加切除尾侧,再次进行冰冻病理检查,若仍为阳性则需采用腹会阴联合切除术[20]。⑥为避免损伤外括约肌或直肠,需在肛门内外括约肌间隙层面进行分离。⑦积累腹腔镜手术经验,并严格掌握手术适应证。同时低分化腺癌、肿瘤侵犯外括约肌及肿瘤下缘侵及齿状线为腹腔镜经括约肌间切除术的禁忌证。
综上所述,腹腔镜经括约肌间切除术治疗低位直肠癌效果显著,可有效改善患者近期肛门功能,缩短术后恢复时间,改善患者预后。

