辣椒种子中拮抗青枯病菌内生细菌的促生功能分析
牟玉梅 李菲 范高领 邢丹 蓬桂华
摘 要:以拮抗青枯病菌的辣椒种子内生细菌为对象,研究并了解其促生功能多样性、促生效应等,为辣椒种子内生细菌的开发利用提供理论支撑。测定了6株内生细菌的多样化生物学功能,进行种子催芽和盆栽促生试验。结果表明,产IAA、溶磷、固氮、产嗜铁素是供试菌株中普遍具备的功能,6株内生细菌中有5株具有3种及3种以上的促生功能。所有内生细菌菌悬液均能显著地促进辣椒种子萌发和植株生长,增强种子活力,提高壮苗指数,具有较好的促生效果。辣椒种子内生菌菌株对辣椒具有较好的防病促生效果,具有开发微生物农药和菌肥的巨大潜力。
关键词:辣椒种子;内生细菌;拮抗作用;功能多样性
中图分类号:S633.3 文献标志码:A 文章编号:1673-2871(2020)07-056-05
Abstract:This experiment is to study and understand the function diversity and effect of cayenne pepper seed endophytic bacteria, which antagonizes cayenne pepper seed, and providing theoretical support for the development and utilization of endophytic bacteria in pepper seeds. The biological functions of 6 endogenous bacteria were determined by seed germination and plant growth in pot. IAA production, phosphorus dissolution, nitrogen fixation, and ferrophilic production are a common function of the tested strains. Five of the six endogenous bacteria have three or more probiotic functions. All endogenous bacterial suspensions can significantly promote the seed germination and growth of pepper, enhance the seed vitality, and improve the seedling index, which has a good effect of promoting growth. Endophytic bacterial strains of pepper seeds have good disease control and growth promotion effects on pepper, and have great potential to be developed as microbial pesticides and bacterial fertilizer.
Key words: Pepper seeds; Endophytic bacteria; Antagonistic effect; Functional diversity
内生菌是一类生活在植物体内且对植物无明显不利影响的微生物的总称[1]。植物内生菌的生物多样性十分丰富,其在自然选择条件下会产生与宿主植株相同或相似的生理生化活性物质[2],通过合成植物激素、产生铁载体、生物固氮等多种方式促进宿主种子萌发和植物生长,协助宿主植物抵御病原菌及不良的生长环境[3-4]。已有研究发现,内生菌除具有生防功能多样性外,还兼有一定的促生效果。程亮[5]从矮火绒草植株根、茎、叶和种子部位分离获得52株内生细菌,发现其中11株有拮抗病原真菌能力、9株有产IAA能力、7株有溶磷活性、7株有固氮活性、20株有除草活性、13株有耐低温能力和8株有促生作用。 蔡长平等[6]从连作重茬地辣椒健康植株根系中分离出内生拮抗细菌PEB-99,发现该内生细菌除抑菌活性较强之外,还能产生铁载体、吲哚-3-乙酸(IAA),具有较强的溶解有机磷的能力。 焦蓉等[7]从烟草种子中分离筛选出4株对烟草疫霉具有较强抑制作用的拮抗菌株,其对烟草病害有良好的防治效果,还能促进烟草种子萌发、显著提升各项生理指标,促进烟草幼苗的生长。张波等[8]发现,将从茅苍术分离的4种内生真菌对茅苍术种子进行浸种处理后,种子发芽率、发芽势都高于对照。金梦军等[9]发现,从青藏苔草中分离的内生菌株1Y4对黄瓜和辣椒的株高、茎粗、鲜质量和干质量具有明显促进作用。但目前针对辣椒种子内生菌促生功能的报道尚不多见。因此,笔者以贵州省辣椒研究所辣椒栽培技术研究课题组从辣椒种子中分离的6株对辣椒青枯病菌具有较强抑制作用的内生细菌为材料,开展促生功能多样性、促生效应等方面研究,探究辣椒种子内生细菌的促生特性和功能,为辣椒种子内生菌株的开发及利用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试内生菌株 2017年3月,以从抗辣椒青枯病的辣椒种子(编号7号和8号)中筛选出的6株拮抗辣椒青枯病菌的内生细菌(gz1、gz6、gz7、gz11、gz13、gz14)为供试菌株,在贵州省農业科学院辣椒研究所贵阳试验基地及实验室开展内生细菌促生功能研究。
1.1.2 培养基 营养肉汤培养基、NBRIP无机磷培养基、NFb无氮培养基、CAS培养基、蛋白酶检测培养基、DF固体培养基、纤维素酶检测培养基。
1.2 方法
1.2.1 内生细菌功能多样性分析 产IAA的检测:采用Salkowskis试剂微孔板比色法测定IAA[10]。在波长530 nm用酶标仪测定吸光值,以浓度0、20、40、60、80 mg·L-1的分析纯IAA标准液制作标准曲线。未接种的培养基作为空白对照。
溶磷能力的检测:定性测定:挑取待测菌株的单菌落点接于NBRIP平板上[11],点接无菌水为阴性对照,置于30 ℃培养10 d,观察有无解磷圈及解磷圈的大小。以解磷圈与菌落比值大小确定其对无机磷的解磷作用,比值大,解磷能力强,比值小,解磷能力弱,比值为1时表示菌株无解磷能力。定量测定:将定性筛选出的具有溶磷性的菌株接种于营养肉汤液体培养基中,以等量无接菌液体培养基作为对照,设置3个重复,用钼锑抗比色方法进行磷含量比色测定[10,12],读取700 nm波长下吸光值,根据绘制的磷标准曲线,得到培养液中的有效磷数值。
潜在固氮能力和产酸能力的检测:将待测菌株穿刺接种于含有0.5%庶糖的NFb无氮培养基,30 ℃培养7 d,观察其生长情况,在培养基液面或液面以下出现菌膜,为阳性,未观察到菌膜的为阴性,未接种的培养基作为空白对照,转接3次。含有溴麝香草酷蓝的NFb无氮培养基由绿色变为黄色,说明培养基pH值降至6.0以下,细菌生长过程中产酸[10]。
产生嗜铁素能力的检测:挑取待测菌株的单菌落点接于CAS培养基平板上[13],置于30 ℃培养7 d,菌落周围出现黄色晕圈为阳性,无黄色晕则为阴性。测量黄色晕圈的直径,每株细菌重复检测3次。
胞外分泌蛋白酶能力的检测:在蛋白酶检测培养基平板中央放置直径5 mm的灭菌滤纸片,每张滤纸片上滴入内生细菌菌液5 μL,每处理3次重复,28 ℃恒温培养2 d后观察,观察有无透明圈产生,有透明圈产生则表明该菌可分泌蛋白酶。测量透明圈的直径,每株细菌重复检测3次[14]。
产ACC脱氨酶能力的检测:定性测定:菌株接种于含3 mmol·L-1 ACC的DF固体培养基,选取传代3次后能够在唯一氮源ACC培养基上生长的菌株为产ACC脱氨酶阳性菌株。
定量测定:将菌株接种至营养肉汤液体培养基中培养,采用Bradford 比色法测得酶蛋白的含量[15]。比活力(U·mg-1)为酶活力除以酶蛋白浓度。各菌株酶活性测定均扣除对照样品中自发产物后计算,3次重复。
产纤维素酶能力的检测:28 ℃恒温培养3~4 d后,用0.9% NaCl溶液浸泡纤维素酶检测培养基平板,每2 h除去NaCl溶液1次,冲洗并倒入新的NaCl溶液,6 h后观察菌落周围是否有黄色晕圈,有则表示可产生纤维素酶[16]。
1.2.2 不同菌株浸种对辣椒种子萌芽的影响 将含水量10 %以下的辣椒种子表面消毒,放在70 ℃的恒温箱内干热处理72 h,冷却至室温,将其放入浓度为109 CFU·mL-1内生细菌菌悬液中浸泡4 h,无菌水冲洗3次后,用培养皿纸床法恒温保湿催芽,每培养皿放置100粒种子,检测出芽率。同时,以LB培养液替代菌悬液浸种作为对照。
从种子出芽开始,每天观察记录发芽情况,发芽观察期为19 d,以胚根长超过种子长度的1/2作为发芽标准。7 d统计发芽势,14 d统计发芽率,以19 d内的发芽数计算发芽指数。发芽势/% =供试种子7 d内的发芽数/供试种子总数×100,发芽率/% =供试种子总发芽数(第14天) /供试种子总数×100,发芽指数= Σ(日发芽数/发芽天数)。
以发芽势、发芽率和发芽指数指标,计算综合隶属函数值。根据隶属函数值,分析不同内生细菌催芽能力的差异。隶属函数值Xij用模糊数学隶属函数值方法计算。R(Xij) =(Xij-Xjmin) /(Xjmax-Xjmin)。式中:R(Xij)表示i种类菌株j指标的隶属值,Xij表示i种类菌株j指标的测定值,Xjmax、Xjmin分别表示所有参试菌株某指标的最大值和最小值。累加各指标隶属函数值并求平均值。
1.2.3 不同菌株浸种对辣椒幼苗促生作用测定 消毒、浸种同催芽试验,以LB培养液替代菌悬液浸种作为对照,辣椒播种后50 d,统计各处理成苗率,随机选择各处理适龄幼苗10株,自来水冲洗干净,用蒸馏水冲洗一遍,测量株高、茎粗、叶长、叶宽,然后105 ℃杀青,80 ℃烘干至恒重,测定根干质量、地上部干质量、全株干质量、叶绿素含量,计算壮苗指数。
成苗率/%=成活的辣椒苗/播种种子数×100;壮苗指数=(茎粗/株高+根干质量/地上部干质量)×全株干质量[17] 。
1.3 数据统计分析方法
试验数据采用Excel 2007进行录入、制作图表和计算,采用DPS 7.05进行相关统计分析。
2 结果与分析
2.1 内生细菌功能多样性分析
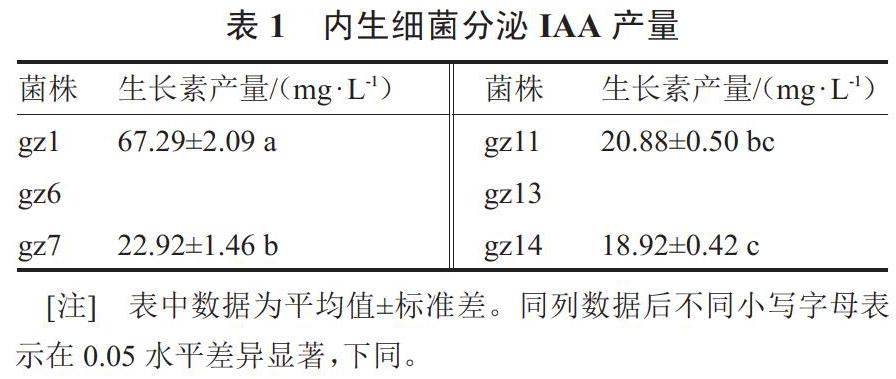
2.1.1 产IAA的能力 从表1可知,6株种子内生细菌中有4株可以分泌IAA。各内生细菌分泌生长素产量介于18.92~67.29 mg·L-1之间,其中菌株gz1分泌生长素能力最强,为67.29 mg·L-1,显著高于其他3个菌株。
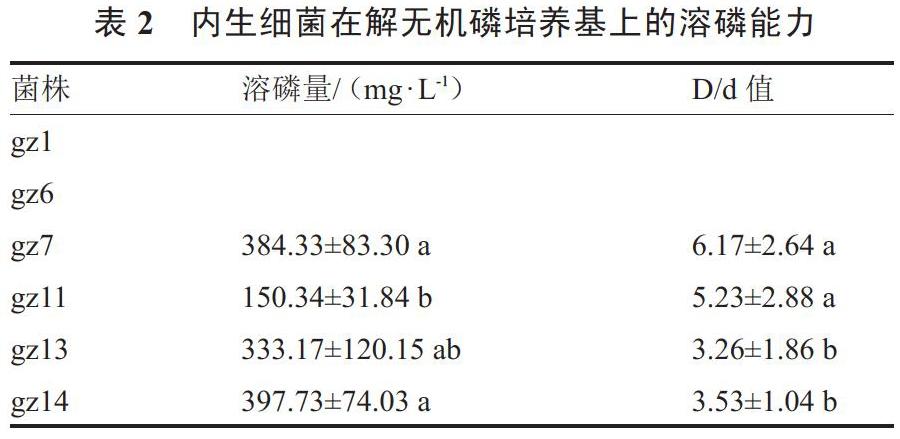
2.1.2 溶磷能力的检测 6株内生细菌中有4株内生细菌表现出不同的溶磷能力(表2)。各菌株D/d值在3.26~6.17之间,菌株gz7 D/d值最大,最小的菌株是gz13。
将具有溶磷圈的4株内生细菌利用钼锑抗比色法定量测定溶解培养基中磷酸钙的能力,其范围在150.34~397.73 mg·L-1之间,菌株gz14溶磷量最大,但D/d值不是最大,菌株gz11溶磷量最小,但其D/d值也不是最小的。可以看出解磷圈最小的,在液體培养基内溶磷活性不一定最弱;解磷圈最大的,在液体培养基内溶磷活性不一定最强。表明解磷圈直径大小与菌株液体解磷能力没有必然相关性。
2.1.3 潜在固氮能力和产酸能力 在NFb无氮培养基中的生长情况显示,有5株内生细菌(gz1、gz6、gz7、gz11、gz13)可以生长,在培养基液面或液面以下出现菌膜,表明这5株内生细菌均具有固氮能力,仅菌株gz14无固氮能力。NFb无氮培养基中所有菌株均未使培养基颜色变黄,说明均不能产酸。
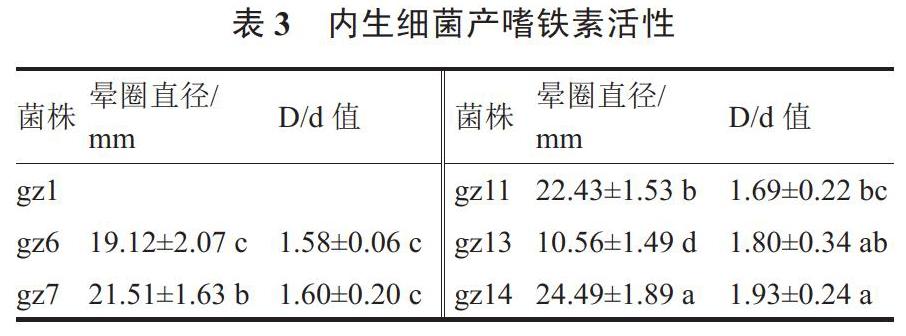
2.1.4 产嗜铁素能力 6株菌株中有5株细菌在CAS平板上能够分泌嗜铁素,螯合三价铁离子,产生黄色晕圈(表3)。晕圈直径范围在10.56~24.49 mm之间,晕圈D/d值范围在1.58~1.93之间;菌株gz14产嗜铁素能力最强。
2.1.5 分泌蛋白酶能力 6株内生细菌中有4株(gz7、gz11、gz13、gz14)能分泌蛋白酶将奶粉蛋白质降解成小分子可溶性物质(表4)。6株分泌蛋白酶菌株透明圈直径范围在36.86~49.08 mm之间,D/d值范围在1.68~2.41之间,其中菌株gz11分泌蛋白酶能力最强。
2.1.6 产ACC脱氨酶能力 将分离的6株辣椒种子内生细菌接种于以ACC为唯一氮源的DF固体培养基上,多次传代后有3株菌株(gz7、gz11、gz14)能够正常生长(表5),表明其具有ACC脱氨酶活性,其中gz7的酶比活力最高,为53.89 nmol·mg-1·h-1,显著高于其他2个菌株。
2.1.7 产纤维素酶能力的检测 6株菌株菌落周围均未产生黄色晕圈,说明菌株均不能产生纤维素酶。
2.1.8 种子内生细菌促生功能多样性分布 从辣椒种子内生细菌促生功能多样性分布可以看出(表6),产IAA、溶解磷酸钙、固氮能力、产嗜铁素、分泌蛋白酶是供试菌株中普遍具备的功能,6株内生细菌中有5株具有3种及以上的促生功能,表明辣椒种子内生细菌促生功能丰富多样,具有促进植物萌发或生长的能力。
2.2 辣椒内生细菌促生效应
2.2.1 不同菌株浸种对辣椒种子萌芽的影响 不同类型内生菌株促进辣椒种子萌芽的作用效果存在差异(表7)。由表7可知,不同内生细菌浸种处理后辣椒种子的发芽势和发芽指数差异较为明显,发芽率差异不明显。发芽势方面,6株菌株的发芽势变化幅度为18.00~62.00%,有5株内生细菌浸种处理后种子的发芽势明显强于对照,菌株gz1浸种处理辣椒种子后的发芽势明显高于其他菌株。发芽率方面,所有内生细菌浸种处理后种子的发芽率均高于对照,有4株菌株浸种处理后的发芽率大于80%,其中gz1、gz11菌株浸种处理辣椒种子的发芽率最高。发芽指数方面,所有内生细菌浸种处理后种子的发芽指数均高于对照,其中菌株gz1浸种处理辣椒种子的发芽指数明显高于其他菌株。
由表7可知,平均隶属函数值由大到小分别是:gz1、gz11、gz6、gz7、gz13、gz14、CK,表明所有内生细菌对种子的催芽能力均高于对照,其中gz1菌株催芽能力最强。
2.2.2 不同菌株浸种对辣椒幼苗促生作用 用不同内生菌株的菌悬液浸种处理后,对辣椒幼苗生长有显著的影响,大部分菌液浸种后,辣椒植株健壮、叶色深,具有较好的促生效果。由表8可知,与对照相比较,6株内生细菌浸种处理后,5株有效抑制了辣椒植株徒长,3株使辣椒叶宽变宽,3株使辣椒叶长变长,5株使叶绿素含量提高,4株使全株干质量增加,4株使壮苗指数提高。内生细菌菌悬液浸种处理使椒苗在株高、茎粗、叶绿素、全株干质量和壮苗指数等方面出现明显变化,特别是菌株gz1、gz7、gz11、gz14菌悬液浸种处理后植株叶绿素、全株干质量和壮苗指数显著优于对照,说明辣椒内生细菌具有促进辣椒壮苗形成的潜力。
3 讨论与结论
植物内生菌通过水平侵染或垂直传播,定殖于各种植物细胞内或细胞间,在长期的进化过程中与宿主植物形成了一种特殊的生态关系,正是这种关系,内生菌种类和数量在各植物体内的分布常与植物的种类、生存环境、生长阶段、营养供给及两者的基因型密切相关。种子作为植物物种延续的重要繁殖器官,也是植物内生菌垂直传播的重要方式,蕴含大量的内生细菌。种子内生菌与植物经过长期、稳定的进化选择,相比于从其他植物器官中分离的内生菌更易长期定殖生存,也更易演化出与宿主互惠互利的代谢途径。本试验结果表明产IAA、溶解磷酸钙、固氮、产嗜铁素是大部分菌供试菌株具备的功能,6株内生细菌中有5株具有3种及3种以上的促生功能,与程亮[5]从矮火绒草植株分离获得内生细菌有拮抗病原真菌能力、产IAA能力、溶磷活性、固氮活性、除草活性、耐低温能力和有促生作用的研究结果类似,表明辣椒种子内生细菌经过与宿主辣椒植株的长期相互选择,已形成了相互促进和需要的共生关系,内生细菌能分泌植株生长所需物质。将6株内生细菌对辣椒种子进行萌芽试验,对种子的催芽能力均高于对照,与张波等[8]将自茅苍术分离的4种内生真菌对茅苍术种子进行浸种处理后发芽率、发芽势都高于对照的研究结果类似,证明植物内生菌对种子萌发具有促进作用。将6株内生细菌进行育苗试验,均对辣椒幼苗生长有显著的影响,大部分内生细菌菌液浸种后的辣椒植株健壮、叶色深,均有效促进了茎叶、根系的生长及干物质积累,与金梦军等[9]关于从青藏苔草中分离的内生菌株1Y4对黄瓜和辣椒的株高、茎粗、鲜质量和干质量具有明显促进作用的报道类似,表明辣椒种子内生细菌对辣椒幼苗具有较好的促生效果。
对比内生细菌促生功能与促生效果,发现gz1、gz7、gz11、gz14处理后植株叶绿素、全株干质量和壮苗指数显著优于对照,可能与内生细菌某项独特的促生特性有关。其中:菌株gz1产IAA能力明显优于其他菌株,能有效促进植株生长;gz7溶磷能力和产ACC脱氨酶能力均很强,能促进植株对磷元素的吸收及降低植物生长时的乙烯水平;gz11具备产IAA、固氮、溶磷、产嗜铁素、产蛋白酶、产ACC脱氨酶等多种促生能力,综合功能较佳;gz14溶磷能力和产嗜铁素能力均优于其他菌株,能促进植株对磷元素和铁元素的吸收。
笔者以从抗青枯病辣椒种子中筛选出的6株拮抗青枯菌内生细菌为研究对象,通过促生功能多样性、促生效应研究,发现种子内生细菌对辣椒种子萌芽、幼苗生长具有积极促进作用,为辣椒种子内生细菌生物菌肥和生物农药的开发提供了理论基础。但在本试验中只研究和分析了内生细菌促生功能与促生效果之间可能存在的关系,对它们之间的作用机制还未深入研究。同时,为推动内生细菌生防制剂的开发与推广,下一步将针对生防菌的防病促生作用機理、发酵生产工艺以及大田施用技术等方面开展深入研究。
参考文献
[1] 张海利,陈永兵,徐坚.番茄青枯病生物防治研究进展[J].农业科技通讯,2008(8):98-101.
[2] 张萍,宋希强.兰科植物内生细菌物种多样性及其促生机理研究进展[J].热带亚热带植物学报,2012,20(1):92-98.
[3] 姚领爱,胡之壁,王莉莉,等.植物内生真菌与宿主关系研究进展[J].生态环境学报,2010,19(7):1750-1754.
[4] 丁锐,李萌凯,任光宇,等.羊耳蒜内生真菌的分离鉴定与抑菌活性筛选[J].北方园艺,2017(1):126-130.
[5] 程亮.青藏高原矮火绒草内生细菌多样性及生物功能分析[J].南方农业学报,2019,50(10):2222-2233.
[6] 蔡长平,黄军,曾艳,等.一株辣椒内生拮抗细菌的筛选及初步鉴定[J].湖南农业科学,2018(7):1-4.
[7] 焦蓉,刘剑金,杨焕文,等.抑制烟草黑胫病菌和促烟草幼苗生长内生菌的分离与鉴定[J].云南农业大学学报(自然科学),2018,33(6):1037-1045.
[8] 张波,王宏伟,肖逸,等.浸种及接种内生真菌对茅苍术种子发芽与幼苗生长的影响[J].江苏农业科学,2012,40(9):227-230.
[9] 金梦军,李珊珊,田文波,等.高寒草地青藏苔草拮抗内生细菌筛选、鉴定及其促生作用测定[J].植物保护学报,2019,46(4):779-786.
[10] 许明双.番茄和水稻种子可培养内生细菌的多样性分析及促生菌功能研究[D].北京:中国农业大学,2014.
[11] NAUTIYAL S C.An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J].FEMS Microbiology Letters,1999,170(1):265-270.
[12] MURPHY J,RILEY J P.A modified single solution method for the determination of phosphate in natural waters[J].Analytic Chimica Acta,1962,27:31-36.
[13] SCHWYN B,NEILANDS J B.Universal chemical assay for the detection and determination of siderophores[J].Analytical Biochemistry,1987,160(1):47-56.
[14] ZHANG J,WANG ZH Y,HAN Y,et al.Isolation and identincation of alkaline proteprotease-producing bacteria[J]. Chemistry&Bioengineering,2006,23(10):42-43.
[15] PENROSE D M,GLICK B R.Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J].Physiologia Plantarum,2003,118(1):10-15.
[16] 張振粉,师尚礼.甘农三号紫花苜蓿种带细菌的生物功能分析及鉴定[J].草业学报,2018,27(1):152-160.
[17] 王正,刘明池,季延海,等.潮汐灌溉时间对茄子穴盘苗质量的影响[J].河北农业大学学报,2015,38(6):31-35.

