响应面法优化海南可可豆中原花青素的提取工艺
房一明 初众 谷风林 贺书珍 赖剑雄
摘 要:本研究采用响应面分析法确定海南可可豆中原花青素提取的最佳工艺条件,对提取得率的影响因素进行单因素分析后,探讨料液比、乙醇浓度、提取时间和温度间的显著性影响和交互作用。结果表明:可可原花青素的最优提取工艺条件为乙醇浓度67%、料液比1∶20(g/mL)、提取时间88 min、提取温度76 ℃。此工艺条件下,可可原花青素提取得率为6.21%。此结果为海南可可豆的开发利用提供基础理论依据。
关键词:可可;原花青素;提取得率;响应面分析法
中图分类号:S571.3 文献标识码:A
Abstract: The extraction of procyanidin from the cocoa beans of Hainan was investigated by the response surface methodology. Single experiments were used to explore the effects of material-to-liquid ratio, extraction concentration, extraction times and extraction temperature on the yield of procyanidin. Based on the analysis of significance and interaction among different factors, the optimal condition of extraction technology was obtained as followed: solvent concentration 67%, material-to-liquid ratio 1∶20 (g/mL), time 88 min and temperature 76 ℃. The extraction rate of procyanidin of the optimized procedure reached 6.21%. The results provide a theoretical basis for the exploitation and utilization of cocoa beans in hainan.
Keywords: cocoa beans; procyanidin; extraction rate; response surface methodology
DOI: 10.3969/j.issn.1000-2561.2020.04.020
可可为热带地区重要的经济作物,因其独特的风味和营养价值,被广泛应用于巧克力、固体饮料、休闲食品、医药品、化妆品等领域[1]。近年来,国内外对可可的相关研究主要集中在可可豆中的多酚类物质。研究结果表明,可可豆是一种富含多酚类物质的食品来源,其具有极强的抗氧化活性,能有效地清除羟自由基(?OH)和超氧阴离子自由基(O2??),有效地抑制脂质氧化[2]。
可可豆中富含多酚类物质,其可以进一步分类为类黄酮,并且这些类黄酮中含有丰富的原花青素[3]。在可可豆中最常见的类黄酮是黄烷-3-醇、儿茶素、表儿茶素和原花青素,其中原花青素含量较高。黄酮类化合物是可可豆中重要的组成成分,其能够提供潜在的心血管健康益处,有助于平衡体内胆固醇,具有抗氧化作用[4]。虽然已知可可豆中含有多酚类化合物,但总含量因原产国、加工方式等不同而异。原花青素或缩合单宁主要由儿茶素的二聚物,低聚物和聚合物组合而成[5],这些原花青素使可可豆的风味呈现苦味[6]。谷风林等[7]研究了海南可可豆的多酚含量,对不同发酵方式下的可可多酚类化合物进行了定量分析;Nazaruddin等[8]研究发现,在可可豆发酵过程中,由于进一步的氧化作用,多酚化合物缩合,豆中的原花青素浓度降低;Gultekin等[9]研究表明,焙烤中温度的升高显著降低了包括原花青素的多酚水平。目前,关于可可发酵豆的原花青素优化提取工艺的研究未见报道。
响应面分析法(response surface methodology, RSM)是合理利用试验设计,采用多元二次回归方程拟合因素与响应值之间的函数关系,通过分析回归方程从而寻求最佳工艺参数,解决多变量问题的一种统计学方法。能够以较少的试验数量和时间对实验进行全面研究,同时可评价各因素间的交互作用[10-11]。
为研究不同提取条件对可可豆中的原花青素提取得率的影响,本研究以海南可可豆作为研究对象,采用响应面分析法,以提取溶剂浓度、料液比、提取时间、提取温度作为影响因素,以海南可可豆中的原花青素提取得率为考察指标,对可可豆中原花青素的提取工藝进行优化,为海南可可豆的开发利用提供基础理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料 可可鲜果(品种为‘热引4号)采摘于中国热带农业科学院香料饮料研究所内,采摘时生长期为5个月,果皮为黄色、淡红色的成熟鲜果。原花青素标准品(纯度≥98%,上海源叶生物科技有限公司),香草醛(上海国药控股有限公司),甲醇(美国Fisher公司),乙醇、盐酸均为分析纯。
1.1.2 仪器与设备 FD-2A冷冻干燥机,北京博医康;Master-S plus UVF实验室专用超纯水机,中国和泰;AL104电子天平,美国Mettler-Toledo;SHZ-C水浴恒温振荡器,上海博迅;Specord 250 Plus紫外可见分光光度计,德国耶拿;DLSB- 5L/10低温冷却液循环泵,巩义予华;MB45快速水分测定仪,美国奥豪斯;R-215旋转蒸发仪,瑞士步琪。
1.2 方法
1.2.1 实验材料的制备 收获新鲜成熟可可果,将其中的可可鲜豆取出并放入木箱中发酵,箱底部留有排液孔,发酵时可可鲜豆外层果肉中的胶体粘液物质化成发酵液伴随发酵进程排出,周围保持通风,发酵时木箱上部用亚麻布覆盖[12]。发酵木箱(0.8 m×0.8 m×0.8 m)由中国热带农业科学院香料饮料研究所提供,可可果为同一季节收获并成熟。发酵时间为7 d,期间定时用木铲搅拌可可豆,并进行倒箱,发酵完成后的豆子经清洗、日晒干燥、真空冷冻干燥、去皮、精磨、脱脂待用。
1.2.2 原花青素标准曲线的绘制 采用香草醛-盐酸法,在Ma等[13]的研究方法基础上,略作修改。准确称取原花青素标准品20 mg放于50 mL容量瓶并用色谱甲醇充分溶解定容。准确吸取原花青素标准溶液0.1、0.5、1.0、1.5、2.0、2.5 mL,放于10 mL容量瓶中并用甲醇定容。分别取1 mL于10 mL具塞試管中,依次加入3 mL香草醛甲醇溶液(4%)和1.5 mL浓盐酸,用甲醇稀释至刻度并混合均匀,室温条件下,避光反应20 min;将去离子水替代样品反应体系作为参比,于500 nm处测定吸光度。拟合不同浓度的吸光度值,得到标准曲线,以吸光度值对质量浓度进行回归分析,得到标准曲线方程为y=8.8703x+ 0.0345,R2=0.9927。
1.2.3 可可豆中原花青素的测定 参照Ma等[13]研究的提取方法并略作修改,准确称取脱脂的可可粉置于50 mL具塞锥形瓶中,加入提取溶剂乙醇后放入水浴恒温振荡器中加热提取,提取液通过0.45 ?m微孔滤膜真空抽滤,除去固形物,得到待测溶液。准确量取1 mL待测溶液,用提取溶剂稀释10倍,参照标准溶液的测定方法,在波长500 nm处,测定样品溶液的吸光度值,代入标准曲线方程,计算得到各样品的原花青素含量。
原花青素含量= [C×V ×n/W]×100%
式中:C为原花青素浓度(mg/mL);V为提取液的体积(mL);n为稀释倍数;W为样品的质量(mg)。
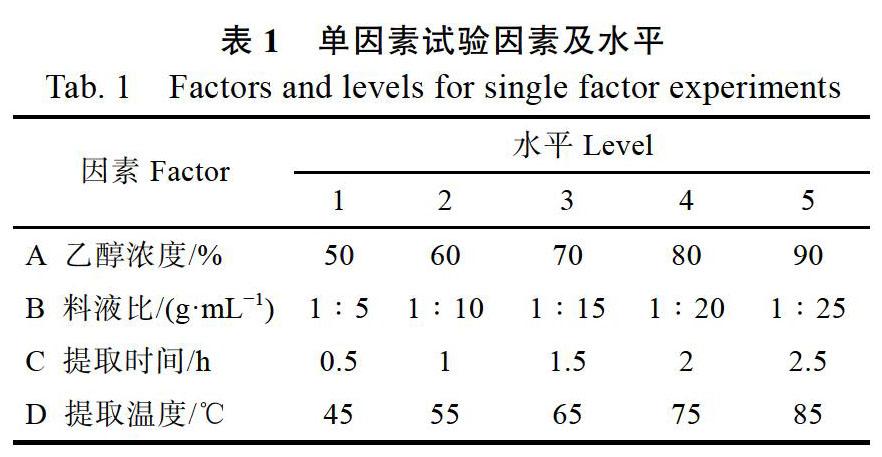
1.2.4 单因素试验 以乙醇浓度、料液比、提取时间、提取温度为因素条件进行单因素试验,分别考察各因素对可可中原花青素提取得率的影响(表1)。
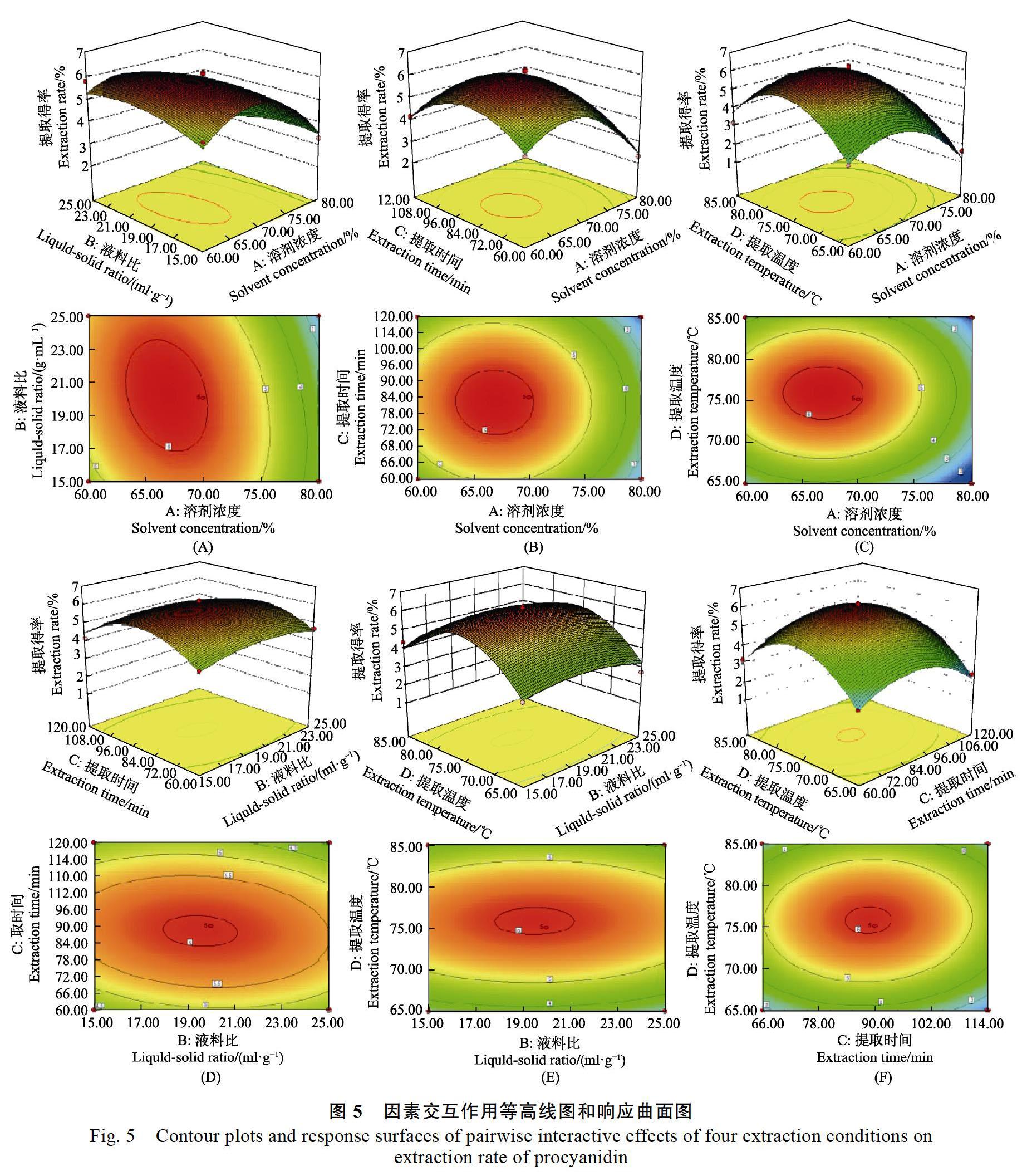
1.2.5 响应面试验 根据Box-Behnken设计原理,在单因素试验的基础上,运用Design-Expert 8.0.6软件,以可可原花青素提取得率为响应值,设置乙醇浓度(A)、料液比(B)、提取时间(C)和提取温度(D)的4因素3水平的试验条件。试验的因子及水平如表2。
1.3 数据处理
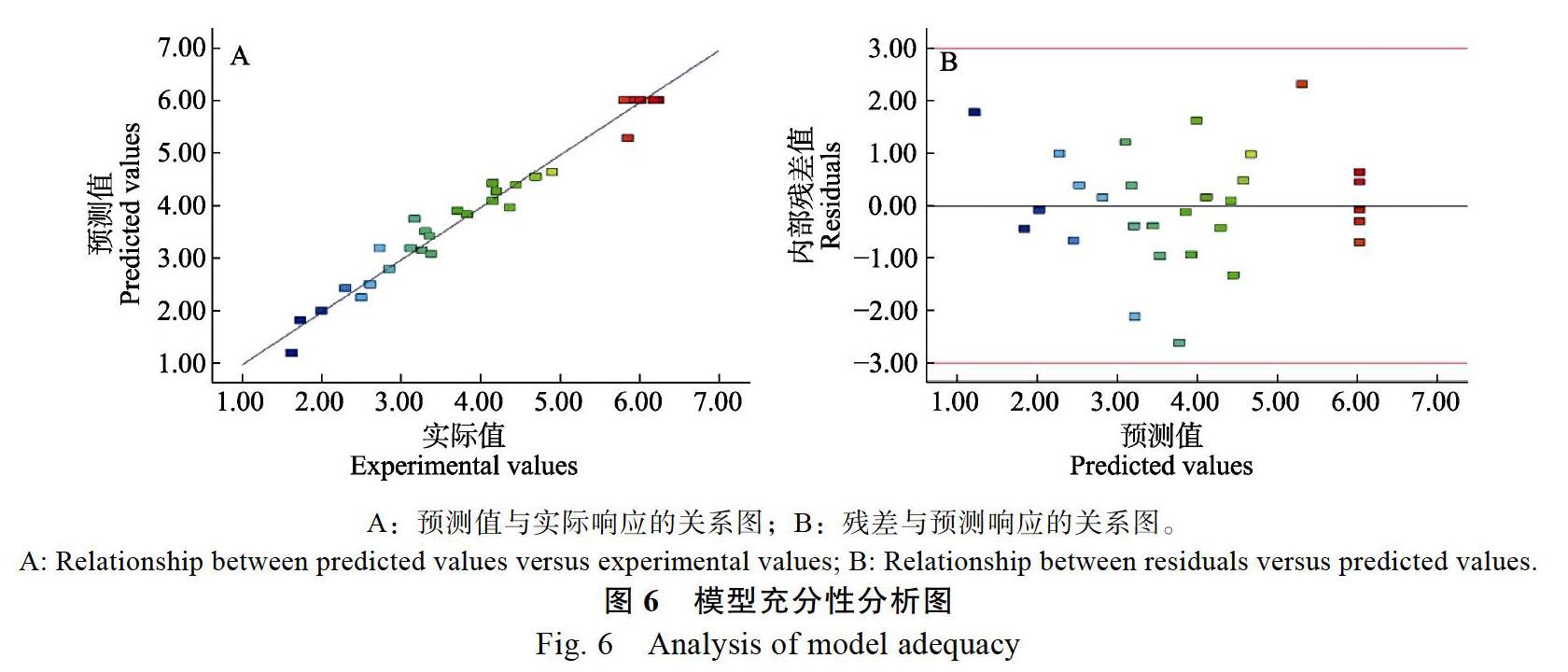
采用Origin Pro 9.1软件进行误差分析并绘制图形,用以评估不同提取条件对可可豆中原花青素提取得率的影响,使用Design-Expert 8.0.5设计软件进行响应面分析,优化海南可可豆中原花青素的提取工艺。
2 结果与分析
2.1 单因素试验分析
2.1.1 乙醇浓度对可可豆中原花青素提取得率的影响 当料液比1∶20,提取温度为75 ℃,提取时间为1.5 h时,采用50%、60%、70%、80%、90%体积分数的乙醇溶液提取可可原花青素,以乙醇浓度为横坐标,原花青素提取得率为纵坐标作图,见图1。
由图1可知,乙醇浓度对可可中原花青素提取得率有一定影响。可可原花青素得率随乙醇浓度的增加逐渐增大,乙醇浓度为70%时,可可中原花青素得率为最大值,当溶剂溶度逐渐增大时提取得率开始降低。这是由于乙醇浓度不同导致浸提溶剂极性大小不同,因此对可可原花青素的溶出效果有一定影响。同时,原花青素是一种多酚类物质,含较多羟基且具有一定极性。依据相似相溶的原理,当溶剂极性和原花青素极性相当时,溶解度达到最大。同时,得率最多,随着乙醇浓度进一步增加。其中,一部分醇溶性成分溶出,同原花青素竞争与乙醇的结合,会导致原花青素提取得率下降[14]。因此,海南可可豆中原花青素提取的最佳乙醇浓度为70%。
2.1.2 料液比对可可豆中原花青素提取得率的影响 当乙醇浓度为70%,提取温度为75 ℃,提取时间为1.5 h时,设置料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25(g/mL),以料液比为横坐标,原花青素提取得率为纵坐标作图,如图2。
由图2可知,随着料液比增大,原花青素的提取得率也逐渐增大,当料液比达到1∶20 (g/mL)时,原花青素得率达到最大值,当料液比增加至1∶25(g/mL)时,原花青素得率开始下降。这是由于随提取溶剂体积的增加,可可粉与溶剂的接触面积增大,从而有利于促进原花青素成分的溶出,当料液比增加到一定程度时,会增大杂质的溶出量,降低原花青素的纯度,且过高的料液比会造成溶剂的浪费,增加原料成本[10]。因此,1∶20(g/mL)为可可豆中原花青素提取的最佳料液比条件。
2.1.3 提取时间对可可豆中原花青素提取得率的影响 在乙醇浓度为70%,料液比为1∶20(g/mL),提取温度为75 ℃条件下,设置提取时间分别为0.5、1、1.5、2、2.5 h,设定提取时间为横坐标,原花青素提取得率为纵坐标作图,如图3。
由图3可知,随着提取时间的延长,原花青素提取得率先增大后减少,当提取1.5 h时,原花青素提取得率为最大值,当提取时间进一步增加,提取得率开始降低,这是由于延长提取时间会增加原花青素提取得率,但原花青素为热不稳定多酚类物质,提取时间过长会破坏原花青素的结构,使原花青素热分解[15]。因此,最佳的提取时间为1.5 h。
本研究中,比较了不同萃取条件下可可多酚原花青素的提取效果,通過单因素和响应曲面优化试验,结果表明,海南可可豆中原花青素的最佳提取工艺为浸提溶剂浓度67%、料液比1∶20(g/mL)、提取时间88 min、提取温度76 ℃。此条件下的原花青素提取得率为6.21%,高于Gu等[23]研究中4.1%的提取得率。模型分析可描述由响应面确定的原花青素提取得率,通过两两因素交互作用研究显示,溶剂浓度对原花青素提取得率的影响更为显著。提取温度和溶剂浓度对原花青素提取得率的影响相差不大。与料液比相比,提取时间和温度条件对海南可可豆中原花青素提取得率的影响较为显著。该研究的目的是确定可可豆中原花青素的最优萃取条件,经过优化的萃取工艺证明含有更多的原花青素,为海南可可豆中的原花青素的有效开发利用提供一定的借鉴基础。
参考文献
[1] 房一明, 谷风林, 初 众, 等. 发酵方式对海南可可豆特性和风味的影响分析[J]. 热带农业科学, 2012, 32(2): 71-75.
[2] 易桥宾, 谷风林, 那治国, 等. 发酵和焙烤对可可豆多酚、黄酮和风味品质的影响[J]. 食品科学, 2015, 36(15): 62-69.
[3] Othman A, Ismail A, Abdul Ghani N, et al. Antioxidant capacity and phenolic content of cocoa beans[J]. Food Chemistry, 2007, 100(4): 1523-1530.
[4] Steinberg F M, Bearden M M, Keen C L. Cocoa and chocolate flavonoids: Implications for cardiovascular health[J]. Journal of the American Dietetic Association, 2003, 103(2): 215-223.
[5] Guyot S, Marnet N, Laraba D, et al. Reversed-phase HPLC following thiolysis for quantitative estimation and characterization of the four main classes of phenolic compounds in different tissue zones of a French cider apple variety (Malus domestica var. Kermerrien)[J]. Journal of Agricultural and Food Chemistry, 1998,46(5): 1698-1705.
[6] Santos-Buelga C, Scalbert A. Proanthocyanidins and tannin-like compounds-nature, occurrence, dietary intake and effects on nutrition and health[J]. Journal of the Science of Food and Agriculture, 2000, 80(7): 1094-1117.
[7] 谷风林, 房一明, 徐 飞, 等. 发酵方式与萃取条件对海南可可豆多酚含量的影响[J]. 中国食品学报, 2013, 13(8): 268-273.
[8] Nazaruddin R, Seng L K, Hassan O, et al. Effect of pulp preconditioning on the content of polyphenols in cocoa beans (Theobroma Cacao) during fermentation[J]. Industrial Crops and Products, 2006, 24(1): 87-94.
[9] Gultekin Ozguven M, Berktas I, Ozcelik B. Change in stability of procyanidins, antioxidant capacity and in-vitro bioac-cessibility during processing of cocoa powder from cocoa beans[J]. LWT-Food Science and Technology, 2016, 72: 559-565.
[10] 陈 健, 孙爱东, 高雪娟, 等. 响应面分析法优化超声波提取槟榔原花青素工艺[J]. 食品科学, 2011, 32(4): 82-86.
[11] 彭芳刚, 李绮丽, 吴卫国. 响应面法优化红莲外皮原花青素的提取工艺研究[J]. 现代食品科技, 2013, 29(6): 1349-1354, 1315.
[12] Minifie B W. Chocolate, cocoa and confectionery: science and technology[M]. Netherlands: Springer, 1989.
[13] Ma X, Zhou X Y, Qiang Q Q, et al. Ultrasound-assisted extraction and preliminary purification of proanthocyanidins and chlorogenic acid from almond (Prunus dulcis) skin[J]. Journal of Separation Science, 2014, 37(14): 1834-1841.
[14] 樊梓鸾, 林秀芳, 王 麗, 等. 响应面法优化高剪切分散乳化提取悬钩子多酚[J]. 食品与生物技术学报, 2014, 33(4): 355-360.
[15] 温志英, 曹 妍. 响应面法优化花生红衣原花青素微波辅助提取工艺[J]. 中国粮油学报, 2011, 26(6): 97-101.
[16] 黄 曼, 徐丽嫚, 陈 静, 等. 响应面法优化高粱外种皮中原花青素的超声波辅助提取工艺[J]. 食品科学, 2012, 33(24): 26-30.
[17] 王长春, 林向阳, 叶南慧, 等. Plackett Burman设计和响应面分析法优化枇杷叶中总黄酮的超声波提取工艺[J]. 中国食品学报, 2013, 13(3): 84-91.
[18] 黄尚荣, 杨雪娜, 张 露, 等. 龙眼皮原花青素提取工艺优化及其抗氧化活性测定[J]. 食品科学, 2014, 35(10): 68-75.
[19] 王海燕, 李 睿, 曾 秀, 等. 响应面优化超声波提取桑叶槲皮素工艺[J]. 食品科学, 2014, 35(22): 56-62.
[20] Gunst R F. Response Surface methodology: process and product optimization using designed experiments[J]. Technometrics, 1996, 38(3): 284-286.
[21] Kuo C H, Chen B Y, Liu Y C, et al. Optimized ultrasound-assisted extraction of phenolic compounds from polygonum cuspidatum[J]. Molecules, 2013, 19(1): 67-77.
[22] 焦天慧, 芦 宇, 叶琳琳, 等. 超声波辅助提取红树莓籽中原花青素及其抗紫外活性评价[J]. 中国食品学报, 2019, 19(6): 98-105.
[23] Gu L W, House S E, Wu X L, et al. Procyanidin and catechin contents and antioxidant capacity of cocoa and chocolate products[J]. Agricultural and Food Chemistry, 2006, 54 (11): 4057-4061.

