赤小豆凝集素的分离纯化及电泳分析
肖俊琪 翟爱华,2,3 张东杰,2,3
(1. 黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2. 黑龙江省农产品加工与质量安全重点实验室,黑龙江 大庆 163319;3. 国家杂粮工程技术研究中心,黑龙江 大庆 163319)
赤小豆[Vignaumbellata(Thunb.)Ohwi and Ohashi]是亚洲豇豆属中的罕见亚种,由于具有丰富的营养价值和独特的药用价值在中国被广泛食用[1]。其蛋白质含量为22%,脂肪含量为0.3%,碳水化合物含量为65%[2],还含有一定的儿茶素、表儿茶素、槲皮素-3’-O-ɑ-L-鼠李糖苷和(±)二氢槲皮素等活性物质[3]。赤小豆可用于治疗慢性复发皮肤炎、小儿急性肾小球肾炎和一些慢性皮肤病[4],并具有重要的营养调节功能[5]和药用价值[6-7]。
目前,已发现的凝集素有57 000余种,其中豆科凝集素有1 600多种,且有近400种凝集素具有3D构象[8]。凝集素是一类能结合糖结构域的非免疫性糖蛋白或碳水化合物结合蛋白[9],可用于凝集素—捕获酶联免疫吸附试验(Lectin-Capture ELISA)中快速捕获和定量样品中的HCV E1E2抗体[10];在病原体感染的先天免疫应答中起重要作用并具有潜在的免疫调节活性[11];凝集素还具有抗生物膜特性和抑菌特性,可成为治疗疾病的潜在工具[12]。凝集素由于能特异性识别血细胞而被应用于血型检测中[13-14]。试验拟对赤小豆凝集素提取工艺进行优化,以凝集活性为指标评价其分离纯化效果。通过SDS-PAGE电泳、Q Sepharose XL阴离子交换色谱、Phenyl FF HP疏水层析色谱和Sephadex G-50凝胶过滤色谱技术进行纯化,旨在为提高赤小豆种质资源优势和豆科凝集素的开发利用提供依据。
1 材料与方法
1.1 试验材料
1.1.1 材料来源
赤小豆:大庆瑞泽丰农业技术有限公司。
1.1.2 仪器与试剂
超微量分光光度计:NanoDrop 2000c型,美国赛默飞世尔公司;
超纯水仪器:Thermo Scientific Barnstead GenPure型,美国赛默飞世尔公司;
小型垂直电泳槽:BIO-RAD MINI 4型,美国伯乐Bio-rad公司;
冷冻干燥机:Alpha 1-2 LD plus型,德国CHRISTA公司;
PBS磷酸盐缓冲溶液、PB磷酸盐缓冲液、硫酸铵、氯化钠:分析纯,中国Biosharp公司;
琼脂糖凝胶、苯基琼脂糖凝胶:分析纯,瑞典乌普萨拉公司;
交联葡聚糖凝胶:分析纯,美国通用电气公司;
电泳试剂:分析纯,美国Bio-Rad生命医学产品有限公司。
1.2 试验方法
1.2.1 提取条件优化
(1) 浸提液种类:料液比1∶15 (g/mL),pH 7.5,提取时间12 h,考察浸提液种类(ddH2O、0.01 mol/L PB、0.01 mol/L Tris-HCl、0.01 mol/L生理盐水、0.01 mol/L PBS)对凝集活性的影响。
(2) 料液比:以PBS为浸提液,pH 7.5,提取时间12 h,考察料液比[1∶5,1∶10,1∶15,1∶20,1∶25 (g/mL)]对凝集活性的影响。
(3) pH:以PBS为浸提液,料液比1∶20 (g/mL),提取时间12 h,考察pH (6.0,6.5,7.0,7.5,8.0)对凝集活性的影响。
(4) 浸提时间:以PBS为浸提液,料液比1∶20 (g/mL),pH 7.5,考察浸提时间(4,8,12,16,20 h)对凝集活性的影响。
1.2.2 响应面优化试验 在单因素试验的基础上,以料液比、pH和提取时间为试验因素,以凝集活性为响应值,运用Design Expert 8.0设计三因素三水平响应面试验。
1.2.3 硫酸铵分级沉淀 根据文献[15-16]修改如下:向粗提液中加入饱和硫酸铵溶液,分别调节饱和硫酸铵浓度至35%,40%,45%,50%,55%,60%,65%,70%,75%,80%,85%。4 ℃静置4 h,11 000 r/min离心10 min,分别收集沉淀和上清液。不同饱和浓度下的沉淀物以ddH2O复溶,并充分透析(14 kDa,36 mm),测定复溶液凝集活性,选取硫酸铵分级沉淀范围。
1.2.4 凝集活性测定 参照Park等[17]的方法。按式(1) 计算凝集活性。
(1)
式中:
Y——凝集活性,HU;
n——凝集孔的最大数量;
C——蛋白浓度,mg/mL;
V——样品体积,μL。
1.2.5 丙烯酰胺凝胶电泳 根据文献[18-19]修改如下:凝胶以5 mg/100 mL堆叠在上层,下部凝胶为12 mg/100 mL;起始电压80 V,保持15 min;分离标记后将电压调至120 V,连续运行30 min;用考马斯亮蓝R-250振荡染色15 min;使用5 mL/100 mL乙醇和10 mL/100 mL 乙酸混合溶液脱色。
1.2.6 蛋白质浓度测定 使用NanoDrop 2000C测定蛋白质浓度,PBS溶液为空白组,选取2 μL样品。
1.2.7 离子交换色谱 缓冲溶液A(20 mmol/L Tris-HCl pH 7.8)溶解样品,用预平衡的阴离子交换柱Q Sepharose XL(Q XL 1 mL)和缓冲溶液B(1 mol/L NaCl+20 mmol/L Tris-HCl,pH 7.8) 对蛋白质进行梯度洗脱(0%~100%),流速0.5 mL/min,洗脱体积20 mL。收集洗脱组分用于凝血活性检测和SDS-PAGE分析。
1.2.8 疏水层析色谱 缓冲溶液C(2.4 mol/L (NH4)2SO4+20 mmol/L Tris-HCl,pH 7.8)用于平衡色谱柱Phenyl FF HP(HiTrapTM1 mL),缓冲溶液A(20 mmol/L Tris-HCl)梯度洗脱柱上蛋白质(0%~100%),流速0.5 mL/min,洗脱体积20 mL。收集洗脱组分用于凝血活性检测和聚丙烯酰胺凝胶(SDS-PAGE)电泳分析。
1.2.9 凝胶过滤色谱 将富集的组分加载到已用缓冲溶液A(20 mmol/L Tris-HCl,pH 7.8)平衡的Sephadex G-50凝胶过滤层析柱上,流速0.5 mL/min。收集洗脱组分用于凝血活性检测和SDS-PAGE分析。
1.2.10 数据处理 运用Origin 8.0、SPSS 19.0、MaxQuant 1.6.1.0、PrimeView 5.0和Design Expert 8.0软件对数据进行分析和数据图像处理。
2 结果与分析
2.1 单因素试验
2.1.1 浸提液对凝集素提取效果的影响 由图1可知,生理盐水组和PBS组的凝集活性明显高于其他组,其中PBS组的更高,可能与PBS缓冲液具有较强的缓冲作用有关,能更好地维持凝集素的结构和活性,与苏艳玲等[20]的研究结果一致。因此,PBS溶剂为赤小豆凝集素的最优提取剂。

图1 浸提液种类对凝集素提取效果的影响
2.1.2 料液比对凝集素提取效果的影响 由图2可知,凝集活性随料液比的增加呈先增加后降低趋势。随着料液比的增加,可溶性蛋白传质动力增加,蛋白质溶解度增大[21];当可溶性蛋白浓度达最大值后,料液比的增加反而会使蛋白质浓度降低[22]。故选择料液比为1∶20 (g/mL)进行赤小豆凝集素粗提取。
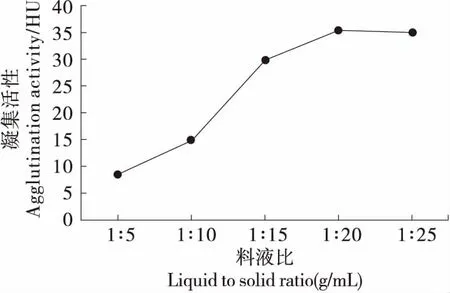
图2 料液比对凝集素提取效果的影响
2.1.3 pH对凝集素提取效果的影响 凝集素具有两性解离性质,溶液pH与蛋白等电点会影响凝集活性[23]。豆科植物凝集素等电点多为5.4~6.5,当提取剂pH接近赤小豆凝集素等电点时,凝集素聚沉凝集活性降低,偏离等电点后凝集素逐渐溶解,凝集活性增大[24]。由图3可知,当pH为 6.0~6.5时,凝集活性较低且变化不明显,当pH值继续增大至偏离凝集素等电点时,凝集素逐渐溶解,凝集活性逐渐上升,并在pH 7.5附近达最大值。因此,选择pH 7.5作为赤小豆凝集素浸提液的最佳pH值。
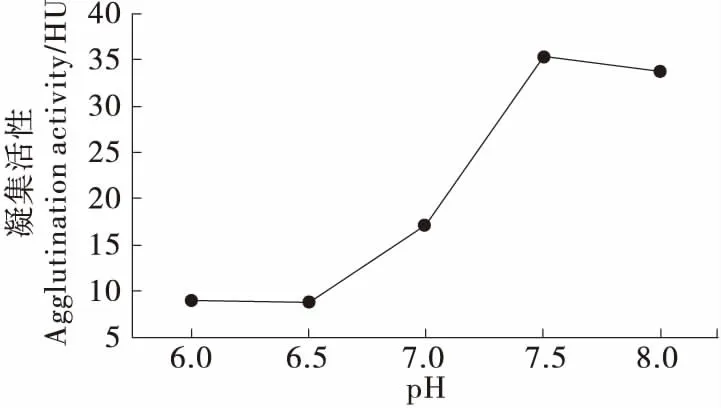
图3 pH对凝集素提取效果的影响
2.1.4 提取时间对凝集素提取效果的影响 由图4可知,凝集活性随提取时间的延长呈先上升后下降趋势,当浸提时间为16 h时,凝集活性达到峰值(35.10 HU),说明提取时间的适当延长有利于赤小豆凝集素的提取。因此,选择16 h作为赤小豆凝集素提取的最优浸提时间。
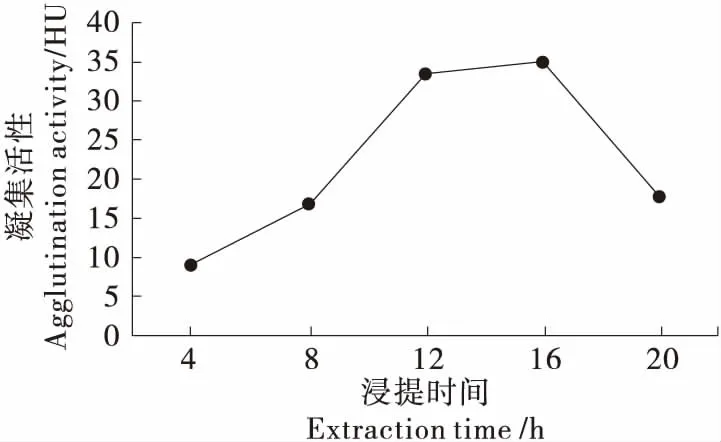
图4 浸提时间对凝集素提取效果的影响
2.2 响应面优化试验
2.2.1 试验设计与结果分析 根据单因素试验结果,以凝集活性为响应值,根据Box-Benhnken中心组合原理进行响应面设计,试验因素水平见表1,试验设计与结果见表2。

表1 响应面因素水平表
2.2.2 模型的建立及显著性检验 使用Design Expert 8.0软件对表2的结果进行多元回归分析,得凝集活性(Y)的二次多项式回归方程:
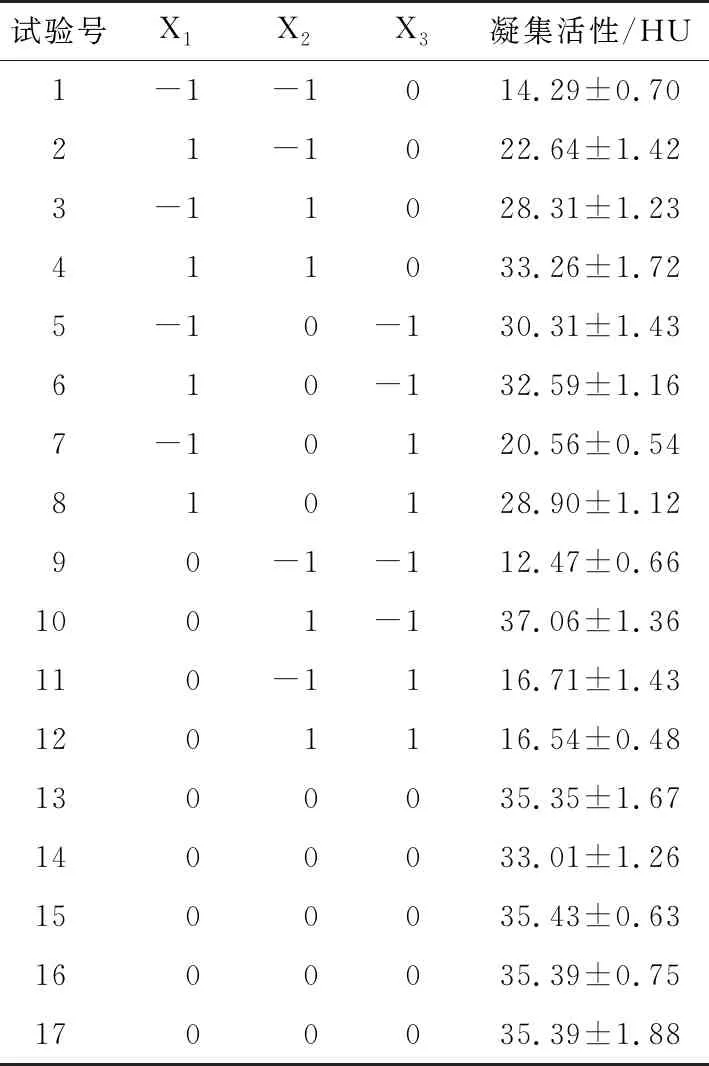
表2 响应面试验设计结果
Y=34.91+2.99X1+6.13X2-3.72X3-0.85X1X2+1.51X1X3-6.19X2X3-1.44X12-8.84X22-5.38X32。
(2)
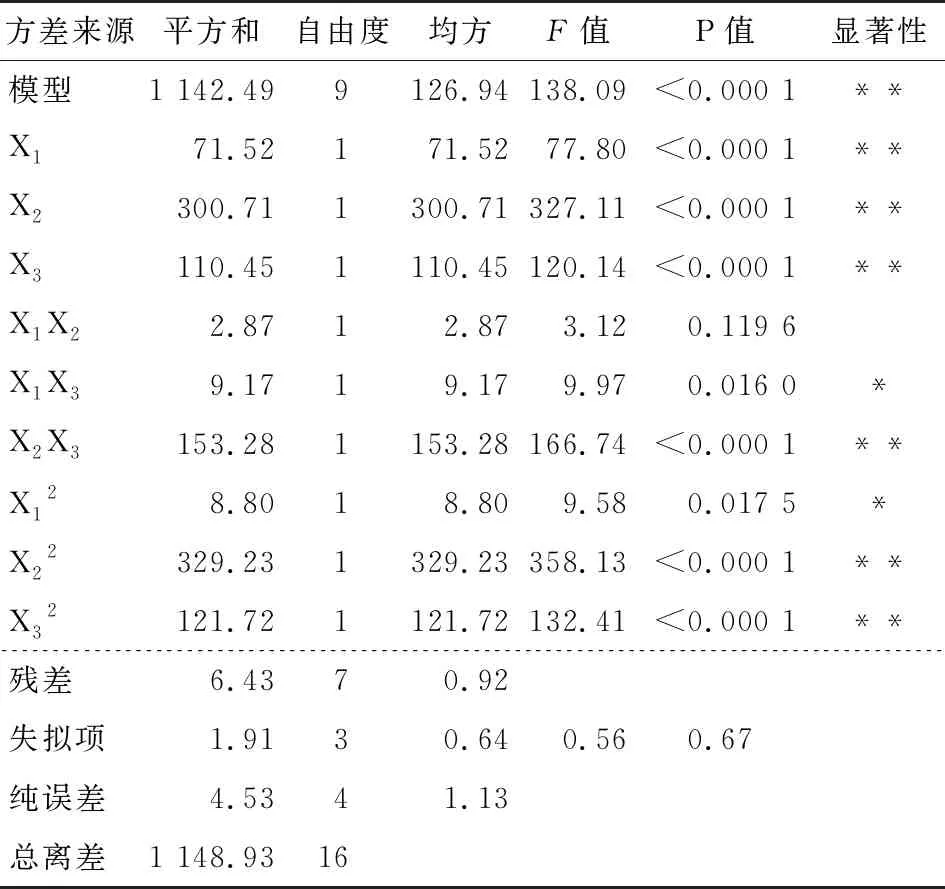
表3 二次模型的方差分析†
2.2.3 交互作用分析与验证 由图5可知,料液比与pH之间对凝集活性的影响不显著、料液比与浸提时间之间对凝集活性的影响显著、pH与浸提时间之间对凝集活性的影响极显著,说明各因素间的交互作用极显著,与方差分析结果一致。该模型得到的凝集素最佳提取工艺参数为料液比1∶22.96 (g/mL),pH 7.76,浸提时间13.77 h,该条件下凝集活性预测值为38.08 HU。结合实际,将各因素修正为料液比1∶23 (g/mL),pH 7.8,浸提时间14 h,实测凝集活性为(37.18±0.18) HU (n=3),与预测值接近,表明优化的工艺条件可靠,方程拟合良好,具有实际应用价值。

图5 各因素交互作用响应面曲面图
2.3 硫酸铵分级沉淀
由表4可知,当混合液中硫酸铵饱和度提高到45%时,开始出现凝集活性(0.06 HU),且随混合液中硫酸铵饱和度的增加出现两个凝集活性增加区间(45%~65%和70%~85%),直至混合液中硫酸铵饱和度为85%时达到最大(178.32 HU);当混合液中硫酸铵饱和度由65%增加至70%时,凝集活性下降(17.44 HU),说明在此分级区间内有更多杂蛋白被沉淀出来;为保证凝集素含量并减少试剂用量,选择赤小豆凝集素的硫酸铵分级沉淀范围为45%~80%。
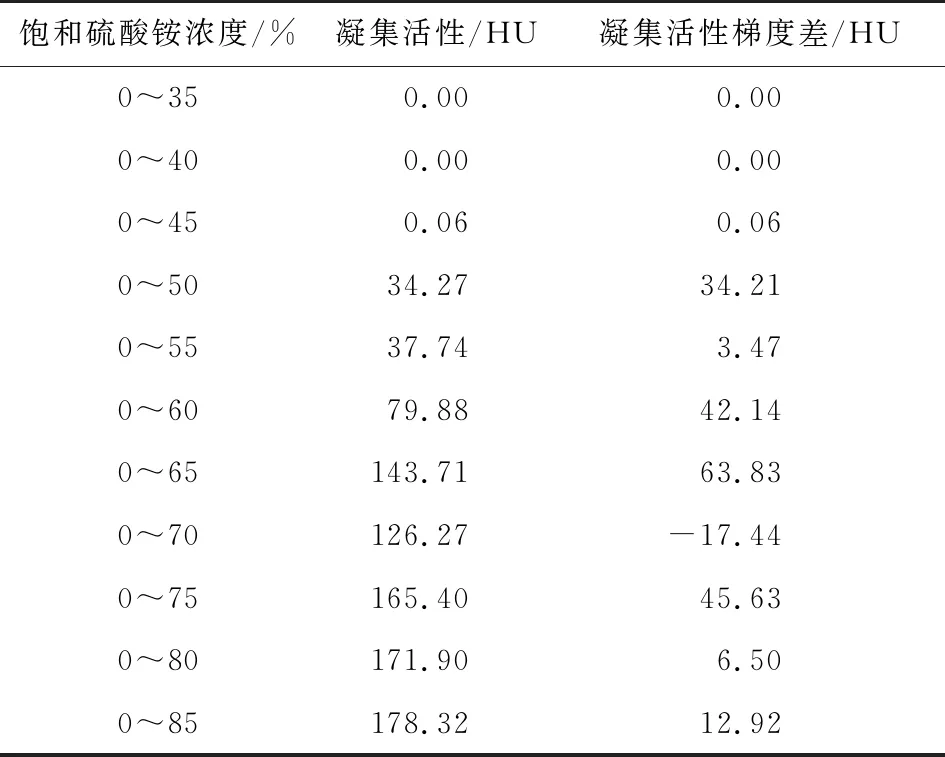
表4 硫酸铵分级沉淀结果
2.4 离子交换色谱
由图6可知,相比于DEAE填料,Q Sepharose XL填料具有更好的分离效果。经Q Sepharose XL层析分离出具有凝集活性的组分F1和F2,其中组分F2的凝集活性更高,而F3未观察到凝集现象。因此,收集组分F1和F2的峰部分,富集后用于疏水层析色谱进一步分析。

图6 离子交换色谱
2.5 疏水层析色谱
由图7可知,经疏水层析梯度洗脱分离出了两个具有凝集活性的组分F4和F5,其峰型变化趋势与凝集活性变化趋势相同,说明组分F4与F5中可能存在两种具有不同疏水性质的凝集素。凝集素种类的多样性可能是表4 中出现两个凝集活性增加区间的原因。对比SDS-PAGE电泳,组分F5中的蛋白组成更为复杂,因此重复提取并富集组分F4中的第15管用于进一步分析。
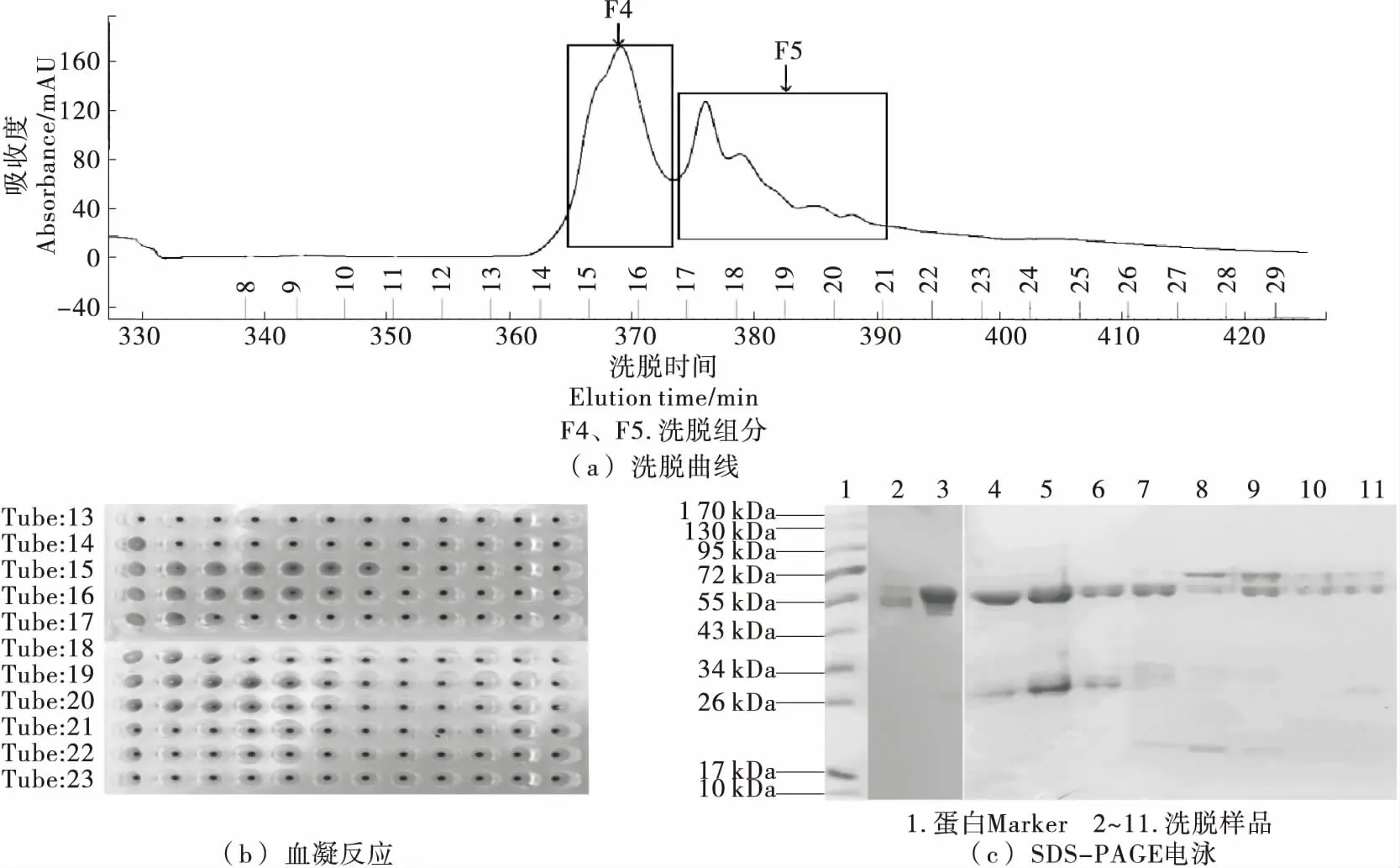
图7 疏水层析色谱
2.6 凝胶过滤色谱
由图8可知,经凝胶过滤色谱分离出了具有高凝集活性(127 HU)的组分F6。目标蛋白在SDS-PAGE电泳中显示2条电泳条带,分子量在55 kDa和27 kDa附近,与Pradip等[25]的研究结果相似。SDS-PAGE电泳中,十二烷基硫酸钠通过断裂凝集素与其他分子间的非共价键使蛋白分子去折叠,强还原剂(巯基乙醇)能通过断裂半胱氨酸残基间的二硫键(S—S)使凝集素分子解聚成多肽链[26]。因此,凝胶过滤色谱的单一峰型表明目标蛋白纯化水平较高,并且在溶液中以稳定的多聚体形式存在[27];结合SDS-PAGE凝胶电泳和凝集活性可以说明,纯化的蛋白是单体蛋白,在具有强还原剂条件下,蛋白中的二硫键断裂解聚为两条亚基并且该亚基具有凝集活性。纯化结果表明,赤小豆凝集素的两条亚基分子量为55 kDa和27 kDa左右。
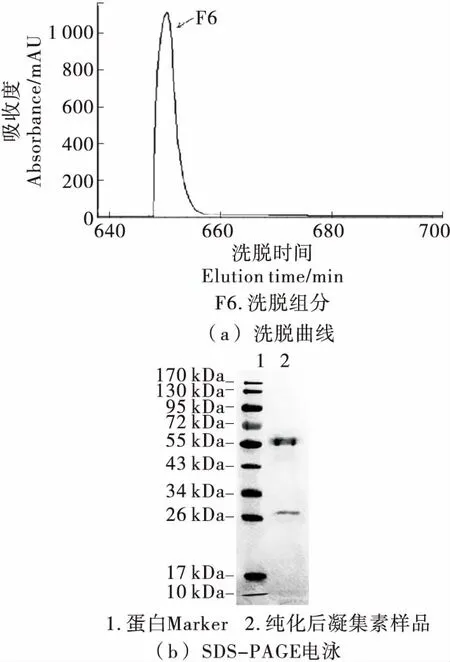
图8 凝胶过滤层析色谱
3 结论
以赤小豆为原料提取凝集素,利用单因素结合响应面试验得到赤小豆凝集素的最优粗提条件为:以PBS磷酸盐缓冲液为浸提剂,料液比1∶23 (g/mL),pH 7.8,浸提时间14 h;粗提物经65%~80%饱和硫酸铵分级沉淀、Q Sepharose XL阴离子交换层析、phenyl FF HP疏水层析、Sephadex G-50凝胶过滤层析后获得赤小豆凝集素。其中,Q Sepharose XL阴离子层析填料比DEAE阴离子层析填料更适合赤小豆凝集素的初步分离;聚丙烯酰胺凝胶电泳表明,赤小豆凝集素的两条亚基分子量分别在55 kDa和27 kDa附近。后续还需从以下几个方面开展研究:① 通过液相色谱—串联质谱方法对赤小豆凝集素进行蛋白质鉴定;② 探究赤小豆凝集素基础理化特性,如金属离子特异性、细胞凝集特异性和糖特异性等。

