野生猕猴桃杂交后代雄性优株花粉质量鉴定
张琛,郗笃隽,刘辉,黄康康,裴嘉博,骆慧枫
(杭州市农业科学研究院园艺研究所,浙江杭州 310024)
猕猴桃是雌雄异株果树,在生产中需配置适宜的授粉树。花粉直感效应是指授粉后花粉对其受精所形成的果实或种子产生的影响[1]。研究表明,雄株的倍性[2-4]、授粉方式等[5,6]对果实坐果率、大小、果皮与果肉颜色、产量等多方面均表现出不同程度的影响,因此优良适配雄株的选择具有重要意义。目前国内外对猕猴桃的研究大多集中于雌株品种的选育,对雄株的选育研究较少。新西兰20世纪50年代选育出海沃德等5个雌性品种适配的雄性品种[7],中国科学院武汉植物园选育出磨山4号等雄性品种[8]。
目前生产上所用的雄株品种单一,常采用一种雄株点授所有品种的雌株,花粉直感效应对雌性品种的影响被忽略,出现果实品质不高、减产等现象。笔者前期从野生猕猴桃资源中初步选出花期合适、花径较大的雄株8株,本研究对其花粉量、花粉活力、花粉萌发率等指标进行了测定,为选出适配性高、性状优良的雄株奠定资源基础。
1 材料与方法
1.1 试验材料
2015年,采集浙江省杭州地区野生猕猴桃果实,将其种子播种,获得野生猕猴桃实生后代雄株若干份,栽植于杭州市农业科学研究院基地,现已达开花树龄。根据雄株的花期、花径、雄蕊数等参数初步选出8株雄株优株,分别编号为Y7、Y18、Y30、Y35、Y37、Y43、Y55、Y58。
1.2 试验方法
花期采集各雄株的铃铛花,用镊子剥取花药于硫酸纸上,阴干后装入玻璃小瓶中,于4℃条件贮存待测。
花粉量测定,参照沈根华等[9]方法并略有改动,取饱满且未开裂花药50粒于离心管中,置于25℃环境中直至花粉完全散出。加入200g/L六偏磷酸钠溶液2mL,用漩涡振荡器制成悬浮液。取悬浮液400μL,加入200g/L六偏磷酸钠溶液1.6mL,摇匀定容于2mL离心管中。取5μL于载玻片上,倒置生物显微镜下观察,统计花粉粒数。重复3次。每枚花药的花粉量(花粉粒/花药)= 每个载玻片上总花粉粒数×40。
花粉活力测定,采用TTC法并稍加改进,取少量花粉混匀于0.5%TTC 500μL溶液中,置于35℃恒温箱中(避光),染色(染成红色为有活力)24小时,吸取少量在显微镜下观察。统计3个视野。花粉活力(%)=着色花粉数/观察花粉数×100。
花粉萌发率测定,参照姜雪婷等[10]方法并有所改动,使用离心管培养法。培养液成分为蒸馏水+20%蔗糖+0.1%硼酸,pH=6.5。将适量花粉混入培养液中振荡,25℃培养12小时。光学显微镜下观察并统计花粉萌发情况。萌发标准为花粉管长度大于花粉粒直径。每个雄株重复3次。萌发率(%)=已萌发花粉数/花粉总数×100。
1.3 数据处理
采用Excel和DPS14.5软件对数据进行统计分析,用单因素方差分析和LSD法检测不同处理间的差异显著性。
2 结果与分析
8个野生猕猴桃雄株优株中,Y35的花粉量最大,单个花药所含花粉量6200粒,显著高于其他雄株花粉量。Y7、Y18、Y30、Y43的花粉量均在2000粒以上,差异不显著。Y37、Y55、Y58的单个花药所含花粉量低于2000粒,其中Y37最少,为1746.67粒(表1)。
花粉活力,Y7的最高,达94.60%,显著高于其他7株(图1)。Y18、Y58、Y35(图2)、Y43、Y55、Y37、Y30的活力依次递减,均未超过25%,Y30花粉活力最低,仅为2.22%(表1)。
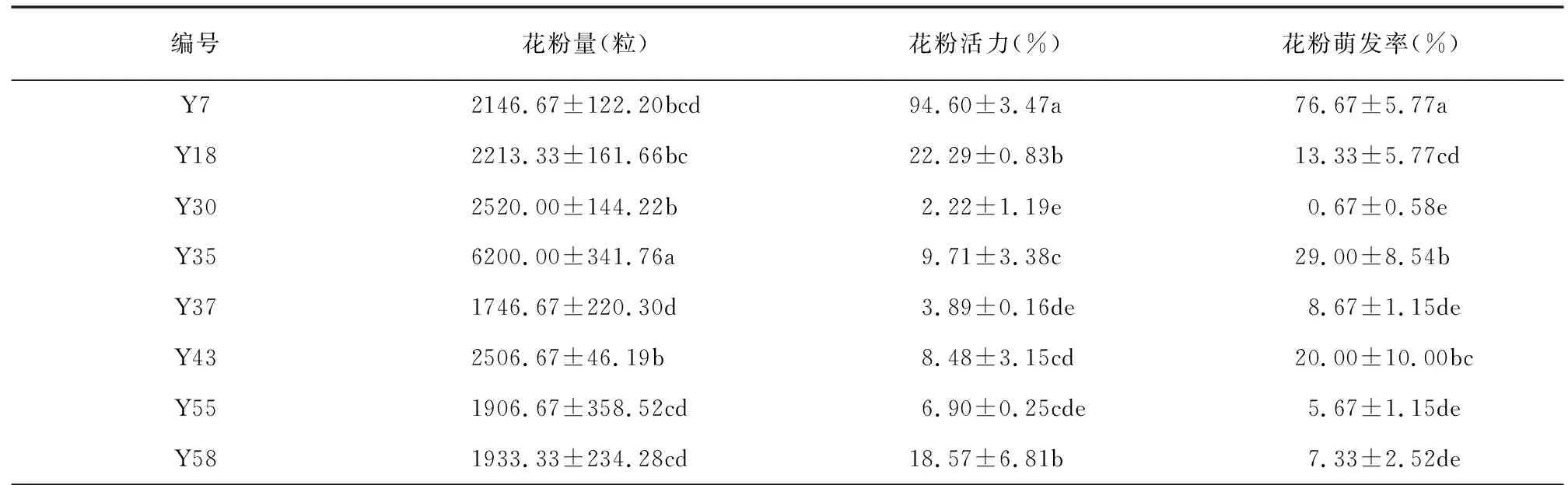
表1 几种野生猕猴桃雄株花粉质量测定
花粉萌发率,Y7的最高,为76.67%,显著高于其余7株(图3)。Y35的次之,为29%,其余雄株的较低,均未超过20%(图4)。Y30花粉萌发率最低,仅为0.67%(表1)。8株雄株优株中,以Y7的花粉活力与萌发率高。
3 小结与讨论
猕猴桃生产上对雄株的选择大多仅参照与雌株品种花期的适配程度。近年来,因气候等不确定因素常常发生花期不遇现象,人工授粉是补足授粉的常见方法。在人工授粉过程中,由雄株花粉质量所引起的花粉直感效应所带来的问题表现日益突出。研究表明,雄株品种的选择对果实产量、质量有一定的影响,花粉量与产量之间存在显著的相关性[11]。近年来,雄株的育种工作被关注与重视。国内对雄性品种的选育标准集中体现在花期适配程度、花径和花粉量大小、花粉萌发率、花粉亲和力等方面。
本试验对前期从野生猕猴桃资源中初步选出的部分与红阳猕猴桃花期合适、花径较大的雄性优株8株进行花粉指标测定表明,Y35雄株的花粉量大但花粉活力与萌发率较低。其他雄株花粉量一般,且花粉萌发率低。在实际生产过程中,花粉萌发率低于30%的品种一般不作为授粉品种[9]。Y7雄株的花粉量适中且花粉活力与萌发率较高,值得关注。下一步可对其花粉亲和力、授粉后结实率、果实品质等方面进行研究,以筛选出性状优良、可实际投入生产应用的雄株品种。

