芍药醇对结肠炎小鼠Foxp3表达的影响及其机制研究
柯乐斌 高仁贤 周垂杨
溃疡性结肠炎(ulcerative colitis,UC) 是一种慢性非特异性的肠道炎症,属于炎症性肠病(inflammatory bowel disease,IBD) 的一种,病变以结肠黏膜层的溃疡为主,溃疡严重者可侵及全结肠,其病程长且难以治愈,发生率逐年上升,本疾病的发病机制尚未完全明确,目前大量研究表明其发病与免疫调节平衡和肠道免疫密切相关[1~3]。Treg 细胞来源于CD4+Treg,由Foxp3诱导产生,能下调自身免疫应答来诱导自身免疫耐受和抑制自身免疫疾病的发生,有预防、减弱或终止各种炎性反应促使慢性炎症愈合的功能; 在抑制免疫反应、介导免疫耐受等过程中起着重要的作用[4, 5]。近年来研究表明,Th17/Treg 转化平衡是维持肠道免疫稳态的重要因素,Th17/Treg的失衡与UC关系密切[6]。恢复调整体内Th17/Treg的平衡在IBD动物模型和临床疗效中都不断地得到验证[7,8]。因此,以Th17和Treg细胞相互转化为靶点,研究具有抑制炎症作用的化合物将为溃疡性结肠炎的治疗提供新的思路。
芍药醇是从传统中草药例如牡丹皮、白芍根和野山药中提取的一种有效成分,广泛参与免疫调节,抗炎、抗肿瘤和抗氧化等生理过程。研究表明在肝细胞癌大鼠模型中,芍药醇能有效提高肝抗氧化酶的生成和免疫调节因子表达[9]。另有研究显示在卵清蛋白诱导的哮喘小鼠模型中,芍药醇抑制TLR4/NF-κB和MAPK信号通路缓解哮喘引起的炎性细胞浸润和胶原沉积[10]。芍药醇被证明可以通过靶向调节T-LAK细胞起源的蛋白激酶来抑制日光紫外线诱导的皮肤炎症[11]。本研究诱导小鼠溃疡性结肠炎模型,观察芍药醇对于模型小鼠的保护作用,并探究其内在机制,为芍药醇在溃疡性结肠炎中的治疗可行性提供科学依据。
材料与方法
1.实验动物与试剂:30只健康雄性BALB/c小鼠[SPF级,浙江中医药大学动物实验中心,实验动物许可证号为SYXK(浙)2010-0012],体质量为20±2g,由浙江中医药大学动物实验中心在SPF条件下饲养繁殖,动物饲养及实验操作严格遵守实验动物的使用和管理原则。葡聚糖硫酸钠(DSS)(美国MP Biomedicals公司,批号160110),芍药醇(中国成都瑞芬思生物科技有限公司,批号:552-41-0,规格:20mg),Foxp3(英国Abcam公司,ab215206),RORγt(美国Santa Cruz公司,sc-293150),细胞因子ELISA检测试剂盒IL-17(美国R&D Systems公司,DY421-05),IL-6(美国R&D Systems公司,SM6000B),IL-10(美国R&D Systems公司,DY417-05),TGF-β(美国R&D Systems公司,7666-MB-005),流式荧光抗体染料:PE-Hamster Anti-Mouse-CD3(货号:14-0031-82)、PE-Hamster Anti-Mouse CD25(货号:12-0251-82)、FITC Rat Anti-Mouse CD4(货号:11-0041-82)、APC Rat Antimouse IL-17A(货号:17-7177-81)、APC Rat Anti-Mouse Foxp3(货号:17-5773-82)均购自美国eBioscience公司。
2.动物分组及UC模型小鼠制备:30只健康雄性BALB/c小鼠按照数字表法随机分成空白对照组、UC模型组、芍药醇治疗组3组,每组小鼠均为10只。使用自由饮用2% DSS水溶液建立UC小鼠模型,除空白对照组外其余两组均用2% DSS水溶液代替(DSS水溶液每天新鲜配置),造模周期14天。芍药醇治疗组:造模1周后,治疗组小鼠每天给予灌胃2ml芍药醇;UC模型组:造模1周后,每天灌胃2ml蒸馏水。造模期间每天观察小鼠饮食、毛发、一般活动状态等,出现稀便、腹泻、大便隐血或肉眼血便的任1个症状即判定为模型建立成功。
3.疾病活动指数(DAI)评分:芍药醇灌胃治疗开始后,每天称小鼠体质量,并取各小鼠粪便,观察大便性状,粪便隐血试剂盒(邻甲苯胺法)测定大便隐血分数,评估疾病活动指数(DAI),DAI=(体质量下降分数+大便性状分数+大便隐血分数)/3,详见表1。

表1 疾病活动指数DAI评分
4.ELISA检测外周血清相关因子含量:小鼠在芍药醇治疗结束后,用3%戊巴比妥钠腹腔注射麻醉,抽取小鼠外周静脉血,室温静置3h后放入4℃预冷的离心机中离心3000r/min,30min,调整为soft模式,收集上层血清。按照ELISA检测试剂盒说明书检测血清中IL-17、IL-6、IL-10和TGF-β的含量。
5.流式细胞仪检测外周血Treg/Th17细胞比例:采集小鼠外周血置于两个肝素钠真空抗凝管中,加入CD3/CD4/CD25抗体各10μl,室温避光孵育20min;400×g离心5min,去上清,清洗;加入IC Fixation buffer 100μl,混匀,避光孵育40min,加入Permeabilization buffer 2000μl,400×g离心5min,去上清;加IL-17A抗体5μl,混匀,室温避光孵育4min;加300μl的PBS,涡旋,避光存放,上机检测。Treg细胞检测方法相同,采用CD3/CD4/CD25/Foxp3抗体标记。
6.小鼠结肠组织损伤指数(CMDI)评分:小鼠采血后立即处死,剪取距肛门约8cm的肠道,用4%多聚甲醛固定结肠标本,放大镜下观察小鼠鼠结肠黏膜的损伤程度,评估小鼠结肠组织损伤指数(CMDI),详见表2。

表2 结肠组织损伤指数(CMDI)评分标准
7.小鼠结肠病理组织学指数(CHPI)评分:小鼠新鲜结肠组织PBS冲洗后于4%甲醛溶液中固定24h以上,脱水、包埋并制成2μm切片,每只小鼠随机选取3张切片。按照HE染色的流程进行处理。制好的小鼠结肠HE切片与显微镜下观察并按照表3的评分标准评估小鼠结肠病理学组织指数(CHPI)。

表3 结肠病理组织学指数(CHPI)评分
8.小鼠结肠Foxp3、RORγt mRNA水平检测:取小鼠结肠组织,液氮研磨成粉末,Trizol法提取组织总RNA,用反转录试剂盒反转为cDNA,以cDNA为模板加入合成的引物进行real-time PCR检测。两步法PCR反应条件:预变性,95℃ 30s,PCR反应,95℃ 5s,95℃ 30s,60℃ 30s,40个循环;解离,95℃ 15s,60℃ 1min,95℃ 15s。引物信息:RORγt:上游引物:5′-GCCTACAATGCCAACAACCA-3′,下游引物:5′-GGACGGTTGGCATTGATGAG-3′;Foxp3:上游引物:5′-ACTCGCATGTTCGCCTACTT-3′,下游引物:5′-AGGGATTGGAGCACTTGTTG-3′;内参GAPDH:上游引物:5′-ATGGGTGTGAACCACGAGA-3′,下游引物:5′-CAGGGATGATGTTCTGGGCA-3′。记录每次测定的Ct值,取3个副孔的平均值,以GAPDH为内参照,得出的数据用2-△△Ct进行分析。
9.小鼠结肠Foxp3、RORγt 蛋白水平检测:提取小鼠结肠组织蛋白,BCA法进行蛋白定量,蛋白变性,进行聚丙烯酰胺凝胶电泳(SDS-PAGE),聚偏二氟乙烯膜(PVDF)蛋白转膜,5%脱脂牛奶常温封闭1h,一抗浓度Foxp3(1∶1000)、RORγt(1∶1000)、β-actin (1∶10000)用牛奶稀释,4℃孵育过夜,洗膜液洗3次,每次10min,二抗浓度(1∶10000)孵育1.5h,洗膜液洗3次,每次10min,化学发光法(ECL)显影,凝胶成像系统检测Foxp3和RORγt蛋白表达,以β-actin为内参。

结 果
1.各组小鼠症状及结肠组织学改变比较:与空白对照组比较,UC模型组小鼠出现精神差,活动量少,进食、饮水量减少,体重减轻等症状,同时出现稀便甚至水样便和肉眼血便,DAI评分显著升高(P<0.05)。与模型组比较,芍药醇治疗组小鼠症状得到缓解,精神趋于正常,进食和活动恢复,粪便正常,未见脓血便,DAI评分明显降低(P<0.05)。与空白对照组比较,UC模型组小鼠结肠组织上有多处溃疡,并且面积>1cm2,DSS诱导溃疡性结肠炎模型成功。芍药醇治疗组小鼠结肠组织溃疡有所缓解,光镜下未发现明显的炎症。小鼠结肠HE染色结果显示,空白对照组小鼠结肠组织结构完整,腺体明显,未见萎缩、坏死、变性及炎性细胞浸润等现象。与空白对照组比较,UC模型组小鼠具有典型的溃疡性结肠炎病理变化。结肠组织结构破坏,出现溃疡,腺样异常,不典型增生,并伴有大量炎性细胞浸润,隐窝数量明显减少,CHPI显著增加(P<0.05)。与模型组比较,芍药醇治疗组小鼠隐窝炎症减轻,炎性细胞浸润程度轻,CHPI明显降低(P<0.05)。HE染色结果详见图1,各组小鼠DAI、CMDI、CHPI评分结果详见表4。
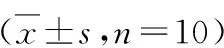
表4 各组小鼠DAI、CMDI和CHPI评分结果
2.小鼠外周血清IL-17、IL-6、IL-10、TGF-β水平:ELISA检测3组小鼠外周血清相关因子水平,检测结果显示,与空白对照组比较,UC模型组小鼠血清中IL-17和IL-6水平显著升高,IL-10和TGF-β水平明显降低,差异有统计学意义(P<0.05)。与UC模型组比较,芍药醇治疗组小鼠血清中IL-17和IL-6水平显著下降,IL-10和TGF-β水平明显回升,差异有统计学意义(P<0.05),详见表5。
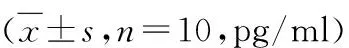
表5 各组小鼠血清IL-17、IL-6、IL-10、TGF-β水平
与空白对照组比较,*P<0.01;与UC模型组比较,#P<0.01
3.小鼠外周血Treg/Th17细胞占比结果比较:利用流式细胞仪检测不同处理组小鼠外周血中Treg/Th17细胞占比数值,与空白对照组比较,UC模型组小鼠Th17 细胞的百分比明显增加,Treg细胞的百分比相应减少,差异有统计学意义(P<0.05);与UC模型组比较,芍药醇治疗组小鼠外周血中Th17细胞的百分比相对减少,Treg细胞的百分比相应增加,差异有统计学意义(P<0.05),详见表6。
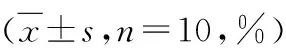
表6 小鼠外周血Th17、Treg细胞占CD4 +T 细胞百分比结果
4.小鼠结肠Foxp3、RORγt mRNA水平检测:realt-ime PCR结果显示,与空白对照组比较,UC模型组小鼠Foxp3 mRNA表达水平降低,RORγt表达增加,差异有统计学意义(P<0.05)。与UC模型组比较,芍药治疗组小鼠结肠组织Foxp3表达得到恢复,而RORγt表达降低,差异有统计学意义(P<0.05),详见表7。

表7 小鼠结肠组织Foxp3、RORγt mRNA水平检测结果
5.小鼠结肠Foxp3、RORγt 蛋白水平检测:UC模型组小鼠结肠中Foxp3蛋白表达显著降低,而RORγt蛋白表达明显增加。与UC模型组比较,芍药醇治疗组小鼠结肠中Foxp3蛋白表达有所增加,而RORγt蛋白表达下降,结果与mRNA检测结果一致,详见图2。
讨 论
Th细胞是T淋巴细胞中一个十分重要的亚群,Th细胞平衡失常与炎症的发生和发展关系密切[12, 13]。Th17和Treg细胞均来自CD4+T 细胞,在外周血或脾中循环。Th17细胞作为最重要的促炎细胞,特异性分泌白介素17(IL-17)和白介素6(IL-6)并促进炎性反应,本研究中UC模型组小鼠外周血清中IL-17和IL-6水平明显上升,说明了炎性反应的存在。而Treg 细胞作为具有独特调节作用的免疫抑制细胞,主要分泌一些细胞因子如白介素-10(IL-10)和转化生长因子-β(TGF-β),在无促炎细胞因子的情况下,TGF-β诱导CD4+T 细胞分化成Treg细胞,Treg细胞产生抗炎细胞因子IL-10 和TGF-β,抑制T细胞的活性和增殖,控制免疫应答的强度,减轻机体组织的损伤[14,15]。本研究结果显示,在UC模型组小鼠外周血清中,IL-17和IL-6等炎性因子表达水平上升,IL-10和TGF-β水平显著下降。
大量研究表明,Th17和Treg细胞失衡是导致风湿性关节炎、哮喘和IBD等多种免疫性疾病的重要原因[4, 16, 17]。通过检测小鼠外周血Th17、Treg细胞占CD4+T 细胞百分比结果,本研究中UC模型组小鼠体内存在Th17和Treg细胞失衡的现象,提示疾病发生可能与免疫细胞数量失衡相关。Foxp3是控制Treg细胞分化的特异性转录因子,CD4+CD25+Treg细胞分化过程中呈特异性高表达,可调控Treg细胞分化发育和功能,该基因突变或敲除小鼠会导致CD4+CD25+Treg细胞缺失或下降,伴有功能缺陷,诱发严重自身免疫反应[18]。研究表明表达Foxp3的Treg细胞在SCID小鼠模型中可以抵抗结肠炎的能力,同时其丧失活力也会引起小鼠炎性肠病的发生[19]。在缓解期UC患者肠黏膜固有层的Foxp3+Tregs细胞数量明显增加, 研究认为这些增加的细胞在选择性抑制效应T细胞的反应和维持肠道免疫平衡中可能起着重要作用[20]。本研究中小鼠结肠组织蛋白检测结果显示,UC模型组小鼠结肠内Foxp3蛋白明显下降,而在芍药醇治疗组小鼠结肠组织内Foxp3蛋白表达则有所回升,这与既往研究结果相符合,Foxp3蛋白增加可以缓解溃疡性结肠炎。
综上所述,本研究着重探讨了芍药醇在溃疡性结肠炎小鼠的作用及其内在机制。研究结果证实了芍药醇可以促进溃疡性结肠炎小鼠结肠组织中Foxp3表达,诱导Treg细胞分化生成,降低RORγt表达,抑制Th17细胞分化,调节Th17/Treg细胞平衡,维持体内免疫平衡,同时降低IL-17、IL-6炎性相关因子的表达,减轻肠道炎性反应,从而起到缓解和治疗溃疡性结肠炎的作用,为今后的临床应用提供了科学依据。本研究也发现Foxp3的表达在IBD进展过程中可以调控免疫细胞的分化和数量平衡,围绕Foxp3在炎性肠病分子生物学机制研究的深入,对于IBD的发病机制和诊治策略将提供新的认识。

