CT‐电子密度转换曲线误差对IMRT剂量计算结果的影响
朱凤盈,马彦凝,罗锦胜,潘宏威,王远远,蓝茂英
1.南方医科大学顺德医院放射治疗科,广东佛山528300;2.瓦里安医疗系统公司,北京100176;3.合肥离子医学中心医疗部,安徽合肥230000
前言
治疗计划系统(Treatment Planning System,TPS)进行剂量计算依赖于CT影像中所包含的相对电子密度信息,该密度信息利用CT值转换得到,这一转换通常视所使用的CT而定[1]。TPS剂量计算时,错误的CT/电子密度(CT‐ED)关系会造成剂量计算错误。CT值的大小受CT扫描参数如管电压、管电流、层厚等以及扫描条件的影响,导致对应物质的相对电子密度误差[2]。本研究主要分析CT‐ED转换曲线误差对宫颈癌患者调强放射治疗(IMRT)计划剂量造成的影响,建立正确的CT‐ED转换曲线应该在临床工作中予以重视,以保证治疗计划剂量计算的精度。
1 材料与方法
1.1 主要设备和仪器
(1)CT 扫描机:西门子SOMATOM Definition AS 20 层螺旋大孔径CT,CT 床附加碳素纤维平板床面;(2)模体:CIRS062 电子密度模体;(3)TPS:瓦里安Eclipse 治疗计划系统;(4)直线加速器:瓦里安Trilogy直线加速器,MLC 60对,中间40对叶片,每片宽度5 mm,两端各10对叶片,宽度1 cm。
1.2 病例选择
随机选取2018年11月~2019年1月在南方医科大学顺德医院放射治疗科进行IMRT 治疗的宫颈癌患者10例进行回顾性研究。年龄38~75 岁,平均年龄61 岁,中位年龄61 岁。计划选择腹部CT‐ED 转换曲线完成,扫描电压120 kⅤ,电流35 mA,层厚3 mm。
1.3 IMRT计划设计及CT‐ED转换曲线引入
处方剂量5 040 cGy,分28次完成照射。采用前3后2或前2后3布野,射野避开对肾脏、直肠等危及器官的照射。在TPS对转换曲线引入±0.5%、±1.0%、±1.5%、±2.0%和±3.0%的误差,重新计算剂量分布。每例患者得到10个新计划,与原计划进行剂量学比较。
1.4 评价指标
分别评价原计划和新计划靶区及危及器官的剂量体积参数,评价指标包括:处方剂量包绕靶区体积(ⅤRx)、最大剂量(D2%)、最小剂量(D98%)、适形度指数(Conformity Index, CI)和均匀性指数(HomogeneityIndex,HI);危及器官包括脊髓的最大剂量(D1cc)、小肠的最大剂量(D1cc)、膀胱和直肠的体积剂量(Ⅴ45Gy),以及股骨头的体积剂量(Ⅴ30Gy)[3]。
1.5 统计学方法
从10例宫颈癌患者IMRT 计划中分别得出靶区ⅤRx、D2%、D98%与转换曲线误差的散点图;危及器官脊髓、小肠最大剂量D1cc与转换曲线误差的散点图;膀胱和直肠的体积剂量Ⅴ45Gy与转换曲线误差的散点图;股骨头的体积剂量Ⅴ30Gy与转换曲线误差的散点图。通过Matlab 软件对上述数据进行拟合,采用线性拟合、多项式拟合等方法,拟合出靶区及危及器官剂量参数偏差值(Δ)与转换曲线误差之间的相关公式。采用SPSS 21.0 统计软件进行统计学分析,计量资料用均数±标准差表示,相关性进行Spearman 分析,P<0.05为差异有统计学意义。
2 结果
2.1 转换曲线误差对靶区剂量参数的影响
如表1所示,当转换曲线误差为正数时,即CT‐ED转换曲线数值增大,ⅤRx降低,当出现1.5%偏差时,计划靶区(PTⅤ)的ⅤRx为94.73%±1.86%,误差继续增大,带来的影响超出临床可接受范围。当转换曲线误差为负数时,ⅤRx升高,引入误差越大,ⅤRx值越大。如图1所示,Matlab 拟合得到转换曲线误差与ΔⅤRx之间的相关公式如下所示:
表1 转换曲线误差对处方剂量包绕靶区体积的影响(±s,%)Tab.1 Effect of conversion curve errors on target coverage(Mean±SD,%)
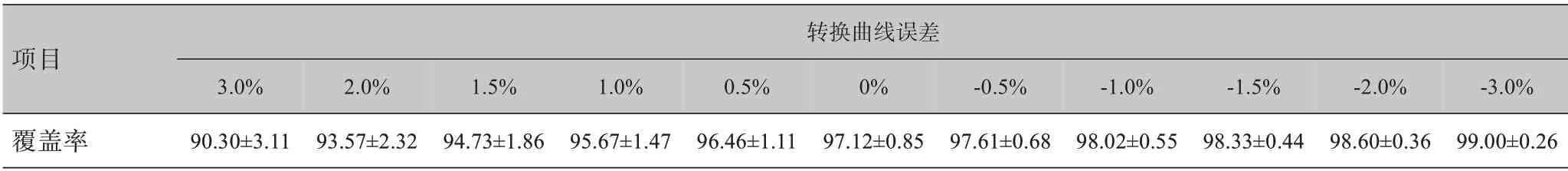
表1 转换曲线误差对处方剂量包绕靶区体积的影响(±s,%)Tab.1 Effect of conversion curve errors on target coverage(Mean±SD,%)
项目覆盖率转换曲线误差3.0%90.30±3.11 2.0%93.57±2.32 1.5%94.73±1.86 1.0%95.67±1.47 0.5%96.46±1.11 0%97.12±0.85‐0.5%97.61±0.68‐1.0%98.02±0.55‐1.5%98.33±0.44‐2.0%98.60±0.36‐3.0%99.00±0.26
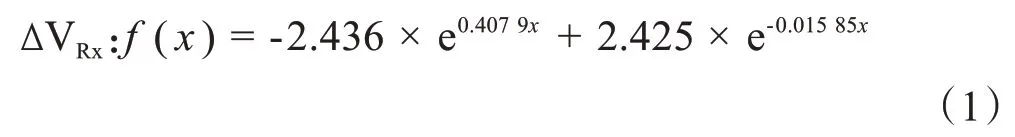
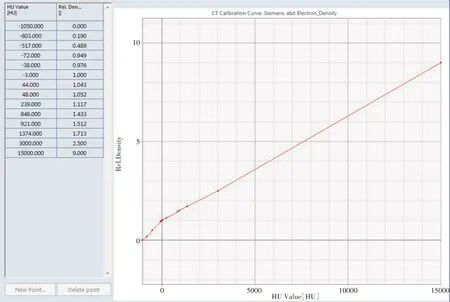
图1 腹部CT-ED转换曲线Fig.1 Abdominal CT-ED conversion curve
对于D2%、D98%,引入正转换曲线误差,数值降低,引入负转换曲线误差,数值升高,引入的转换曲线误差越大,D2%、D98%数值变化越大。如表2所示,ΔD2%、ΔD98%与转换曲线误差之间存在显著负相关性。如图2b和图2c所示,用Matlab得到转换曲线误差与ΔD2%、ΔD98%之间的相关公式:
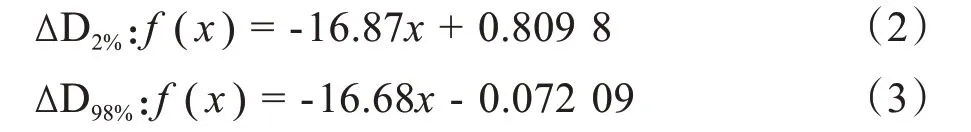
CI、HI随转换曲线误差变化没有表现出明显规律,两者之间没有显著的相关性,如表2所示。图2a~图2i 为10例患者IMRT 计划靶区及危及器官剂量参数偏差值与转换曲线误差之间的散点图。
2.2 转换曲线误差对危及器官剂量参数的影响
脊髓‐D1cc、小肠‐D1cc、膀胱‐Ⅴ45Gy、直肠‐Ⅴ45Gy和股骨头‐Ⅴ30Gy,在引入正转换曲线误差时,数值降低,引入负转换曲线误差时,数值升高,引入的转换曲线误差越大,危及器官数值变化越大。如表2所示,危及器官剂量参数偏差值与转换曲线误差之间存在显著负相关性。图2a~图2i 为用Matlab 拟合得到的转换曲线误差与危及器官剂量参数偏差值之间的相关公式:
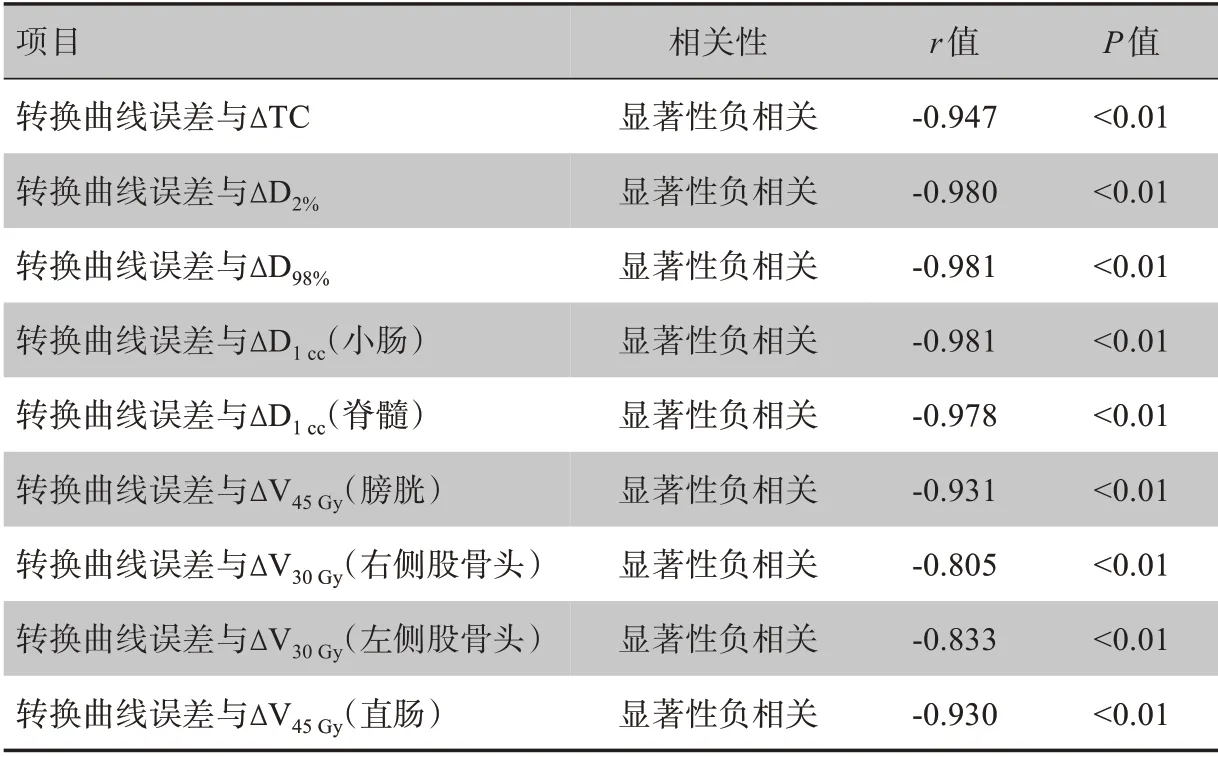
表2 靶区及危及器官剂量参数偏差值与转换曲线误差之间的Spearman法相关分析Tab.2 Spearman correlation analysis between the conversion curve errors and the deviation values of dosimetric parameters of target areas and organs-at-risk
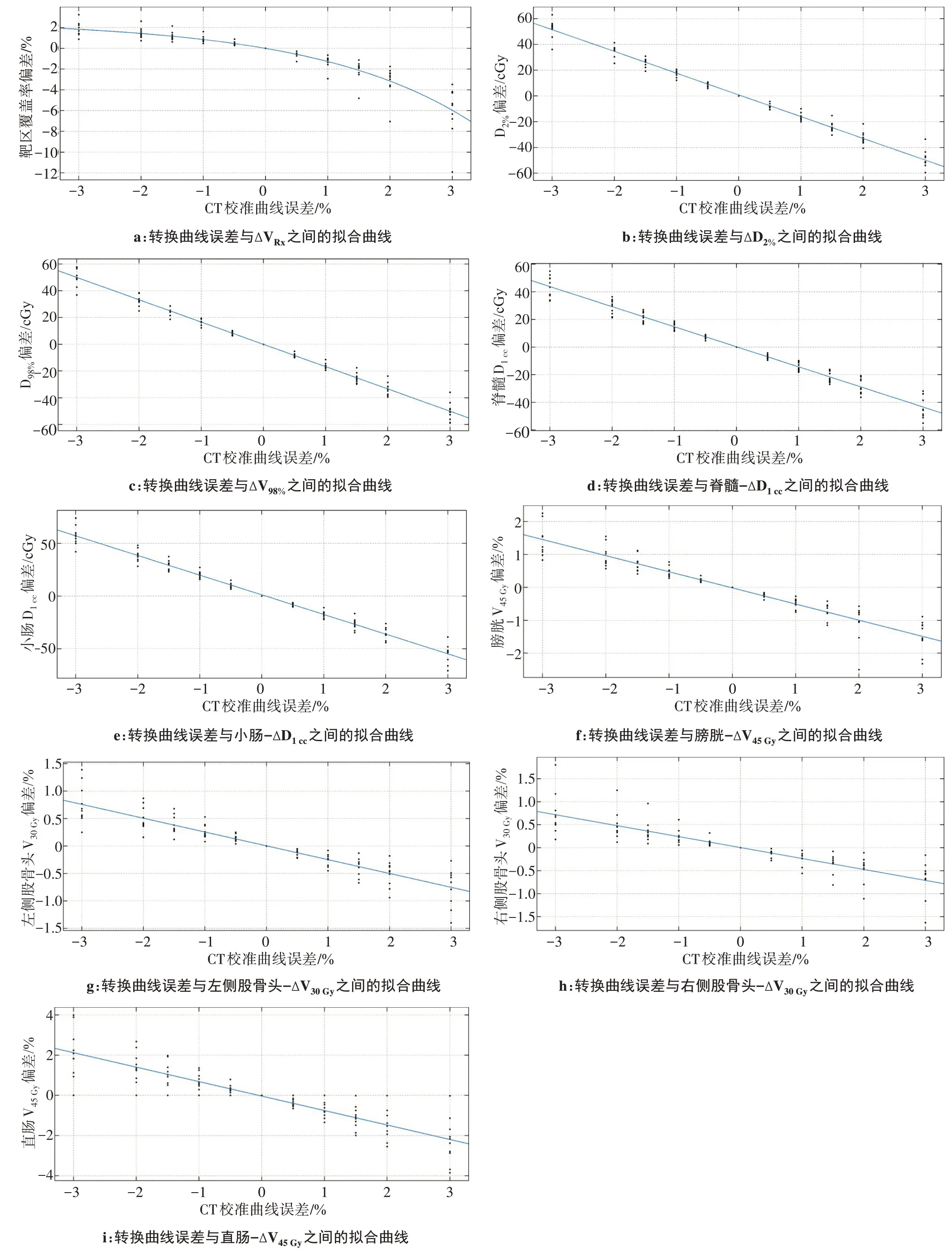
图2 10例患者IMRT计划靶区及危及器官剂量参数偏差值与转换曲线误差之间的散点图Fig.2 Scatter plots between the conversion curve errors and the deviation values of dosimetric parameters of target areas and organs-at-risk in IMRT plans of 10 patients

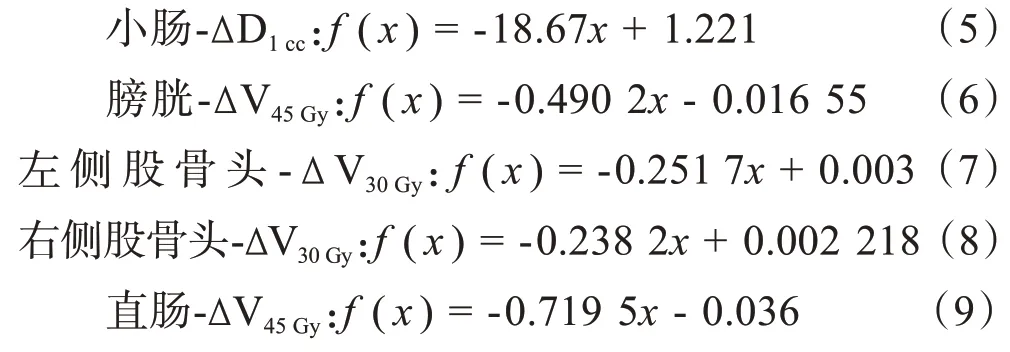
3 讨论
为了确保放疗剂量的精确计算,需要保证计划系统CT‐ED 转换曲线的准确性。目前,有不少文献[4‐12]对CT 值和ED 的关系进行了相应的研究。Zurl 等[4]研究表明使用不同的CT 扫描协议可以导致HU 值高达20%的变化,导致系统平均剂量误差达到1.5%。李克等[13]研究了基于不同扫描部位采集的CT‐ED转换曲线对放疗剂量的影响,结果表明在不同扫描部位下进行采集的CT‐ED 转换曲线对放疗剂量计算有一定影响,对于头部与胸部的肿瘤应该尽量选择对应扫描模式下的CT‐ED 转换曲线进行剂量计算,以保证治疗计划剂量计算的精度。
有研究表明CT 定位条件和扫描参数可能导致CT值的改变,特别是扫描电压和CT定位床面的散射对CT 值的影响较大[14]。此外,CT 增强造影剂也会影响CT值从而影响剂量的计算,并且其浓度越高CT值则增加越多,导致剂量也会增高[15‐16]。若体内有金属植入物,也会导致CT 值产生较大的偏差,这种偏差包含金属植入物本身的CT 值偏差以及金属导致的周围组织的CT 值的偏差[17‐18]。除此,若患者体内存在工人关节、心脏起搏器等外部植入物也可能导致CT值的变化,从而引起剂量计算的偏差。
由于客观因素,CT‐ED转换曲线的误差无法完全避免。TPS剂量计算时,错误的CT‐ED关系会造成剂量计算错误。研究表明,CT‐ED转换曲线的误差有可能导致剂量计算结果相差3%以上[8,19]。本研究侧重于分析CT‐ED 转换曲线误差对宫颈癌患者IMRT 计划剂量造成的影响,拟合出靶区及危及器官剂量参数偏差值(Δ)与转换曲线误差之间的相关公式,以直观显示转换曲线误差对临床评价指标带来的影响。转换曲线引入正误差时计划剂量参数降低,引入负误差时计划剂量参数升高,引入的误差越大剂量变化越大。PTⅤ的ⅤRx与转换曲线误差显著性负相关,当出现1.5%偏差时,为94.73%±1.86%,误差继续增大,带来的影响超出临床可接受范围。
为确保CT‐ED 转换曲线的准确性,需要对CT 进行定期质控。对此,AAPM TG 66号报告[20]详细描述了CT 模拟机的质控规范,包括CT 值精确性、电子密度和CT 值的转换等均有相应检查频率和容差限值。不同厂家的CT 模拟机性能参数都不完全一样,各个放疗中心应该根据自己设备的情况建立CT‐ED 转换曲线,并且考察可能影响CT 密度值的因素,完善CT模拟机的QA标准。
总之,CT‐ED 转换曲线误差越大,导致剂量计算的误差也越大。在当今精确放疗的时代,需要定期对CT 做相应的质控,保证CT‐ED 转换曲线的准确性,以保证放疗计划剂量计算的精度。

