环境对蜂房哈夫尼亚菌群体感应基因haII/haIR表达的影响
赫彬彬 李婷婷 梅永超 王当丰 孙晓佳 刘 楠 励建荣*
(1 渤海大学食品科学与工程学院 辽宁省食品安全重点实验室 辽宁锦州121013 2 生物技术与资源利用教育部重点实验室(大连民族大学) 辽宁大连116600)
微生物是导致水产品腐败变质的主要原因之一,其生长代谢过程中能够分泌胞外酶、嗜铁素、有色物质以及形成生物被膜等致腐因子[1]。研究表明,微生物主要通过群体感应系统(Quorum sensing,QS)调控致腐因子的产生,进而发挥其致腐能力[2]。该系统通过产生并释放一种被称为自体诱导物的小分子(Autoinducer,AI),使微生物能够感知外界生存环境的变化,并通过启动特定基因的表达对环境变化进行反馈,从而维持自身生长[3-4]。微生物腐败特性的表达不仅受到QS 系统的调控,也受pH 和营养状态等外界环境因素的影响。如产生志贺毒素的大肠杆菌(Escherichia coli) 在pH 3.8 时无法存活,pH 4.1 时可降低志贺毒素产量。可通过调节环境因素来抑制大肠杆菌毒力因子的表达[5]。
由于微生物适应环境的能力不同,所以食物腐败的速度和程度也随着贮藏条件的改变而发生变化[6]。蜂房哈夫尼亚菌(Hafnia alvei)是兼性厌氧型革兰氏阴性杆菌,也是肉类和鱼类低温贮藏过程中的腐败菌,其能形成生物膜以抵抗外界不良环境的变化,进而维持自身生长[7]。本实验室前期从腐败大菱鲆中分离得到一株蜂房哈夫尼亚菌,研究发现其具有相关腐败特性,如生物被膜的形成以及分泌信号分子的能力等特性均依赖于QS系统的调控,且外源环境的改变对其生物被膜的形成有一定影响[8]。Wang 等[9]发现沙门氏菌生物膜调控基因的表达受培养基的基质成分影响,当其在实验室胰蛋白酶大豆肉汤(TSB)中生长7 d 时,其生物膜调控基因的表达量增加;而当在解冻肉汤(MTLB)中生长时,该基因表达受到抑制。由于蜂房哈夫尼亚菌在冷链运输等低温贮藏条件下仍可生长,因此,探究不同环境条件对蜂房哈夫尼亚菌群体感应基因表达的影响尤为重要。
本文以haII/R 系统为研究对象,利用转录组学技术探讨不同环境因素条件(碳源、pH、NaCl 浓度、温度) 对蜂房哈夫尼亚菌群体感应调控基因haII/haIR(NCBI GenBank:AF503776.1)表达的影响,以期明确QS 基因表达差异与各环境因素的关系,进一步研究如何抑制蜂房哈夫尼亚菌等致腐菌的致腐能力,建立靶向控制群体感应系统,为水产品保鲜新技术提供理论数据支撑。
1 材料与方法
1.1 试验菌株
供试菌蜂房哈尼亚菌从腐败大菱鲆中分离、鉴定,保藏于渤海大学水产品贮藏与保鲜实验室中心。
1.2 主要试剂
LB 肉汤、氯化钠(分析纯),青岛海博生物技术有限公司;琼脂糖、Ezup 柱式细菌基因组总DNA 提取试剂盒、Taq PCR Master Mix (2×,red dye)、DNA Marker,上海生工生物工程有限公司;RevertAid First Strand cDNA Synthesis Kit 试剂盒,赛默飞世尔科技公司。
1.3 主要仪器
LDZX-50FBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;BPS-100CA 恒温恒湿培养箱,上海一恒科技有限公司;MS105UD 电子分析天平,梅特勒-托利仪器有限公司;PCR 仪,德国Eppendorf 公司;Ge1Doc XR+全自动凝胶成像系统、CFX ConnectTM荧光定量PCR 检测系统,美国Bio-Rad公司;Legend Micro21R 台式微量离心机,美国Thermo 公司。
1.4 试验方法
1.4.1 菌株活化 将蜂房哈夫尼亚菌过夜活化后,按1∶100 的体积比接种于新鲜LB 液体培养基中,在28 ℃,160 r/min 的条件下,过夜培养12~16 h。
1.4.2 引物设计 以haII/haIR 为目的基因,以蜂房哈夫尼亚菌的16S rRNA 为内参基因,使用Primer 5 软件设计出适用于荧光定量PCR 试验的引物。
1.4.3 引物合成 所设计出的引物由上海生工生物工程股份有限公司合成,相关引物序列见表1和表2。

表1 蜂房哈夫尼亚菌haII/haIR 基因引物序列Table 1 The primers of haII/haIR gene of Hafnia alvei

表2 蜂房哈夫尼亚菌haII/haIR 基因RT-qPCR 引物序列Table 2 The primers of haII/haIR gene of Hafnia alvei by RT-qPCR
1.4.4 DNA 提取 采用上海生工生物工程有限公司的Ezup 柱式细菌基因组DNA 抽提试剂盒对细菌总DNA 进行提取,详细步骤如下:
1) 取1 mL 菌液加入1.5 mL 离心管中,在8 000 r/min 条件下离心1 min,弃去上清,加入180 μL Buffer Digestion 和20 μL Proteinase K,振荡后于56 ℃水浴1 h。
2) 向菌体中加入200 μL Buffer BD 后充分颠倒混匀,如有沉淀,可于70 ℃水浴10 min。
3) 加入200 μL 无水乙醇后充分颠倒。
4) 将吸附柱放入收集管中,将上步所得溶液及半透明悬浮物加入吸附柱中静置2 min,在12 000 r/min 条件下离心1 min,弃去收集管中废液。
5) 将吸附柱重新放回收集管中,加入500 μL 已加入异丙醇的PW Solution,在10 000 r/min条件下离心30 s,弃去滤液。
6) 加入500 μL 已加入无水乙醇的Wash Solution 于吸附柱中,在10 000 r/min 条件下离心30 s,弃去滤液。
7) 将吸附柱重新放回收集管中,在12 000 r/min 条件下离心2 min,除去残留的Wash Solution。
8) 取出吸附柱置于新的1.5 mL 离心管中,加入100 μL CE Buffer 静置3 min 后于12 000 r/min 下离心2 min。收集DNA 溶液于-20 ℃下保存备用。
1.4.5 引物适用性检测 将不同生长环境下的蜂房哈夫尼亚菌按上述方法提取DNA,并以50 μL PCR 体系进行扩增。体系添加试剂量为:
Taq PCR Master Mix 25 μL,上下游引物各2 μL,DNA 模板1 μL,Sterilizer ddH2O 20 μL。反应条件为:94 ℃预变性4 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸95 s,共30 个循环,最后72℃延伸10 min。将扩增成功的PCR 产物以1%琼脂糖凝胶电泳成像检测,记录结果。
1.4.6 RNA 提取及质量检测
1) 将过夜活化后的蜂房哈夫尼亚菌在10 000 r/min 条件下离心2 min 收集菌体。加入1 mL Trizol 混匀,将混合物室温放置5 min,以便样本被Trizol 充分裂解。
2) 每1 mL Trizol 裂解的样本加入200 μL氯仿,剧烈摇晃20 s 后于室温静置3 min,在4℃、12 000×g 条件下离心15 min。
3) 离心后,将最上层的无色液体(约总体积50%左右)移至一个新的无RNA 酶的EP 管中。
4) 向上述液体中加入500 μL 异丙醇,于室温静置10 min,并在4 ℃下12 000×g 条件下离心10 min。
5) 吸去上清液,加入由DEPC 水配制的75%乙醇,上下颠倒混匀,于4 ℃、7 500×g 条件下离心5 min。
6) 除去乙醇后,开盖于室温放置5~10 min,即得到纯化的RNA。
7) 将所得RNA 用DEPC 水溶解,采用琼脂糖电泳检测其质量。
1.4.7 cDNA 合成 将上步提取的RNA 反转录合成cDNA,详细步骤如下:
第1 步反转录体系为:RNA template 1 ng;oligo (dT)18 Primers 2 μL;RNase-free Water 9 μL;反应条件:65 ℃5 min;4 ℃2 min;4 ℃∞。
第2 步反转录体系为:上步RNA 变性溶液12 μL;5X Reaction Buffer 4 μL;RiboLock RNA酶抑制剂(20 u/μL) 1 μL;10 mmol/L dNTP Mix 2 μL;RevertAid M-MuLV(200 u/μL)1 μL;反应条件:42 ℃ 60 min;70 ℃ 5 min;4 ℃ 2 min;4 ℃ ∞。
1.4.8 荧光定量PCR 将不同环境下培养获得的cDNA 溶液稀释,按照以下反应体系进行荧光定量PCR 扩增,建立熔解曲线,所得数据跟据方程2-△△Ct计算并分析基因表达量的差异。
反应体系(共计20 μL):2×SYBR Green PCR Master Mix 10 μL;Sterilizer ddH2O 4 μL;F primer 0.5 μL;R primer 0.5 μL;cDNA 5 μL。
反应条件:95 ℃3 min,95 ℃10 s,55 ℃20 s,72 ℃20 s,75 ℃停留5 s 收集荧光信号,反应共进行40 个循环,并在65~95 ℃范围内建立熔解曲线。
表达量计算方程:△Ct (样品)=Ct (样品)-Ct(样品中内参)
△Ct(空白)=Ct(空白)-Ct(空白中内参)
△△Ct=△Ct(样品)-△Ct(空白)
目的基因相对表达量=2-△△Ct
1.5 不同环境对蜂房哈夫尼亚菌haI/R 系统表达的影响
1.5.1 不同碳源对蜂房哈夫尼亚菌haI/R 系统表达的影响 根据Zimmer 等[10]方法配制AB 培养基,所含成分为:3 g/L K2HPO4,1 g/L NH4Cl,0.3 g/L MgSO4·7H2O,0.15 g/L KCl,1 g/L NaH2PO4,0.01 g/L CaCl2,0.0025 g/L FeSO4·7H2O,酪蛋白水解氨基酸5 g/L,碳源5 g/L(碳源:葡萄糖、木糖、蔗糖、果糖、乳糖和麦芽糖)。将过夜培养后的蜂房哈夫尼亚菌按1∶1 000 体积比接种于不同碳源的AB 培养基中,于28 ℃、160 r/min 条件下培养至OD595为1.0 左右。以LB 液体培养基为空白对照组,按照1.4 节的方法测定不同样品中haII/haIR基因的表达量。
1.5.2 不同氯化钠质量浓度对蜂房哈夫尼亚菌haI/R 系统表达的影响 将过夜培养后的蜂房哈夫尼亚菌按1∶1 000 体积比接种于不同NaCl 质量浓度(5,10,20,30,40,50 mg/mL)的新鲜LB 液体培养基中,在28 ℃、160 r/min 条件下培养至OD595为1.0 左右,按1.4 节的方法测定不同样品中haII/haIR 基因的表达量。
1.5.3 不同pH 对蜂房哈夫尼亚菌haI/R 系统表达的影响 将过夜培养后的蜂房哈夫尼亚菌按1∶1 000 体积比接种于不同pH(5,6,7,8,9)的新鲜LB 液体培养基中,在28 ℃、160 r/min 的条件下培养至OD595为1.0 左右,按1.4 节的方法测定不同样品中haII/haIR 基因的表达量。
1.5.4 不同温度对对蜂房哈夫尼亚菌haI/R 系统表达的影响 将过夜培养的蜂房哈夫尼亚菌按1∶1 000 体积比接种于LB 液体培养基中,分别置于不同温度条件(4,15,28,37 ℃)下,160 r/min 培养至OD595为1.0 左右,然后按照1.4 节的方法测定不同样品中haII/haIR 基因的表达量。
1.6 数据分析
采用SPSS 19.0 统计软件及Origin 8.5 进行数据统计分析并绘图。
2 结果与分析
2.1 蜂房哈夫尼亚菌群体感应haII/haIR 基因的验证
根据haII/haIR 基因序列设计特异性引物,按上述步骤提取DNA,采用普通PCR 扩增,经1%琼脂糖凝胶电泳检验并通过凝胶成像仪观察扩增效果。将扩增成功的PCR 产物送至上海生工生物工程股份有限公司进行测序,测序结果与NCBI上GeneBank 数据库中的己有序列进行BLAST 比对分析。图1为haII/haIR 基因1%琼脂糖凝胶电泳图。从图中可以看出能够扩增出预期大小的片段,且条带单一,无引物二聚体出现。经NCBI BLAST 比对后,相似结果高达99%以上,表明扩增产物与目的序列的一致性高。

图1 蜂房哈夫尼亚菌haII/haIR 基因特异性引物PCR 扩增电泳图Fig.1 Agarose electrophoresis of Hafnia alvei haII/haIR genes amplification on products for ordinary PCR
2.2 荧光定量PCR 引物检测
2.2.1 引物特异性检测 以提取到的DNA 为模板,使用所设计的引物进行普通PCR 扩增,产物由1%的琼脂糖凝胶电泳检测,电泳图如图2所示。结果表明:所设计的引物扩增出预期大小的片段,条带单一、明亮,并且无引物二聚体,说明引物特异性良好,可用于后续试验。

图2 蜂房哈夫尼亚菌haII/haIR 基因荧光定量引物PCR 扩增电泳图Fig.2 Agarose electrophoresis of Hafnia alvei genes amplification on products for qPCR
2.2.2 荧光定量PCR 扩增曲线及引物特异性分析 以反转录得到的cDNA 为模板,使用所设计的引物进行荧光定量PCR,建立的熔解曲线如图3所示。在荧光定量PCR 试验中,SYBR Green 荧光染料是一种能与双螺旋结构DNA 结合的染料,随着PCR 产物的增加荧光值同步增加,荧光染料也有可能与非螺旋结构结合,从而影响试验结果[11],因此需要分析熔解曲线来确定引物的特异性。由图可知,各目的基因对应的溶解曲线只有一种特异性峰,说明目的基因扩增时并没有产生非特异性条带及引物二聚体,由此证明引物具有良好的特异性,试验结果真实可靠。
2.3 不同环境件对蜂房哈夫尼亚菌halI/R 系统表达情况的影响
2.3.1 不同碳源对蜂房哈夫尼亚菌halI/R 系统表达情况的影响 碳源对于微生物的生长代谢具有重要的意义,其主要为细胞生命活动提供所需的能量。常用的碳源主要有糖类、油脂、有机酸和小分子醇等[12]。本文研究了添加不同碳源(糖类)对蜂房哈夫尼亚菌群体感应haII/haIR 基因表达量的影响。从图4中可以看出,相较于其它碳源而言,木糖的添加使haII/haIR 相对表达量达到最高,分别为128.5%和223.8%;而蔗糖的添加抑制了haII/haIR 基因相对表达量。对于haII 基因,当碳源为蔗糖时,该基因表达量最少,仅为17.4%,对于其它碳源的利用程度依次为:木糖>果糖>葡萄糖>麦芽糖>乳糖>蔗糖;当碳源为麦芽糖时,haIR 基因表达量仅有22.4%,对于其它碳源的利用程度依次为:木糖>果糖>蔗糖>葡萄糖>乳糖>麦芽糖。本实验室前期曾探究不同碳源对蜂房哈夫尼亚菌生物膜的影响,较其它碳源而言,木糖的添加能够显著促使其生物膜形成。因此,本文的研究与之前的研究结果呈一致性[13]。
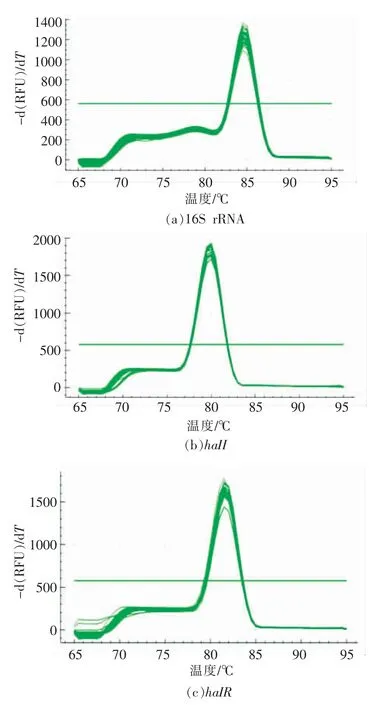
图3 蜂房哈夫尼亚菌基因荧光定量PCR 熔解曲线Fig.3 The melting curves of real-time PCR for gnens of Hafnia alvei
2.3.2 不同氯化钠质量浓度对蜂房哈夫尼亚菌halI/R 系统表达情况的影响 渗透压对微生物的生长有较大影响。当环境中氯化钠质量浓度较高时,对细菌生长造成较大的环境压力[14]。本文通过向LB 肉汤中添加氯化钠,使其最终质量浓度为5,10,20,30,40 mg/mL 和50 mg/mL,其 中 以10 mg/mL 氯化钠添加量为对照组,探究不同氯化钠质量浓度对蜂房哈夫尼亚菌haII/haIR 基因表达量的影响。结果如图5所示,当培养过程中氯化钠质量浓度为5~10 mg/mL 时,haII/haIR 基因呈上升趋势;而当氯化钠质量浓度在20~50 mg/mL 时,haII/haIR 基因表达情况均受到抑制;当氯化钠质量浓度为30 mg/mL 时,其haII/haIR 基因表达量仅分别为10 mg/mL 氯化钠培养条件的37.1%和30.9%;而采用质量浓度为50 mg/mL 的氯化钠培养时,haII 基因和haIR 基因表达量却均高于质量浓度为40 mg/mL 的氯化钠培养组,这可能由于蜂房哈夫尼亚菌受到高渗环境胁迫,该菌自身群体感应系统增强所导致的。孔西曼[15]研究发现,环境胁迫会显著刺激蜂房哈夫尼亚菌AHLs 的分泌,以维护自身QS 系统的稳定性。
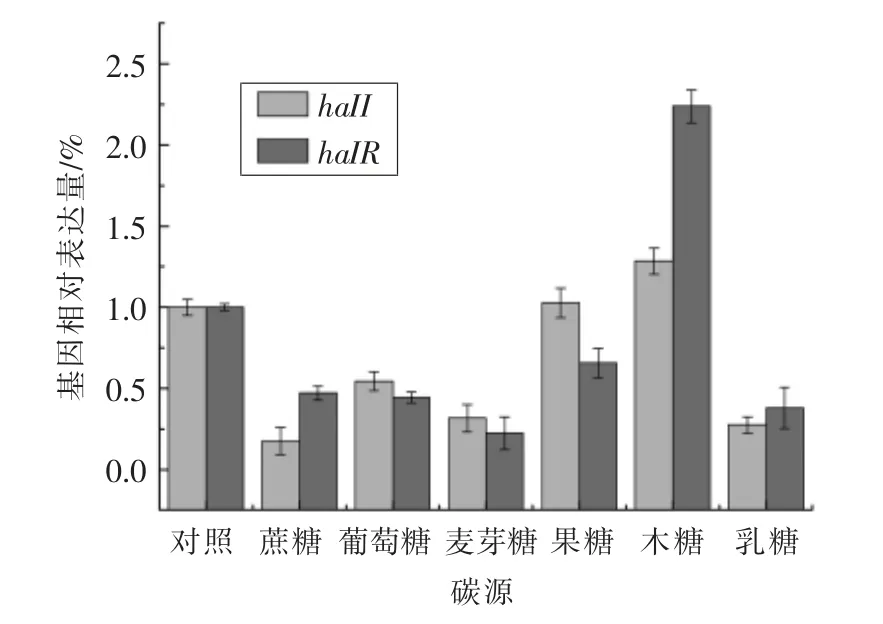
图4 不同碳源对蜂房哈夫尼亚菌haII/haIR 基因相对表达量的影响Fig.4 Effect of different carbon sources on haII/haIR gene expression in Hafnia alvei

图5 不同氯化钠质量浓度对蜂房哈夫尼亚菌haII/haIR 基因相对表达量的影响Fig.5 Effect of different NaCl mass concentrations on haII/haIR gene expression in Hafnia alvei
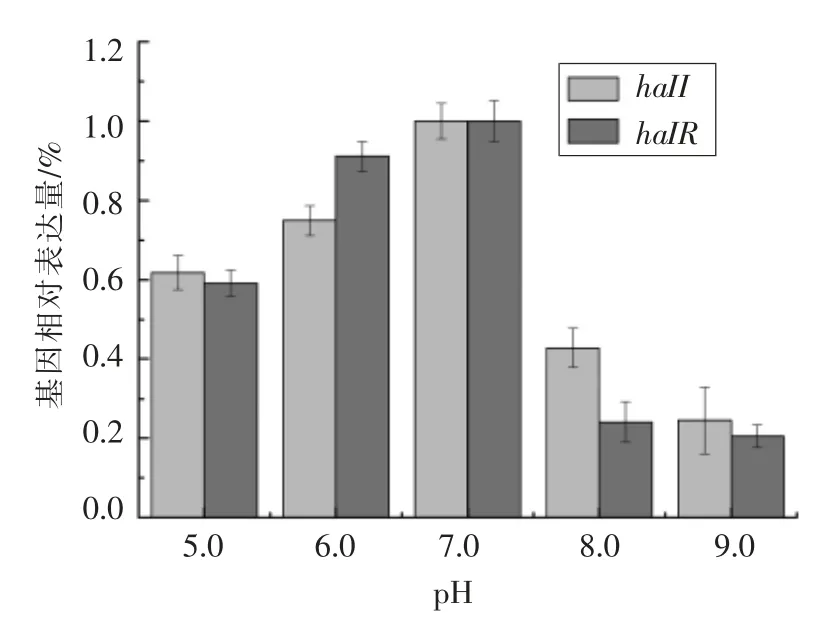
图6 不同pH 对蜂房哈夫尼亚菌haII/haIR 基因相对表达量的影响Fig.6 Effect of different pH on haII/haIR gene expression in Hafnia alvei
2.3.3 不同pH 对蜂房哈夫尼亚菌halI/R 系统表达情况的影响 pH 在微生物的生长代谢过程中占据重要地位。pH 可引起细胞膜电荷变化,导致微生物细胞吸收营养物质的能力发生变化,不同pH 条件在一定程度上反应微生物适应环境的能力[16]。本文以pH 5.0~9.0 的新鲜LB 肉汤培养蜂房哈夫尼亚菌,探究当外源环境pH 改变时,haII/haIR 基因的表达情况。结果如图6所示,当培养条件pH 值为5 时,haII 基因表达量达到pH 值为7 培养条件的61.8%;而在培养条件pH 值为9时,该基因表达量仅为pH 值为7 时的24.0%;haIR 基因表达情况与haII 基因相似。因此,就总体而言,与对照组相比(pH 值为7.0),酸性条件对蜂房哈夫尼亚菌haII/haIR 基因表达量影响较小;而碱性条件下蜂房哈夫尼亚菌haII/haIR 基因表达量则受到明显的抑制。研究表明:产气荚膜梭菌(Clostridium perfringens) 毒力因子的表达量受群体感应系统而下调,其主要是由酸性代谢物和酸性环境所介导。因此,可在该菌感染部位如伤口、肠道及食物中施加pH 控制抑制其毒力因子的表达[17]。这与本文研究不一致,可能由于不同类型微生物之间对酸碱条件敏感度不同所致。
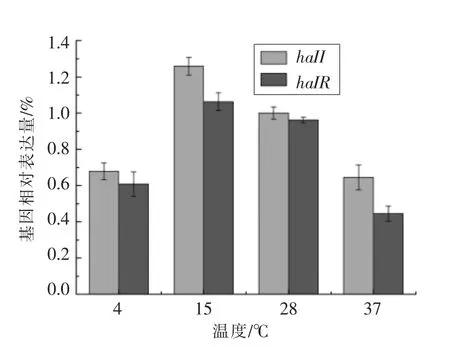
图7 不同温度对蜂房哈夫尼亚菌haII/haIR 基因相对表达量的影响Fig.7 Effect of different temperature on haII/haIR gene expression in Hafnia alvei
2.3.4 不同温度对蜂房哈夫尼亚菌halI/R 系统表达情况的影响 图7为不同温度培养条件下蜂房哈夫尼亚菌haII/haIR 基因的表达情况。结果表明,haII/haIR 基因均能在冷藏条件下(4 ℃)表达,为对照组(28 ℃)表达量的67.9%和60.9%;当培养温度为15 ℃时,haII/haIR 基因表达量最大;而当温度升至最适温度(37 ℃)以上时基因表达量有所下降。此外,温度的变化也会引起细菌生物膜形成能力和毒力因子表达量的变化[18-20]。由于海产品易受细菌污染形成生物被膜,且难以清除,因此极易造成海产品腐败及安全性风险。研究表明:低温(4~15 ℃) 会降低副溶血弧菌生物膜的形成能力,而37 ℃时,该菌生物膜形成减少[21],这与本试验结果相似。因此在水产品冷链运输过程中,可通过调节温度抑制蜂房哈夫尼亚菌致腐因子的表达。
3 结论
本文探究了不同环境因素下,蜂房哈夫尼亚菌haII/haIR 基因的表达情况。结果表明:当细菌处于不利环境时,可通过影响其QS 系统进而调控其生物学行为及功能。在不同碳源培养条件下,蜂房哈夫尼亚菌haII 基因表达情况依次为:木糖>果糖>葡萄糖>麦芽糖>乳糖>蔗糖;haIR 基因表达情况为:木糖>果糖>蔗糖>葡萄糖>乳糖>麦芽糖。当细菌处于高渗透压胁迫时,haII/haIR 基因表达量均有所下降。并且在碱性条件下,haII/haIR 基因表达量也受到抑制。低温培养条件(15 ℃)haII/haIR基因表达量明显上升;而超过其最适温度后(28℃)表达量有所下降。本文通过明晰环境因素对蜂房哈夫尼亚菌群体感应相关基因haII/haIR 表达的作用,为以后研究环境因素对群体感应调控的致腐性提供一定的理论基础。

