抗白粉病基因 PmCH1357相关分子标记验证与评价
陈 芳,李 欣,乔麟轶,李 锐,郭慧娟,常利芳,张树伟,阎晓涛,畅志坚,3,张晓军,3,李东方
(1.山西大学生命科学学院,山西太原 030006; 2.山西省农业科学院作物科学研究所/作物遗传与分子改良山西省重点实验室,山西太原 030031; 3.农业部黄土高原作物基因资源与种质创制重点实验室,山西太原 030031; 4.新疆生产建设兵团第六师农业科学研究所,新疆五家渠 831300)
由活体营养型真菌Blumeriagraminisf. sp.tritici(Bgt)引起的白粉病是小麦的一种主要病害,可严重影响小麦的产量和品质[1]。培育并种植适应当地的抗病小麦品种是控制该病害最为有效、经济并对环境安全的措施[2]。然而,小麦白粉菌生理小种多,毒性基因变异快,多数推广的抗病品种广泛种植3~5年后便开始丧失抗性[3-4]。因此,亟需持续挖掘和定位新的抗白粉病基因,开发与其紧密连锁的分子标记,通过分子标记辅助选择,加速小麦抗病育种进程。
分子标记辅助选择是利用分子标记与目标性状基因紧密连锁或共分离的特点,通过检测分子标记的基因型来跟踪目标基因的存在,不受环境影响,可快速、准确地对目标基因进行选择[5-6]。目前,借助分子标记辅助选择已将多个白粉病抗性基因转育到生产品种中。Xu等[7]通过与Pm2b紧密连锁的标记Xbwm20、Xbwm21、Xbwm25和Xcfd81构建了含Pm2b基因的以推广品种石麦15、石新828和科农199为遗传背景的近等基因系;刘金元等[8]借助与Pm2及Pm4a紧密连锁的标记对小麦品种或品系进行辅助选择,成功获得了含有3个白粉病抗性基因组合“Pm2+Pm4a”、“Pm2+Pm21”和“Pm4a+Pm21”的优异小麦品种扬麦158;桑大军等[9]通过回交育种与分子标记相结合将抗白粉病基因Pm13、Pm21、Pm30和Pm33导入小麦品种郑麦9023中,获得了抗白粉病的郑麦9023近等基因系,并通过杂交育种与分子标记技术相结合,育成了含白粉病抗性基因的新品种郑麦835、郑麦863和郑麦883。
白粉病抗病性鉴定通常采用人工接种法进行,但其发病情况易受环境等因素影响,严重降低了选择效率。育种过程中通过分子标记能高效地对该目标性状进行选择,而分子标记辅助选择的关键是有稳定可靠的分子标记。目前虽已开发出大量与白粉病抗性相关的分子标记,但这些标记多被应用于抗病基因的定位或克隆中,它们在不同遗传背景下的有效性有待进一步验证。目前,分子标记的有效性评价越来越受到育种家的关注。张维军等[10]利用5个小麦穗发芽功能性KASP标记对185份宁夏小麦种质资源进行穗发芽抗性筛选,发现标记Phs646和Phs666是穗发芽抗性鉴定的有效标记,而标记Vp1B1-83只能作为参考标记;胡洋山等[11]通过小麦分蘖成穗数基因相关分子标记与单位面积最大分蘖数和单位面积穗数的相关性研究,筛选到2个实用性的分子标记。但是关于白粉病抗性基因相关分子标记有效性评价方面的报道较少。本课题前期通过台长29/CH1357的F2群体在小偃麦衍生品系CH1357中定位到一个显性抗白粉病基因PmCH1357,其连锁标记为Xgwm190-22.2-Xbwm9-1.5-Xbwm8-11.3-PmCH1357-2.0-Xcfd81-0.8-Xbwm20-0.3-Xbwm21-0.7-Xbwm25-1.7-Xmp510。鉴于此,本研究利用前期定位的8个相关分子标记对以感白粉病品种晋麦66和抗白粉病品系CH1357构建的341个F2:3家系进行PCR检测,验证并评估这8个相关分子标记在该群体中的有效性及实用性,以期为小麦抗病育种的分子标记辅助选择提供参考。
1 材料与方法
1.1 试验材料与白粉病菌株
白粉病苗期抗病性鉴定材料包括抗病亲本CH1357(中8701//冀麦26/小偃7430)、感病品种晋麦66(原名太原610,由土耳其材料62166为母本,太原251为父本杂交选育而成)[12]及由二者构建的341个F2:3家系。
苗期白粉病抗性鉴定所用菌株E09由中国农业科学院植物保护研究所周益林研究员惠赠,本课题组通过活体幼苗保存。该菌株是在中国中部和北部地区发现的一个广谱型白粉菌株,对Pm2、Pm4a、Pm4b、Pm5e、Pm12、Pm16、Pm21和Pm30等抗白粉病基因表现为无毒,而对Pm1、Pm3b、Pm3c、Pm3e、Pm5a、Pm17和Pm19等抗白粉病基因表现为有毒[13]。
1.2 苗期白粉病抗性鉴定
在山西省农业科学院人工培养气候室中对供试材料进行苗期白粉病抗性鉴定。用75%的无水乙醇对每个株系的种子浸泡消毒后种植于72穴的育苗盘,每穴5粒种子,每个育苗盘种植8穴对照品种台长29作为诱发穴,以确保病害的充分发生。人工气候室条件为光照强度125 μmol·m-2·s-1,光周期12 h,温度16~22 ℃(光照时22 ℃,无光照时16 ℃),湿度70%左右。种植大约10 d后,用预先繁殖的新鲜白粉菌人工扫抹幼苗,每株系处理10株苗,重复鉴定3次。接菌大约10 d后,待感病对照晋麦66充分发病后,用 0~4级分级标准[14]逐一调查每个株系的反应类型。其中0级为免疫型,0;级为近免疫型,1级为高抗型,2级为中抗型,3级为中感型,4级为高 感型。
1.3 抗白粉病基因标记
试验选用本课题组前期在(台长29/CH1357)F2群体中定位的8个与白粉病抗性基因PmCH1357相关的分子标记,验证并评价其在不同遗传背景中的有效性,引物信息详见表1。
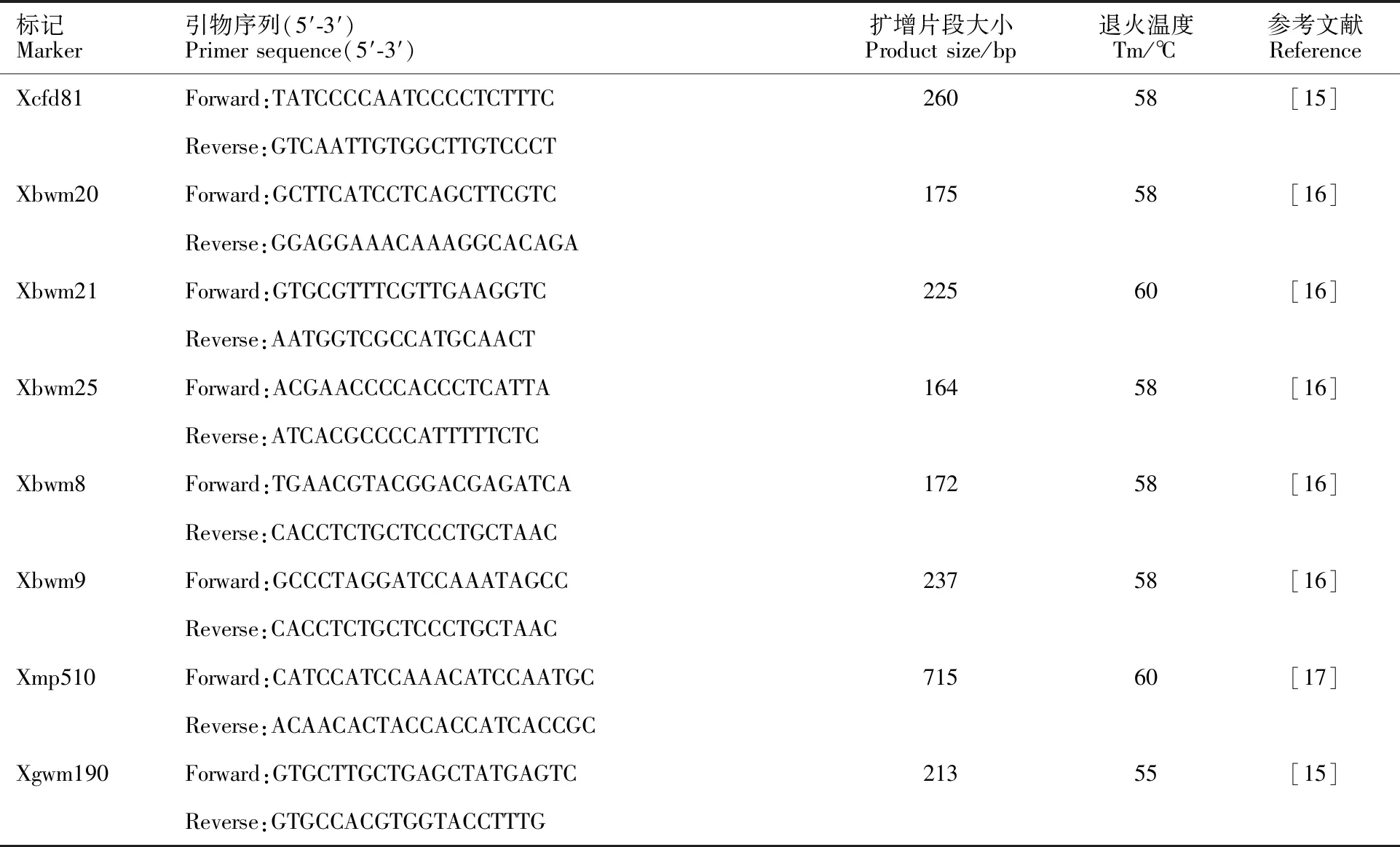
表1 8对与抗白粉病基因 PmCH1357连锁的标记及引物序列Table 1 Eight markers linked to the powdery mildew resistance gene PmCH1357 and primers applied in this study
1.4 基因组DNA提取及PCR扩增
在三叶期剪取亲本及341个F2:3家系植株的幼嫩叶片,液氮冷冻研磨后,用CTAB法[18]提取基因组DNA,用NANODROP 2000分光光度计测定DNA浓度和纯度后,进行PCR扩增。PCR扩增体系为10 μL,含1.0 μL DNA模板(50 ng·μL-1)、1.0 μL 10×buffer(10 mmol·L-1Tris-HCl,pH 8.3,50 mmol·L-1KCl,1.5 mmol·L-1MgCl2),0.25 μL dNTP (0.2 mmol·L-1)、0.4 μL引物(10 μmol·L-1)、0.2 μL Taq酶和7.15 μL ddH2O。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性45 s,55~62 ℃(依引物退火温度而定)复性45 s,72 ℃延伸 30 s,35个循环;72 ℃延伸10 min,12 ℃保存。利用8%非变性聚丙烯酰胺凝胶(Acr与Bis质量比为29∶1)电泳检测PCR扩增产物,硝酸银染后,甲醛溶液中显色照相并统计标记基因型带型。
2 结果与分析
2.1 8对抗白粉病基因(PmCH1357)相关标记的基因型检测结果
利用(台长29/CH1357)群体中定位的抗白粉病基因PmCH1357的8对相关标记对晋麦66/CH1357的341个F2:3单株进行基因型检测,结果(表2)表明,8对相关标记中只有标记Xmp510为显性标记,不能区分纯合抗病基因型和杂合抗病基因型,其余7对标记均为共显性标记,能清晰地区分纯合抗病基因型和杂合抗病基因型。部分标记PCR扩增产物的电泳检测结果见图1。
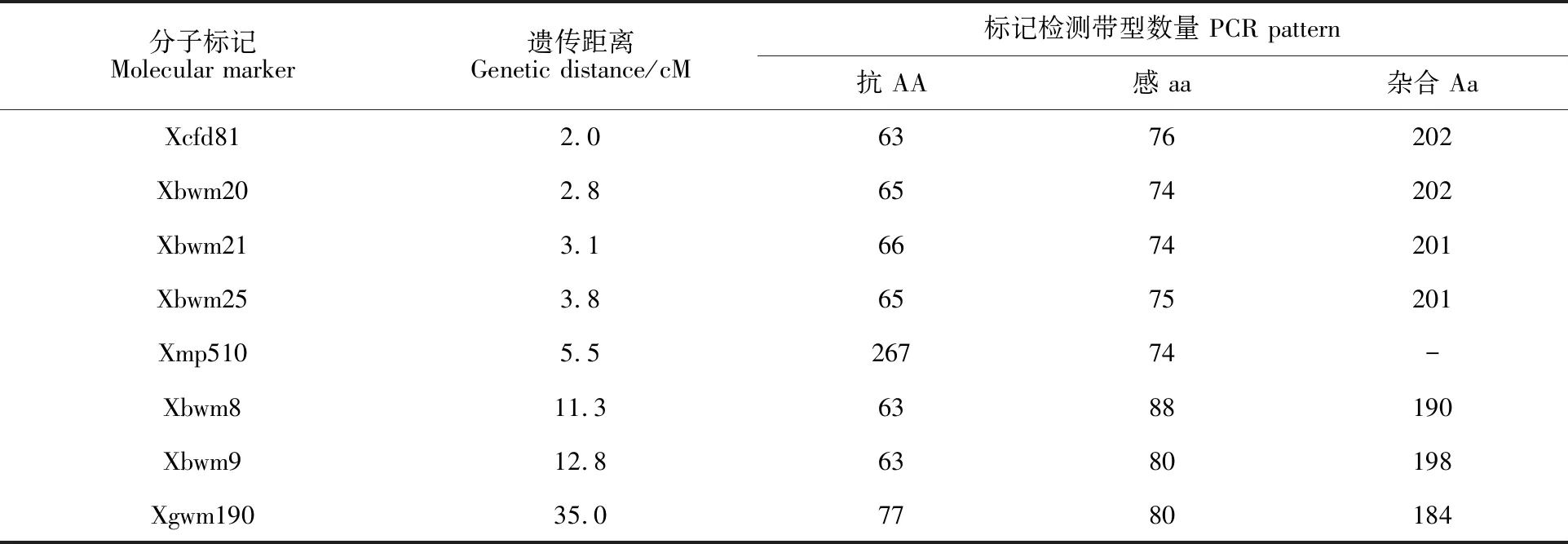
表2 8对抗白粉病基因( PmCH1357)连锁标记在(晋麦66/CH1357)F2:3家系中的扩增带型分布Table 2 PCR amplification patterns of the eight markers associated with powdery mildew resistance gene PmCH1357 in the population of(Jinmai 66/CH1357) F2:3 lines
2.2 单个连锁标记选择的有效性
利用白粉病菌株E09对上述标记检测为纯合抗病基因型的单株进行苗期白粉病抗性鉴定。结果表明(表3),标记Xcfd81检测的63个纯合抗病基因型株系中,表现为纯合抗病的株系为62个,基因型与表型符合率为98.4%;标记Xbwm21检测的66个纯合抗病基因型株系中,表现为纯合抗病的株系为63个,基因型与表型符合率为95.5%;标记Xbwm20检测的65个纯合抗病基因型株系中,表现为纯合抗病的株系为62个,基因型与表型符合率为95.4%;标记Xbwm25检测的65个纯合抗病基因型株系中,表现为纯合抗病的株系为61个,基因型与表型符合率为 93.8%;标记Xbwm8检测的63个纯合抗病基因型株系中,表现为纯合抗病的株系为54个,基因型与表型符合率为85.7%;标记Xbwm9检测的63个纯合抗病基因型株系中,表现为纯合抗病的株系为54个,基因型与表型符合率为85.7%;标记Xgwm190检测的77个纯合抗病基因型株系中,表现为纯合抗病的株系为41个,基因型与表型符合率为53.2%;标记Xmp510检测的267个抗病基因型株系中,表现为纯合抗病的株系为69个,基因型与麦型符合率为25.8%。
2.3 标记组合在分子标记辅助选择中的有效性
将不同标记两两组合,进一步分析其在分子标记辅助选择中的有效性,结果见表3。从基因型与表型符合率来看,单独用Xcfd81对PmCH1357进行选择时,基因型与表型符合率为98.4%;用标记组合Xcfd81+Xbwm8、Xcfd81+Xbwm9或Xcfd81+Xgwm190进行选择时,基因型与表型符合率均可达到100%;但用标记组合Xcfd81+Xbwm21、Xcfd81+Xbwm20和Xcfd81+Xbwm25进行选择时,基因型与表型的符合率为98.4%,与单独使用Xcfd81的结果相同。单独使用Xbwm21、Xbwm20或Xbwm25对PmCH1357进行选择时,基因型与表型的符合率分别为95.5%、95.4%和93.8%;当它们分别与Xbwm8、Xbwm9或Xgwm190组合使用时,基因型与表型的符合率均达到97%以上,甚至100%;但Xcfd81、Xbwm21、Xbwm20和Xbwm25两两组合使用时,基因型与表型的符合率与该2个标记中遗传距离较近的标记相比无明显差异。Xgwm190、Xbwm9和Xbwm8两两组合使用时,基因型与表型的符合率与该2个标记中遗传距离较近的标记相比无明显差异。表明使用基因两侧的标记进行筛选可获得更高的选择准确率。
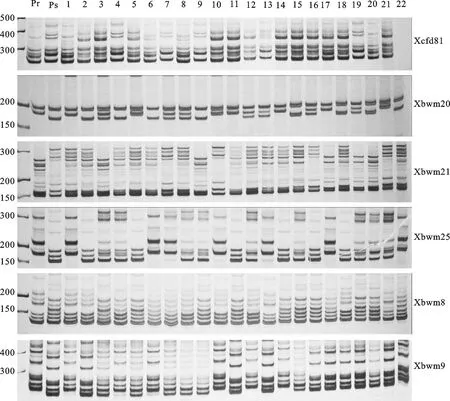
Pr:抗病亲本CH1357;Ps:感病亲本晋麦66;1~22:F2:3群体株系编号。
从获得的纯合抗病表型株系数量来看,单独使用1个标记进行选择时,除Xmp510为显性标记,无法准确区分纯合抗病与杂合抗病基因型外,遗传距离较近的标记可以获得较多的抗病株系,而遗传距离较远的标记获得的抗病株系则较少,表明连锁标记与抗病基因的遗传距离是影响选择效率的一个重要因素。从表3可以看出,当使用2个标记组合进行选择时,筛选出的纯合抗病株系数量与遗传距离较远的标记筛选的株系数量相比没有明显差异,甚至有所减少。如在PmCH1357的下游,Xbwm25的遗传距离较远,单独使用Xbwm25筛选获得的纯合抗病株系数量为61个,而使用Xcfd81+Xbwm25、Xbwm21+Xbwm25和Xbwm20+Xbwm25标记组合筛选获得的纯合抗病株系数量则分别是60、61和61个,与单独使用Xbwm25筛选结果无明显差异。Xbwm8、Xbwm9或Xgwm190都位于PmCH1357的上游,且与PmCH1357遗传距离相对较远,分别为11.3、12.8和35.0 cM,单独使用1个标记筛选获得的纯合抗病株系数量分别为54、54和41个,而使用下游遗传距离最近的标记Xcfd81与这3个标记组合筛选时,获得的纯合抗病株系数量分别为53、52和38个,与单独使用这3个标记相比无明显差异。这表明,在使用2个标记组合筛选时,获得的纯合抗病株系数量受到遗传距离较远的标记限制。
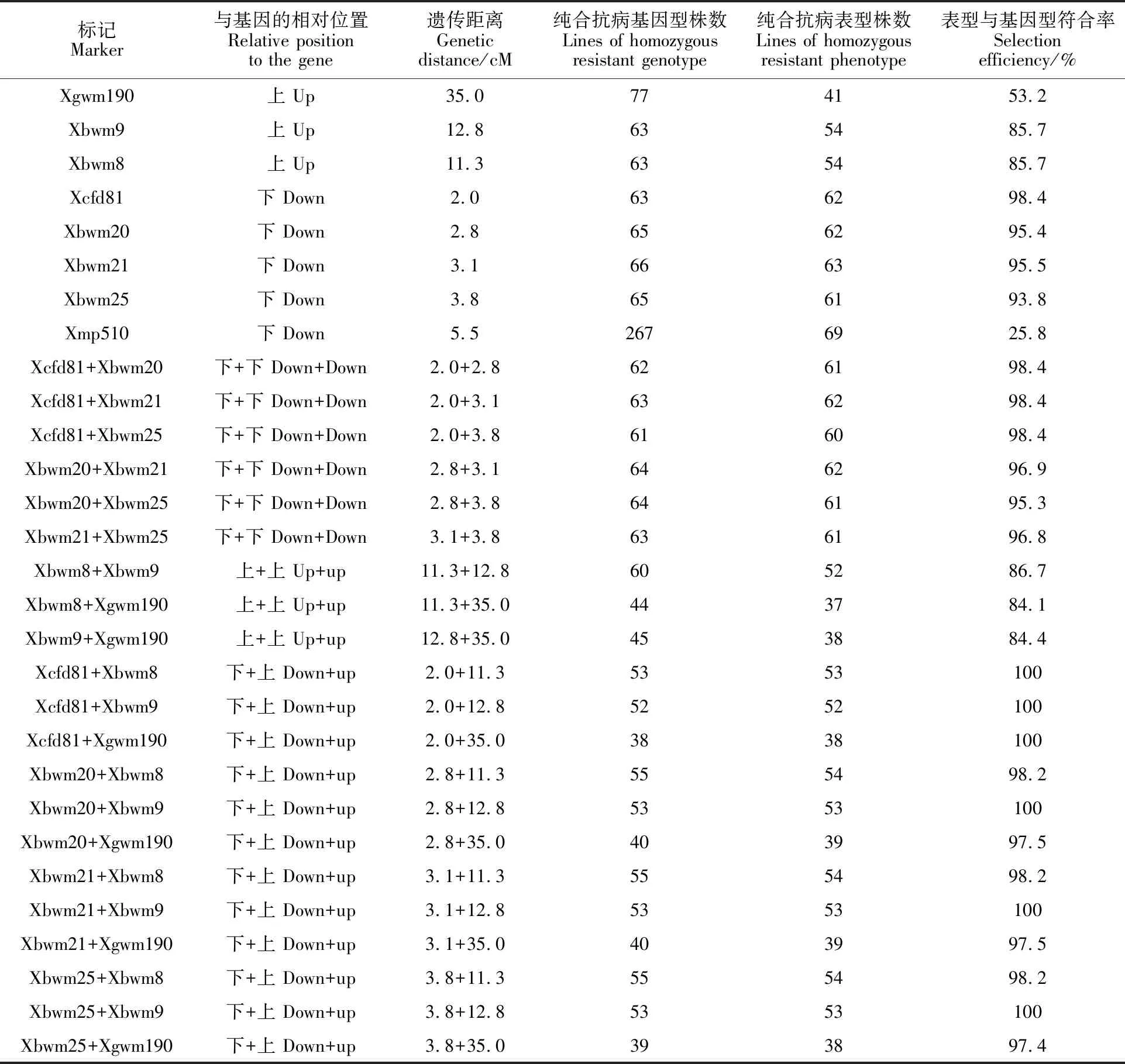
表3 8个连锁标记及不同标记组合的符合率评价Table 3 Evaluation of the selection efficiency with eight markers and their combinations associated with powdery mildew resistance gene PmCH1357
3 讨 论
将多个不同的抗病基因聚合到同一优良品种或品系中可有效提高品种抗性及抗病持久性[19],分子标记技术的发展为小麦抗病基因的聚合提供了有利条件。目前,小麦中与各种性状相关的分子标记已有大量报道,但这些分子标记大多用于基因的染色体定位,而基因定位是基于特定亲本构建的遗传群体进行的,因此,与该基因连锁的分子标记大多仅在特定的环境或遗传背景中能有效追踪目标基因的存在,实际应用中分子标记的使用缺乏一定的通用性。例如杨 燕等[20]和张兆萍等[21]分别利用4个与穗发芽抗性相关的分子标记Vp1B3、MST101、Xgwm155和wmc104对不同品种进行了检测,杨 燕等[20]认为,MST101和wmc104与穗发芽抗性不相关,Vp1B3和Xgwm155与穗发芽抗性相关;而张兆萍等[21]则认为,Xgwm155、MST101与穗发芽抗性不相关,Vp1B3和wmc104与穗发芽抗性相关;仅Vp1B3在中国品种中表现出较为稳定的选择效率。因此,对现有分子标记在不同遗传背景或品种中的有效性验证具有十分重要的意义。
本研究对前期在小偃麦衍生品系CH1357中定位的位于染色体5DS上的抗白粉病基因PmCH1357相关的8对分子标记通过晋麦66/CH1357 F2:3家系群体进行了有效性评价。4对分子标记Xcfd81、Xbwm21、Xbwm20和Xbwm25对整个群体检测的纯合抗病基因型与纯合表现型符合率均达到93%以上,可用于抗白粉病基因PmCH1357的筛选;标记Xbwm8、Xbwm9和Xgwm190对群体检测的纯合抗病基因型和纯合表现型符合率偏低,原因可能是分子标记与目标基因间的遗传距离影响分子标记辅助选择效率[22],分子标记与目标基因连锁越紧密,二者间发生交换重组的概率越低,选择效率则越高。Peng等[23]认为,分子标记与目标基因间的遗传距离小于2.0 cM时,标记检测的准确率及有效性可达到90%以上。三个标记Xbwm8、Xbwm9和Xgwm190距离目标基因较远,遗传距离分别为11.3 cM、12.8 cM和35.0 cM,标记与目标基因间发生重组的可能性较大,故选择效率较低;标记Xmp510与目标基因的遗传距离为5.5 cM,选择效率却仅有25.8%,可能因为该标记为显性标记,不能有效区分纯合和杂合抗病基因型,在育种实践中存在较大的局限性。
分子标记辅助选择中通过多对标记的结合使用,可提高选择效率和准确性[24-25]。本研究通过对不同标记组合的选择效率进行分析后发现,当组合标记位于连锁基因的同一侧时,表型和基因型的符合率并无明显增加,纯合抗病株系数量却有所降低,其原因可能是当标记位于基因同一侧时,同一个重组株系会在不同标记间表现出不同的基因型,遗传距离近的标记受到遗传距离远的标记限制,遗失更多的纯合抗病株系,从而降低了标记的选择效率;但当2个组合标记分别位于基因两侧时,表型和基因型的符合率显著提高,不同侧标记组合进行选择后表型和基因型的符合率基本相同,而获得的纯合抗病株系数受到遗传距离较远的标记的限制。因此,在使用连锁标记进行辅助选择的时候,选择基因两侧的标记进行组合可获得较好的选择效果;为了进一步提高选择效率,避免遗失更多的有效株系,应尽量选择与该基因遗传距离较近的标记。所以,在对抗白粉病基因PmCH1357进行选择时,使用标记组合Xcfd81+Xbwm8进行筛选可以获得更高的准确性及更多的有效株系。
总之,现有的分子标记多数为连锁标记,扩增带型反映的是特定基因组区段的序列特征,并不代表目标基因本身。因此,为了有效提高分子标记选择的准确性,还需对抗病基因PmCH1357构建高密度的饱和遗传图谱,寻找与该抗病基因更为紧密的两侧标记,或克隆该基因,开发可直接用于抗病基因选择的功能标记或共分离标记,以进一步提高分子标记选择的效率。

