131 I治疗老年分化型甲状腺癌患者的效果分析及对胞外信号调节激酶通路蛋白的调控作用研究
王磊,凌瑞,易军,贠军,李南林,吕勇刚,孟庆杰
空军军医大学西京医院(解放军第四军医大学第一附属医院)甲状腺乳腺血管外科,西安710032
甲状腺癌是临床上发病率较高的内分泌系统恶性肿瘤,也是引起死亡的重要原因[1‐2]。虽然目前分化型甲状腺癌发病率占甲状腺癌比例较低,但有逐年升高的趋势[3‐4]。目前临床上治疗甲状腺癌通常采用的方法为手术合并131I治疗[5]。131I治疗分化型甲状腺癌已经被临床广泛采用,且其安全性和有效性已经得到广泛的认可[6]。但是随着治疗剂量的增大,131I的治疗风险也明显增加。因此,探索131I治疗后患者的不良反应及治疗相关生物大分子参与机制具有重要的临床价值和实践意义。本研究分析131I治疗老年分化型甲状腺癌患者的效果及对胞外信号调节激酶(extracellular signal‐regu‐lated kinase,ERK)通路蛋白的调控作用。
1 资料与方法
1.1 一般资料
收集2014年2月至2016年12月解放军第四军医大学第一附属医院收治的老年分化型甲状腺癌患者的病历资料。纳入标准:均经病理检查确诊为甲状腺癌,属于乳头状癌,且均无肝肾转移。排除标准:严重的肝肾功能异常;严重的代谢性疾病;严重的免疫系统疾病;存在明显的认知功能障碍。根据纳入、排除标准,共纳入180例老年分化型甲状腺癌患者,男95例,女85例;年龄61~65岁,平均(63.3±3.1)岁;肺部转移31例,颈部淋巴结转移149例。
1.2 治疗方法
所有患者在治疗前均停用左甲状腺素钠片3周,忌碘摄入4周;服用131I后2 h开始采取促进唾液分泌的措施。所有患者均接受131I一次性口服治疗,无转移首次治疗剂量为100 mCi,淋巴结转移为150 mCi,肺转移为200 mCi,骨转移为 250 mCi。每日早、中、晚观察患者的情况直至治疗结束。
1.3 观察指标
取患者空腹静脉血血清待用。分析患者治疗前后白细胞数、血小板数、红细胞数和淋巴细胞数变化,并检测肝肾功能相关蛋白谷丙转氨酶(ala‐nine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、血尿素氮(blood urea nitro‐gen,BUN)、碱性磷酸酶(alkaline phosphatase,ALP)及肌浆网钙离子ATP酶2a(sarcoplasmic retic‐ulum calcium ATPase 2a,SERCA2a)水平的变化;分析患者血清中相关生物大分子Ras、Raf、胞外信号调节蛋白激酶(mitogen‐activated protein kinase,MEK)、胞外信号调节激酶1/2(extracellular signal‐regulated kinase 1/2,ERK1/2)、B细胞淋巴瘤/白血病‐2相关X蛋白(B‐cell lymphoma/leukemia‐2 asso‐ciated X protein,BAX)、B细胞淋巴瘤/白血病‐2(B cell lymphoma/leukemia‐2,Bcl‐2)、p53、p73、热休克蛋白70(heat shock protein 70,HSP70)、磷酸酶和紧张 素同系 物(phosphatase and tensin homolog,PTEN)、Beclin1、高迁移率族蛋白B1(high mobility group box 1,HMGB1)及增殖细胞核抗原(prolifer‐ating cell nuclear antigen,PCNA)水平的变化。结果以与β‐actin蛋白的相对表达量表示。
1.4 仪器及试剂
冷冻离心机购自BIORIDGE公司;酶标仪购自美国伯乐公司;全自动生化分析仪购自罗氏公司。ALT、AST、BUN、ALP及SERCA2a检测试剂盒购自南京检测生物工程研究所;白细胞、血小板、红细胞和淋巴细胞检测试剂盒购自罗氏公司;Ras、Raf检测试剂盒购自Omega公司;MEK和ERK1/2蛋白检测试剂盒购自Abcam公司;BAX/Bcl‐2、p53检测试剂盒购自武汉博士德生物工程有限公司;p73、HMGB1及PCNA检测试剂盒购自R&D公司。
1.5 统计学分析
采用SPSS 21.0统计软件分析数据。计量资料以均数±标准差(±s)表示,组间比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 131 I治疗前后血细胞水平的比较
131I治疗后老年分化型甲状腺癌患者血清中白细胞数和血小板数均低于治疗前,差异均有统计学意义(P<0.05);治疗前后红细胞数和淋巴细胞数比较,差异均无统计学意义(P>0.05)。(表1)
表1 131I治疗前后血细胞水平的比较(± s)

表1 131I治疗前后血细胞水平的比较(± s)
时间131I治疗前(n=1 8 0)131I治疗后(n=1 8 0)t值6.3 3±1.0 2 5.0 6±0.9 9 2.5 4 6 4.5 5±0.6 8 4.5 1±0.6 9 1.9 8 6 2 8 9.6±2 5.2 2 3 6.9±1 8.7 2.1 4 7 1.5 2±0.3 2 1.1 5±0.2 8 3.6 5 3 P值白细胞(×1 0 9/L)<0.0 5红细胞(×1 0 12/L)>0.0 5血小板(×1 0 9/L)<0.0 5淋巴细胞(×1 0 9/L)>0.0 5
2.2 131 I治疗前后肝肾功能指标水平的比较
131I治疗前后老年分化型甲状腺癌患者血清中肝肾功能相关分子ALT、AST、BUN、ALP及SER‐CA2a蛋白水平比较,差异均无统计学意义(P>0.05)。(表 2)
表2 131I治疗前后肝肾功能指标水平的比较(± s)
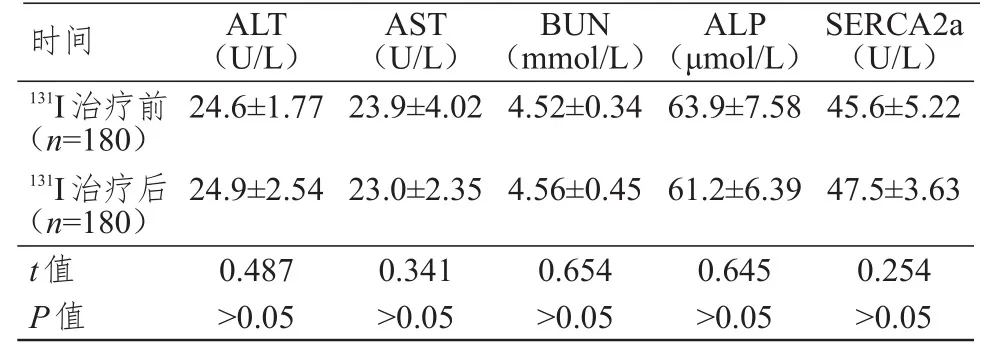
表2 131I治疗前后肝肾功能指标水平的比较(± s)
时间131I治疗前(n=1 8 0)131I治疗后(n=1 8 0)t值P值2 4.6±1.7 7 2 4.9±2.5 4 0.4 8 7>0.0 5 2 3.9±4.0 2 2 3.0±2.3 5 0.3 4 1>0.0 5 4.5 2±0.3 4 4.5 6±0.4 5 0.6 5 4>0.0 5 6 3.9±7.5 8 6 1.2±6.3 9 0.6 4 5>0.0 5 4 5.6±5.2 2 4 7.5±3.6 3 0.2 5 4>0.0 5 A L T(U/L)A S T(U/L)B U N(m m o l/L)A L P(μ m o l/L)S E R C A 2 a(U/L)
2.3 131 I治疗前后ERK通路蛋白相对表达水平的比较
131I治疗后老年分化型甲状腺癌患者ERK信号通路关键分子Ras、Raf、MEK及ERK1/2水平均降低,且与治疗前相比差异均有统计学意义(P<0.05)。(表 3)
表3 131I治疗前后ERK通路蛋白相对表达水平的比较(± s)

表3 131I治疗前后ERK通路蛋白相对表达水平的比较(± s)
时间131I治疗前(n=1 8 0)131I治疗后(n=1 8 0)t值P值0.5 6±0.0 9 0.4 6±0.0 8 2.1 7 5<0.0 5 0.4 4±0.0 8 0.3 3±0.0 7 2.1 1 8<0.0 5 0.4 5±0.0 6 0.4 0±0.0 9 3.4 7 4<0.0 5 0.5 0±0.1 1 0.4 5±0.0 7 6.3 4 7<0.0 5 R a s R a f M E K E R K 1/2
2.4 131 I治疗前后HSP70、PTEN及Beclin 1相对表达水平的比较
131I治疗后老年分化型甲状腺癌患者HSP70、PTEN及Beclin1蛋白相对表达水平均低于治疗前,差异均有统计学意义(P<0.05)。(表4)
表4 131I治疗前后HSP70、PTEN及Beclin 1相对表达水平的比较(± s)

表4 131I治疗前后HSP70、PTEN及Beclin 1相对表达水平的比较(± s)
时间131I治疗前(n=1 8 0)131I治疗后(n=1 8 0)t值P值0.5 1±0.1 0 0.4 4±0.0 5 1.2 8 7<0.0 5 0.4 1±0.0 8 0.3 6±0.0 6 3.3 4 2<0.0 5 0.4 4±0.0 8 0.3 8±0.0 7 2.6 4 8<0.0 5 H S P 7 0 P T E N B e c l i n 1
2.5 131 I治疗前后 p53、 p73、BAX及Bcl- 2相对表达水平的比较
131I治疗后老年分化型甲状腺癌患者血清中p53、p73及BAX蛋白相对表达水平均升高,而Bcl‐2蛋白相对表达水平降低,与治疗前比较差异均有统计学意义(P<0.05)。(表5)
表5 131I治疗前后 p53、 p73、BAX及Bcl‐ 2相对表达水平的比较(± s)

表5 131I治疗前后 p53、 p73、BAX及Bcl‐ 2相对表达水平的比较(± s)
时间131I治疗前(n=1 8 0)131I治疗后(n=1 8 0)t值P值0.1 5±0.0 3 0.1 9±0.0 6 4.2 2 8<0.0 5 0.2 0±0.0 4 0.2 4±0.0 5 3.3 3 7<0.0 5 0.3 0±0.0 5 0.3 5±0.0 5 2.9 4 6<0.0 5 0.3 4±0.0 8 0.3 0±0.0 5 2.7 8 0<0.0 5 p 5 3 p 7 3 B A X B c l‐2
2.6 131 I治疗前后HMGB 1及PCNA相对表达水平的比较
131I治疗后老年分化型甲状腺癌患者HMGB1及PCNA蛋白相对表达水平均低于治疗前,差异均有统计学意义(P<0.05)。(表6)
表6 131I治疗前后HMGB 1及PCNA相对表达水平的比较(± s)
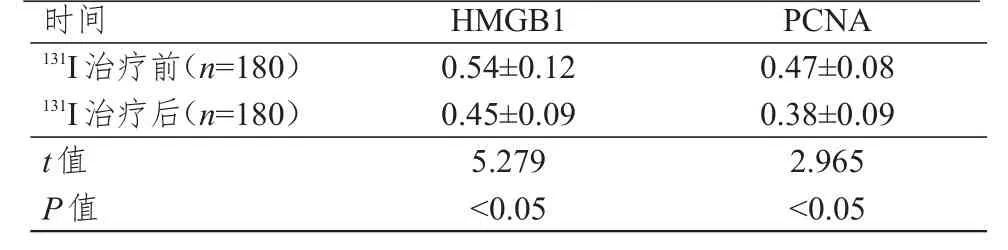
表6 131I治疗前后HMGB 1及PCNA相对表达水平的比较(± s)
时间131I治疗前(n=1 8 0)131I治疗后(n=1 8 0)t值P值0.5 4±0.1 2 0.4 5±0.0 9 5.2 7 9<0.0 5 0.4 7±0.0 8 0.3 8±0.0 9 2.9 6 5<0.0 5 H M G B 1 P C N A
3 讨论
放射性131I治疗分化型甲状腺癌的临床效果已经得到广泛认可,且其不良反应发生率低,对患者器官无严重损伤,具有广泛的应用前景。但是目前关于131I治疗后体内生物大分子表达水平变化及对细胞内信号转导通路的影响报道较少。本研究在分析131I治疗老年分化型甲状腺癌患者效果及对ERK通路蛋白的调控作用时发现131I治疗后老年分化型甲状腺癌患者血清中白细胞数和血小板数降低而红细胞数、淋巴细胞数、ALT、AST、BUN、ALP及SERCA2a水平无明显变化;血清中ERK信号通路蛋白BAX、p53、p73蛋白水平均升高而Ras、Raf、MEK、ERK1/2、Bcl‐2、HMGB1 及 PCNA 蛋白水平均降低。因此,131I治疗老年分化型甲状腺癌患者效果与其调控患者体内ERK信号通路有关,且不影响患者的肝肾功能。
细胞外信号向细胞内转导是外部刺激影响细胞生理生化反应的主要方式,其主要是由一系列的信号转导通路介导的。ERK信号转导通路是肿瘤细胞功能维系的关键信号转导通路[7‐8]。血管生成增多是恶性肿瘤的重要标志,而丝裂原活化蛋白激酶/细胞外调节蛋白激酶信号通路与肿瘤血管新生过程密切相关[9],且PI3K/AKT及MEK/ERK信号转导通路在肿瘤血管内皮细胞迁移中发挥着积极的作用[10]。以往的研究发现双丁酰环腺苷酸抑制甲状腺癌细胞株FTC‐133增殖过程与其调控细胞内ERK信号转导通路有关[11],且雌激素受体α与细胞外信号调节蛋白激酶和血管内皮生长因子在甲状腺癌的发生、发展、转移及细胞凋亡过程中发挥着广泛的作用[12]。同时,MAPK/ERK和PI3K/AKT信号通路的基因变异与甲状腺癌的发生发展过程密切相关,且可以作为药物干预治疗甲状腺癌的靶点[13]。本研究发现131I治疗后老年分化型甲状腺癌患者血清中ERK信号通路蛋白Ras、Raf、MEK及ERK1/2表达水平降低,提示131I治疗与引起甲状腺癌患者ERK信号转导通路的恢复有关。
增殖细胞核抗原PCNA也与甲状腺组织的病理过程紧密联系,也是甲状腺癌患者临床治疗效果及预后的标志物[14‐15]。以往的研究发现,甲状腺乳头状癌及甲状腺乳头状增生的鉴别诊断中PC‐NA水平是一项重要指标[16],且甲状腺炎合并甲状腺恶性肿瘤患者体内PCNA蛋白的表达水平也明显增高[17]。以往的研究发现,甲状腺乳头状癌中hMLH1、hMSH2和PCNA的表达水平是患者临床分期的重要标志物,也与患者的预后密切相关[18‐19]。活血消瘿方对结节性甲状腺肿模型大鼠甲状腺细胞增殖和凋亡的调控作用也主要通过其影响细胞内PCNA蛋白的表达实现[20],而甲状腺癌组织中p27和增殖细胞核抗原的表达水平是甲状腺癌临床分期的重要标志物,且二者表达呈明显的正相关[21]。本研究发现131I治疗后老年分化型甲状腺癌患者血清中PCNA蛋白水平降低,提示131I治疗也与引起甲状腺癌患者PCNA蛋白的恢复有关。
因此,131I治疗老年分化型甲状腺癌患者效果与其调控患者体内ERK信号通路有关,且不影响患者的肝肾功能。

