机械搅拌式动物细胞反应器不同桨型组合的CFD数值模拟与优化
丁宁,李超,白力,郭美锦,2,庄英萍,2,张嗣良
1 华东理工大学 生物反应器工程国家重点实验室,上海 200237
2 上海生物制造技术协同创新中心,上海 200237
由哺乳动物细胞培养表达的治疗性单克隆抗体 (Monoclonical antibody,MAB) 因其特异性强和耐受性好等特点,已成为最好的治疗肿瘤药物之一[1]。自2018年6月国家药品监督管理局正式批准“PD-1抗体药物”在中国上市[2],抗体药物已从研发阶段进入到大规模生产和市场应用阶段,从而使抗体药物生产的技术瓶颈已由抗体表达系统构建转移到抗体大规模生产制备技术,其中由以前的升级培养规模放大到千升级是最关键的制备技术[3]。因此,适用于大规模细胞悬浮培养性能的生物反应器 (Bioreactor) 是核心装置之一。
生物反应器内的流场特性是其使用性能的决定因素,通常有两种研究方式。一种是实验方法,如粒子图像测速法 (Particle image velocimetry,PIV) 研究方法[1-3];另一种是计算流体力学(Computational fluid dynamics,CFD) 数值模拟方法[4-7],即通过模型化和数值分析对反应器内的流场特性进行研究。实验方法适用于实验规模的小型反应器研究,且研究方法具有一定的限制,如PIV方法仅适用于单向流或者极低气含率条件下的流场研究。而CFD方法不受反应器大小或操作条件的限制,具有通用性。但CFD方法的主要问题是建模过程中各种模型或模型参数的选择对结果的影响较大。实际研究过程中,首先用实验室规模获得的流场数据对 CFD模型进行验证和优化,然后用优化的CFD模型对大型或工业规模的反应器内流场特性进行分析[8-10]。
在进行CFD模拟过程中,影响流场模拟准确性的因素很多,包括网格大小、湍流模型、两相间相互作用力模型、气泡聚并破碎模型等等[11-12]。对于动物细胞培养,由于生物反应器通气量通常较低,生物反应器的流场特性主要由搅拌决定。因此,在模型验证阶段,可以用PIV方法获取的单相流流场数据对CFD结果进行验证和优化。如洪厚生等[11]在30 L搅拌罐中研究了4种不同桨叶的流场、剪切率、Kolmogorov尺度和混合时间,并进行PIV实验验证。但是,该文只是对在单层桨体系、不通气和小体积 (30 L) 特定条件进行了考察,而在大规模细胞培养时所需要的多搅拌组合条件,即既要满足反应器内培养液混合均匀,又要满足搅拌系统运动时产生尽量小的剪切力,如0.1–0.5 Pa。至今尚未有该方面报道。
本文根据我们以前建立的标准k-ε模型[12-13]对生物反应器内流场模拟,分析了5种常用的动物细胞悬浮培养轴流型搅拌桨在通气条件下的流场特性,确定了用于细胞培养的最佳搅拌桨组合,并将该型搅拌桨用于动物细胞培养过程,验证其实际应用效果。
1 材料与方法
1.1 细胞株和培养基
中国仓鼠卵巢细胞 (Chinese hamster ovary cell,CHO 细胞) 由杭州安普生物公司提供,表达VEGFR1-Fc-IL-1ra抗体。基础培养基和流加培养基分别为AMP B001和AMP F001。
1.2 细胞培养方法
分别用设计的生物反应器进行流加批式(Fed-batch) 培养,密度为1×106cells/mL,恒定转速为50 r/min,通过四气控制系统调节氧分压,保证过程中溶氧在40%,温度控制在37 ℃,分别在第7天和第8天流加培养基,速率约为45 mL/d。在培养过程中每24 h取样一次,用于细胞计数等分析。
1.3 细胞培养生物反应器搅拌桨和 CFD数值模拟方法
动物细胞反应器搅拌桨一般采用轴向流而不是径向流搅拌桨,前者具有较低的剪切力和良好的混合性能,符合细胞对剪切力敏感和悬浮培养的特点。本文选用三窄叶变截面螺旋桨式搅拌器(HBMI3)、四斜叶涡轮搅拌器 (PBT4)、三宽叶螺旋桨式搅拌器 (FBMI3)、三叶大倾角桨式搅拌器(LPBI3) 和二叶大倾角桨式搅拌器 (LPBI2) 为研究对象,详细结构见图 1。反应器底部通过单管进行通气。
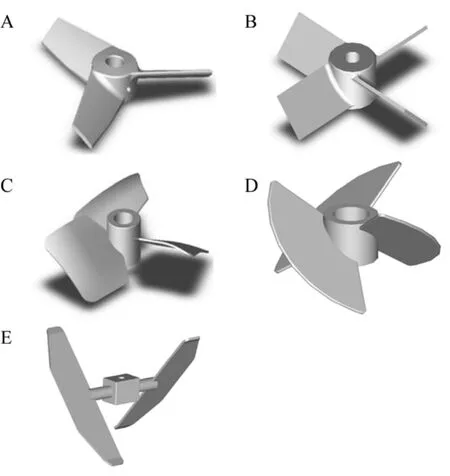
图1 五种机械轴流式搅拌桨Fig. 1 Five commonly used axial flow impellers. (A)Hydrofoil blade mixing impeller (HBMI3). (B) Pitched blade turbine (PBT4). (C) Fluid foil blade mixing impeller (FBMI3). (D) Large pitched blade impeller(LPBI3). (E) Large pitched blade impeller (LPBI2).
针对以上常见的5种轴流型搅拌桨,分别模拟了5种双层搅拌桨组合情况下反应器内的流场情况。所采用的流场模拟软件为 ANSYS CFX 15.0,搅拌桨的旋转采用多重参考系 (Multiple reference frame,MRF) 方法进行模拟,计算网格划分采用ANSYS ICEM CFD 15.0进行,其中桨区的网格进行局部加密,桨区网格数约60万,每个模型总网格数约 150万。计算模型采用 Euler双流体气液两相模型,湍流模型应用标准k-ε湍流模型,采用优化的曳力模型对气液相间作用力进行描述[14-15]。气泡的分布采用群平衡模型(Population balance model,PBM) 进行描述[8]。模型残差收敛标准为残差小于10–4且桨叶扭矩和反应器内的气含率达到稳定。所模拟的动物细胞反应器几何尺寸及操作参数信息如表1所示。
2 结果与分析
本文采用计算流体力学 (CFD) 方法对通气条件下5种搅拌桨组合在生物反应器内的流场进行数值模拟,并进行CHO细胞培养应用验证,结果如下。
2.1 速度矢量场比较
从图 2速度矢量场来看,5种搅拌桨组合的流型各不相同。从中可见 PBT4桨组合下速度矢量较为规整,说明该桨组合流场控制能力较强,主要是由于其叶片较HBMI3号桨组合要宽,所以表现出较规整的流型。FBMI3、LPBI3搅拌桨组合有个共同的特点就是桨周围大速度梯度范围较其他桨要大,但是最大速度有所下降。说明这种桨组合的混合能力要好 (桨的影响范围大)。LPBI2号桨叶片面积虽然相对较小,但是也表现出较佳的排出能力,从而形成较为完整的轴向循环。

表1 模拟采用的反应器参数Table 1 Parameters of bioreactor used in simulation
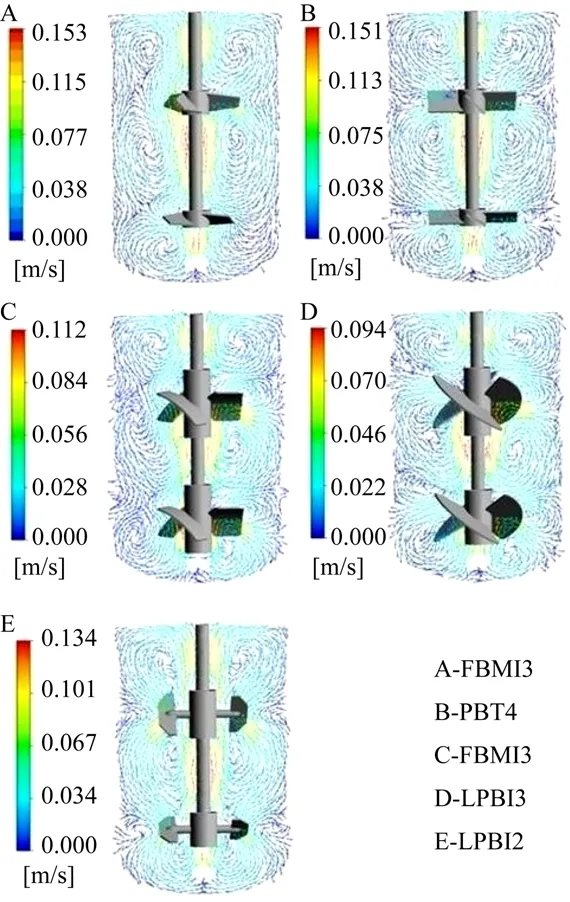
图2 不同桨型组合得到的速度矢量图Fig. 2 Velocity vectors in the bioreactor using different impeller combinations.
2.2 气含率分布比较
如图3所示,所试搅拌桨组合的持气能力都较差,在当前操作条件下均表现为气泛状态。这与动物细胞反应器的设计原理直接相关:细胞对剪切较敏感,搅拌桨和转速的设计过程中需要充分平衡物料混合、细胞悬浮、剪切和氧传质的关系。因此设计过程中搅拌桨通常只起细胞悬浮和物料混合的作用,且需控制尽量低的剪切;而气液传质或气泡的分散主要通过气体分布器实现,反应器内气泡聚并和破碎较少。本文采用的5种轴流桨本身气体分散能力差,且采用单管通气,故呈现气泛特征。
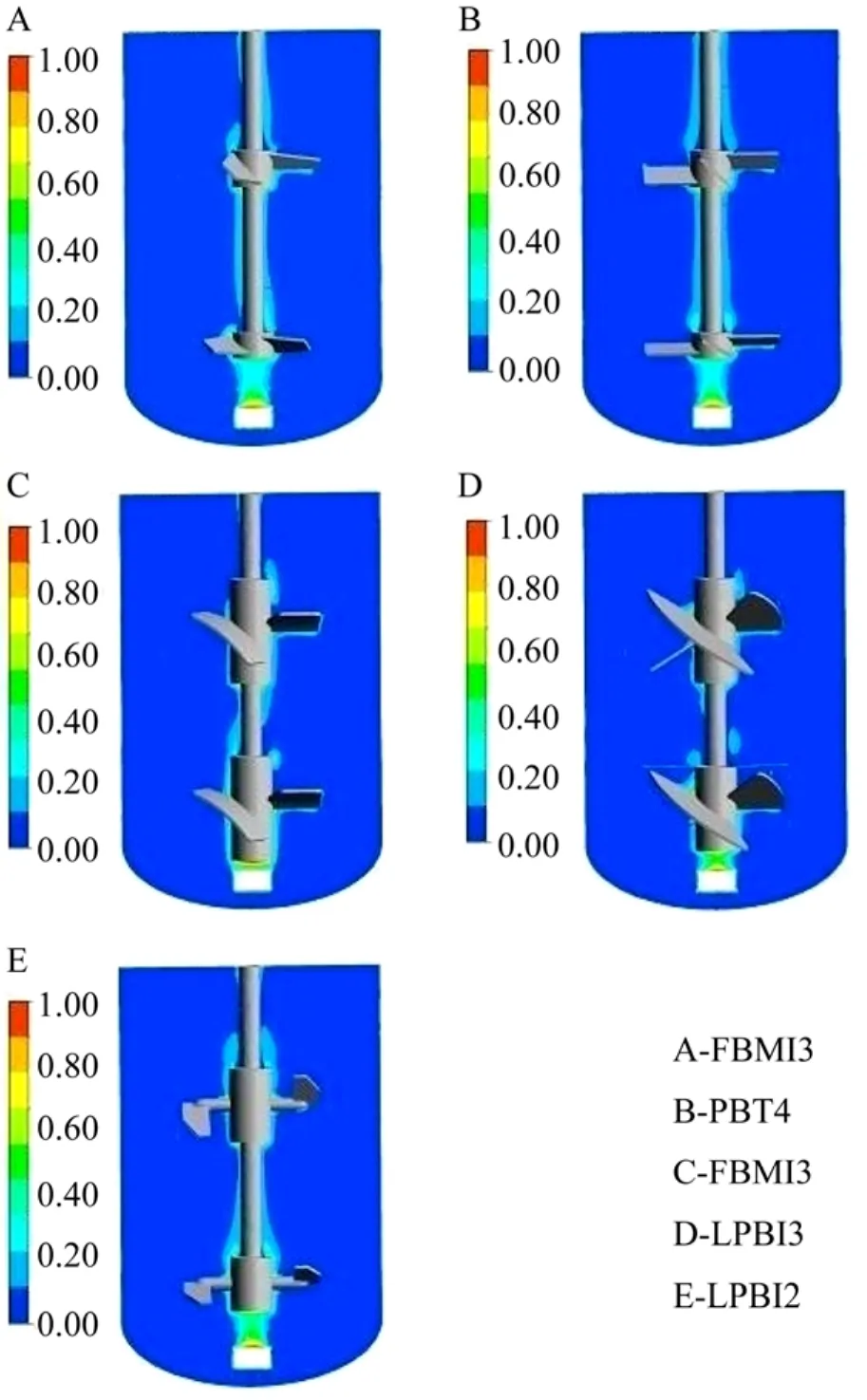
图3 不同桨型组合得到的气含率分布图Fig. 3 Distributions of gas hold-up in the bioreactor using different impeller combinations.
2.3 剪切力比较
表2比较了5种搅拌桨组合形成的流场中平均剪切力与最大剪切力,表明HBMI3搅拌桨组合形成的平均剪切力最小为0.4 Pa,相比较而言FBMI3与LPBI3形成的平均剪切力最大约为0.53 Pa。最大剪切力的比较发现,LPBI2搅拌桨组合形成的最大剪切力最大为 26.95 Pa,是其他搅拌桨组合的3–8倍,FBMI3搅拌桨组合形成的最大剪切力最小为3.85 Pa。之所以FBMI3与LPBI3形成的最大剪切力较小而平均剪切力相对较大是由于这两种搅拌桨在搅拌桨周围形成的高剪切应变率 (速度梯度) 的范围较大,使得搅拌桨区的平均剪切力增大造成的,这从剪切力分布云图 (图4) 也可证明。
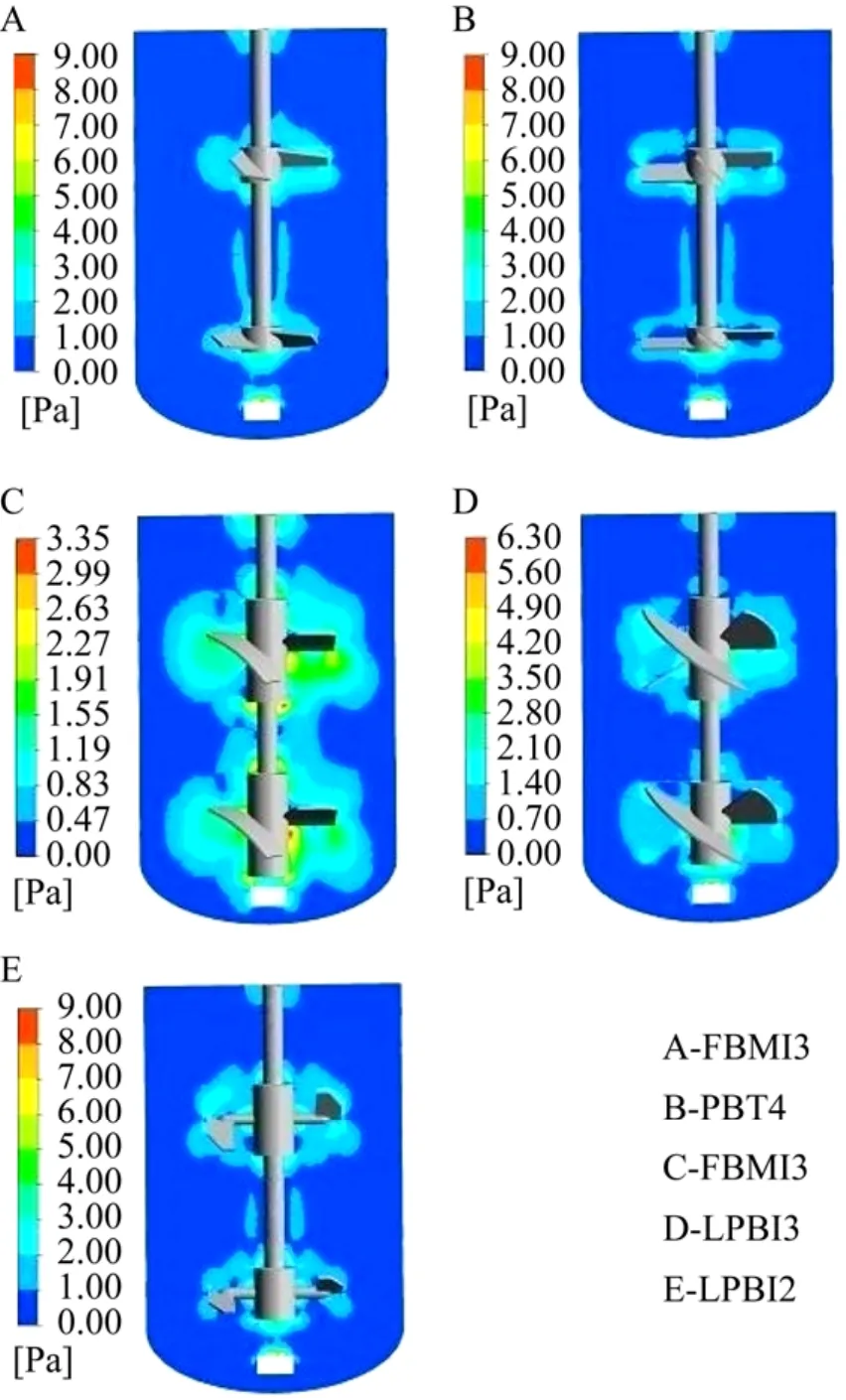
图4 不同桨型组合得到的剪切率分布图Fig. 4 Distributions of shear rate in the bioreactor using different impeller combinations.
2.4 CHO细胞培养结果
将CHO细胞分别在以上5种生物反应器中进行培养15 d,细胞密度和抗体的表达水平结果如表3。CHO细胞在FBMI3搅拌型式下细胞密度和抗体表达水平均最高,其可能原因是该细胞对反应器内的最大剪切力比较敏感,且在该条件下最大剪切力为 3.853 Pa,比其他搅拌组合明显小(表2)。因此,细胞的活率较高,也保证了细胞正常的生理代谢状态,使得表达外源抗体能力最高。结果还发现,当最大剪切力约超过6.0 Pa后,细胞成活率和抗体浓度均显著降低。本试验CHO细胞在剪切力26.95 Pa条件下,细胞的活率下降至75.6%,抗体浓度下降至0.85 g/L。结果说明CHO细胞对反应器内的最大剪切力比较敏感,最大剪切过大会使细胞生长受损。需指出的是,由于该反应器采用的是单管通气,气泡直径较大,而搅拌桨打散气泡的能力较差 (见图 3),因此在反应器内气泡聚并和破碎概率较小,且气泡直径较大,在其离开液面破碎时产生的剪切力较小,因此本文通过 CFD模拟并没有考虑气泡离开液面破碎时产生的剪切。
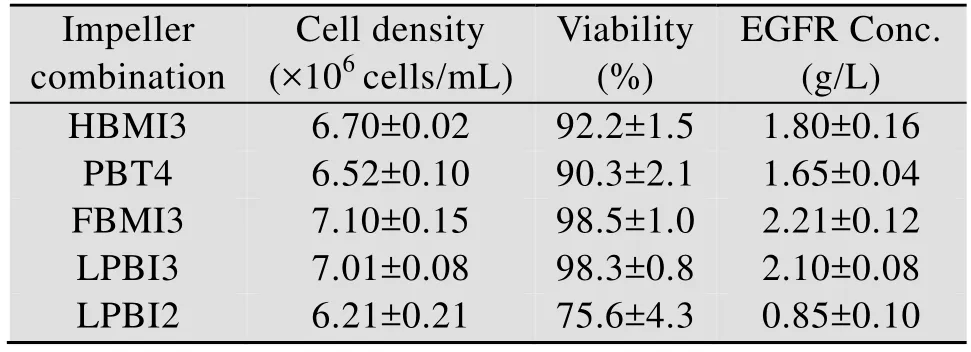
表3 重组CHO细胞在不同搅拌组合培养结果Table 3 Growth and EGFR antibody production by CHO cells cultured in bioreactor using different impeller combinations
3 讨论
动物细胞培养生物反应器已经成为现代生物药物如治疗性单克隆抗体和疫苗制备的重要设备。影响哺乳动物细胞大规模悬浮培养技术应用主要是生物反应器流场特性,尤其是对剪切力(Shear force) 高敏感特性的悬浮培养细胞[13-14]。本文对5种常见的轴流式搅拌桨的5种组合进行了CFD数值模拟,评估了不同组合下在0.1 vvm通气率下的生物反应器的流场特性,并对5组搅拌桨组合进行了CHO细胞的培养试验,发现平均剪切率与细胞生长和抗体的表达无显著相关性,而局部最大剪切力越小的搅拌桨组越有利于细胞的生长和抗体的高效表达 (表2和表3)。
悬浮培养的动物细胞在搅拌条件下由于在生物反应器内的运动而承受较大的剪切力,尤其是经过搅拌桨叶尖线速度大而产生的剪切效应。最早报道[16],只要培养时表面通气避免气泡进入和避免气质界面处气泡的破裂,在搅拌速度100至450 r/min中,三种杂交瘤细胞系在不同搅拌速度下生长细胞的存活力和抗体产量是相当的。但是对于工业规模动物细胞培养如CHO细胞,细胞密度通常大于107cells/mL,必须在培养时进行深层通气,包括空气、氧气和CO2等气体。当气体通入到培养液时,气泡的形成、聚并和破碎将对过程产生重要影响。当生物反应器内流体涡流的不稳定性引起气泡夹带时,在200 r/min转速时可以观察到细胞损伤[16],并且在低转速下其涡流的形成取决于生物反应器系统几何形状和细胞悬浮液的体积。Chisti[17]阐明了叶轮类型、直径、转速和罐直径等参数与细胞损伤的相关性,并提出了一种在无挡板生物反应器中增强混合的方法。通常,细胞生长的最佳状态时的剪切应力数量级约为0.1–0.5 Pa,但是,很难通过实验设备来直接测量不同桨叶剪切应力,尤其是大规模生物反应器。此外,在实际的剪切敏感型细胞的放大过程中,不同细胞采用的剪切放大参数可能不同,如最大剪切率、平均剪切率、能量耗散率、EDCF等[14-16,18],且采用传统的经验公式计算得到的单一剪切参数通常无法准确描述反应器内的真实剪切环境[17,19]。而通过数值模拟方法对反应器内的剪切环境进行全面评估,并将各剪切参数与细胞培养结果进行关联分析,可以高效确定特定剪切敏感型细胞放大的关键剪切参数和剪切阈值,为大规模生物反应器的设计和放大提供了一种理性的方法。

