蛋白核小球藻高效同化硝态氮联产微藻蛋白
骆小英,陈俊辉,魏东
华南理工大学 食品科学与工程学院,广东 广州 510640
近年来,利用微藻来处理富含氮磷等污染物的工农业废水已经成为研究热点。这不仅是因为微藻能够充分利用废水中的有机碳及无机氮磷促进自身生长,而且还能够将这些富营养化的物质转化为高附加值产物如高级燃料、高蛋白饲料等,有助于解决资源短缺和环境污染问题,符合当前建设资源节约型及环境友好型社会的要求[1]。工业的快速发展带来了经济上的快速增长,同时也产生了更多的废气、废水和废渣。特别是废气中的NOX以及废水中硝酸根离子的大量排放,严重威胁了人类健康和生态环境。通常工业废水中NO3–-N含量为200 mg/L,而生产炸药、化肥、果胶、玻璃纸和金属加工等行业的工业废水含有的NO3–-N含量则超过1 000 mg/L[2]。若将这些高硝酸盐含量的废水直接排放到自然水体中,可能通过饮用水等途径进入人体,引发蓝婴综合征、成年人胃癌、甲氧蛋白血症等疾病[3],同时也会进一步加剧水体的富营养化,引起赤潮和水华等现象。目前,国内外处理硝酸盐废水的方法主要分为物化处理和生化处理[4]。物化处理存在成本高并需要后期的进一步处理等问题;生化方法往往是利用反硝化细菌进行反硝化,但处理周期长,极易造成二次环境污染。此外,若单纯地将硝酸根中的氮转化为氮气,则是一种资源上的巨大浪费。如何将“三废”变“三宝”,是实现资源化利用的重要内容,而采用微藻培养技术处理废水可以从根本上解决上述问题,真正实现高氮废水的资源化利用。目前在水质治理方面研究比较多的微藻主要是绿藻,特别是小球藻属的藻种[5]。蛋白核小球藻Chlorella pyrenoidosa是最常见的小球藻藻种之一。它不仅生长速度快、营养方式多样、耐受能力强[6],而且已经有大量的研究将蛋白核小球藻与污水处理相结合[7-8],实现了废水减排,并获得了富含蛋白质的生物质资源。
本文首先在摇瓶培养条件下系统研究了不同培养模式和光照模式 (光强恒定及阶梯变化)对蛋白核小球藻的生长、硝酸根同化速率及藻体蛋白和色素含量的影响;然后将获得的优化培养条件,在5 L光发酵罐中进行实验室小试培养,以期进一步提高蛋白核小球藻同化硝酸根的能力,为今后利用蛋白核小球藻处理工业废硝酸或硝酸盐废水并联产高蛋白微藻生物质提供基础数据,提供废水资源化利用、变废为宝的创新技术支撑。
1 材料与方法
1.1 藻种及保种培养
蛋白核小球藻Chlorella pyrenoidosa系北京大学陈峰教授惠赠,采用 Basal培养基进行斜面转接保藏,保藏温度为4 ℃[9]。
1.2 实验试剂及仪器
葡萄糖、硝酸钠和硝酸等实验所用试剂均为分析纯;AL104型电子天平和Seven Easy型pH计均购自瑞士 Mettler Toledo公司;Allegra 25R型高速冷冻离心机购自美国 Beckman Coulter公司;DHG-9123A型电热恒温鼓风干燥箱购自上海一恒科学仪器有限公司;DHZ-DA型恒温摇床购自太仓实验设备厂;AMA240型高压灭菌锅购自英国 ASTELL公司;AW442P4 流式细胞仪购自美国贝克曼库尔特商贸有限公司;HI83200多参数水质分析仪购自意大利 HANNA公司;K9840半自动凯氏定氮仪购自中国 Hanon公司;SBA-40D生物传感器购自山东省科学院;UV2300紫外-可见分光光度计购自天美科学仪器有限公司。
1.3 实验方法
1.3.1 培养基和培养实验
本研究采用改良的 Basal培养基作为模拟废水。其中,葡萄糖和硝酸钠作为实验初始的碳氮源,初始葡萄糖浓度依据实验设计而变,硝酸钠浓度为15 g/L,盐度为15‰[10]。
研究中主要选用不同培养模式和光照模式为主要考察对象。首先在摇瓶培养体系中,全面评价这些条件对蛋白核小球藻的生长、硝酸根同化速率及胞内积累含氮化合物含量的影响;然后在5 L的光发酵罐中对最优条件进行小试培养验证,从而获得最大硝态氮同化速率和最大小球藻生物量产率。
1.3.2 不同培养模式的摇瓶培养实验
在摇瓶中进行4种培养模式的比较,分别为分批培养、25%培养基回流的补料分批培养 (下文统称25%回流补料分批)、50%培养基回流的补料分批培养 (下文统称50%回流补料分批) 和培养基不回流的补料分批培养 (下文统称补料分批培养)。简述如下:将混养培养的种子液按约1×108CFU/mL接入到摇瓶中,连续培养的初始葡萄糖浓度为50 g/L,而25%回流补料分批、50%回流补料分批和补料分批培养条件下的初始葡萄糖浓度均为20 g/L。培养过程中以500 g/L葡萄糖母液作为碳源补充。当培养基中葡萄糖浓度低于 10 g/L,补加葡萄糖至20–25 g/L。培养至第4天,分别取25%回流补料分批和 50%回流补料分批中培养液总体积的 25%和 50%,离心后回流上清液到摇瓶中。培养时间为6 d,培养温度为 (30±1) ℃,摇床转速为 150 r/min,连续光照,光照强度为210 μmol/(m2·s)。
1.3.3 不同光照模式的摇瓶培养实验
两种光照模式为阶梯式光强和恒定光强,具体培养条件为:恒定光强培养时光照强度为210 μmol/(m2·s),阶梯式光强初始值为120 μmol/(m2·s)。初始葡萄糖浓度均为20 g/L。阶梯式光强模式培养的小球藻从第2天开始,每天增加30 μmol/(m2·s),第4天增加到 210 μmol/(m2·s)后即保持不变。同时,在第2、3天分别向两种光照模式培养液中补加葡萄糖至20 g/L。保持初始接种密度、补糖水平及培养温度和摇床转速与两种培养模式下相同。连续光照,培养5 d。
1.3.4 发酵罐补料分批培养
小球藻的补料分批培养在5 L光发酵罐中进行。光发酵罐由5 L玻璃发酵罐配置环绕LED光照系统组成,工作体积为3.5 L,具体方法如下:将培养6 d的种子液接种到装有已灭菌培养基的发酵罐中,接种量为发酵罐工作体积的7%,并保证接种密度与摇瓶实验保持一致。培养过程中采用连续光照的混养补料分批培养,光照强度根据细胞密度的变化从 120 μmol/(m2·s) 不断增加到560 μmol/(m2·s),培养基的 pH 和温度分别为(6.5±0.05) ℃和(30±2) ℃,搅拌转速为 150–200 r/min,通气量为 2.5–10 L/min,消泡剂浓度为 0.3%(W/V),培养到128 h后结束培养。
培养过程中的补料流加方法为:根据蛋白核小球藻的生长情况,每12 h一次性添加500 g/L葡萄糖母液若干毫升,以保证培养基中还原糖浓度在20–35 g/L;同时,通过在线自动流加1 mol/L浓硝酸母液作为流加氮源同时,维持培养基 pH值稳定在6.5–7.0之间;培养期间滴加适量消泡剂控制培养基中泡沫的生成,避免产生过多泡沫而抑制小球藻的正常生长。
1.4 分析方法
1.4.1 生物量测定
蛋白核小球藻的生物量采用干重法和流式细胞术进行测定。干重法:吸取 2 mL藻液置于已准确称重的 2 mL离心管中,离心后将所得藻泥用超纯水反复清洗离心2次,将最终得到的藻泥放入60 ℃恒温烘箱中烘干至恒重。用分析天平称量并计算得到烘干藻粉的重量。生物量产率 (单位:g/(L·d)) 的计算根据公式:

其中DW1、DW2分别代表t1和t2时间点的干重浓度。
流式细胞术:将藻液样品适当稀释,采用CytoFLEXS流式细胞仪检测细胞密度,流速为10 μL/min,阈值设置为SYTO通道1 000 CFU/mL读取30 s,根据得到稀释后的细胞密度[11]。
比生长速率(单位:d–1)的计算根据公式:
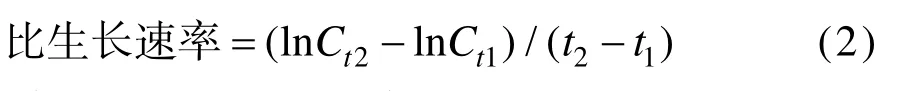
其中Ct1、Ct2分别代表t1和t2时间点的细胞密度。
1.4.2 葡萄糖浓度测定
葡萄糖浓度采用 SBA-40D生物传感分析仪进行测定,矫正范围为0.5–1.0 g/L。测定前,取待测样品的上清液,采用针筒过滤器(0.45 μm滤膜)先进行过滤,然后将其稀释至葡萄糖测定浓度的矫正范围内。用1.0 g/L的葡萄糖标准液进行定标,待定标通过后,用微量注射器吸取25 μL稀释好的上清液进行测定,每个样品重复测定3次后取平均值,测定读数乘以稀释倍数,即为待测样品的葡萄糖浓度。
1.4.3 硝酸根离子浓度测定
使用意大利HANNA HI83200多参数水质分析仪测定硝酸根的浓度。硝酸根平均同化速率(单位:g/(L·d))的计算根据公式:

其中Nt1、Nt2分别代表t1和t2时间点的硝酸根浓度。
1.4.4 蛋白质含量测定
采用 FOSS公司的半自动凯氏定氮仪测定蛋白质含量。
1.4.5 色素含量测定
称取冻干后的藻粉10 mg于2 mL的冻存管中并加入适量的陶瓷珠,然后加入90%丙酮溶液1 mL,液氮反复冻融后利用振荡器多次振荡提取到藻粉呈现白色后,吸取上清液并合并定容到10 mL,6 000 r/min离心10 min,再次吸取上清液定容到10 mL,最后将定容后的样品稀释到一定浓度,利用紫外分光光度计测定波长分别为 470 nm、646 nm和663 nm下的吸光度,采用以下公式计算得到叶绿素 a、叶绿素 b和叶黄素浓度(单位为 μg/mL)[10]。

其中Ca、Cb和Ct分别表示叶绿素a、叶绿素b和叶黄素浓度。
1.5 数据分析
采用Microsoft Origin V8.5 Software和SPSS Statistics对数据进行方差分析和显著性检验。
2 结果与分析
2.1 摇瓶培养中培养模式对硝酸根同化速率、藻蛋白与色素合成的影响
本实验在 250 mL摇瓶中进行小球藻的混养培养,考察了培养模式对小球藻细胞吸收同化硝酸根的影响。其中,在补料分批培养模式下设计培养基回流,是因为此时培养基中还有较高的硝酸根离子残留,暂未满足工业污染物中NO3–直接排放不超过15 mg/L或间接排放不超过40 mg/L的要求和WHO 2017年安全饮用水中NO3-N质量浓度最大允许值 (11.3 mg/L) 的标准 (即最大NO3质量浓度为50 mg/L)[12-13]。本研究中,培养基回流就是利用微藻继续对培养基中的硝酸根离子进行同化固定,直到培养基中的硝酸根离子全部消耗完后才会直接排放。实验结果如图1所示。所采用的 4种培养模式分别为分批培养、25%回流补料分批、50%回流补料分批和补料分批培养。
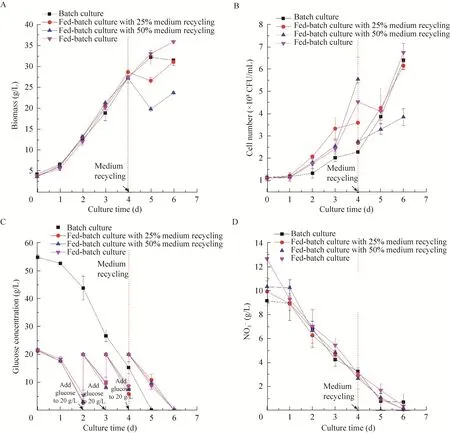
图1 不同培养模式下蛋白核小球藻细胞生长 (A)、细胞密度 (B) 及培养基葡萄糖 (C) 和硝酸根 (D) 浓度变化Fig. 1 Biomass (A) and cell density (B) of C. pyrenoidosa grown under different cultivation modes with changes of glucose and NO3– concentration (C–D).
如图1A和1B所示,在接种初期,微藻的生长存在短暂的延滞期,此时培养基尚未流加或更新,小球藻细胞的干重浓度和细胞密度均随着培养时间的延长而呈现不断增加的趋势;同时,在不同培养模式下,微藻培养基中硝酸根含量均呈下降的趋势 (图1C)。值得注意的是,从培养的第4天开始,即进行培养基回流后,在25%回流补料分批和50%回流补料分批的培养条件下,小球藻的生物量干重都呈现先下降后上升的趋势。同时,通过计算可知,小球藻在补料分批条件下,细胞的比生长速率为0.13 d–1,而在25%回流补料分批和50%回流补料分批条件下的比生长速率分别为 0.27 d–1和 0.11 d–1。50%回流补料分批的比生长速率较补料分批培养条件下略低,可能是因为小球藻无法在短时间内通过快速繁殖以弥补因收获过多的藻细胞而造成的细胞生物量干重降低(图1A)。另外,由图1C可知,在培养第4天,即未进行培养基回流前,25%回流补料分批和50%回流补料分批实验组中其残余的硝酸根含量分别为2.91 g/L和2.68 g/L;从开始回流到实验结束,25%回流补料分批、50%回流补料分批和补料分批培养,其后期的硝酸根平均同化速率分别为0.93 g/L、0.87 g/L和0.91 g/L。由此可见小球藻在25%回流补料分批条件下其同化硝酸根的能力比补料分批培养略高。这一结果与Liu等通过连续预收获螺旋藻优化光分布并控制生物量浓度以提高微藻对于氮素利用率的实验结果相一致,说明适宜的收获率能提高微藻对培养基中氮素的去除效果[14]。培养基离心收集藻细胞并回流培养基的过程中,一方面降低了培养体系中的藻细胞密度,增强单个细胞吸收利用光的有效面积,重新优化了光照分配,有利于微藻细胞生长和对硝酸根的吸收同化;另一方面回流的培养基中残留硝酸根继续作为氮源供微藻细胞生长,减少了直接排放造成的环境污染[14-15]。
从整个培养过程来看,在补料分批培养模式下,培养第0–1天,藻细胞密度增长最缓慢,培养基中的葡萄糖消耗速率也较低 (图 1A)。第1天后,藻细胞增长迅速,葡萄糖和硝酸根消耗与细胞生长相一致,都呈现较高的速率。同时可以观察到,分批培养下细胞在培养初期增长较慢,出现较长的延滞期,推测可能是高浓度的葡萄糖抑制了小球藻细胞的生长增殖[16]。当培养至第6天时,培养基中硝酸根全部消耗完毕,细胞干重和细胞数达到最大值,分别为 35.95 g/L和6.78×108CFU/mL。补料分批培养模式下,藻细胞的最大生物量与本实验其他培养方式相比增加较多,存在显著性差异 (P<0.01)。这说明补料分批培养是最适宜小球藻细胞生长的培养模式。
不同培养模式下小球藻细胞生长和培养基营养物质的消耗情况如表1所示。由表1可知,不同培养模式显著影响小球藻细胞生物量及营养物质的消耗 (P<0.05)。25%回流补料分批和 50%回流补料分批均可以获得较高的葡萄糖消耗量和硝酸根同化速率,但是并未完全转化为小球藻生物量;同分批培养相比,其最大生物量还要略低。而在补料分批培养模式下,藻细胞最大生物量干重和生物量产率,均显著高于本实验中的其他3种培养模式 (P<0.01);与此同时,小球藻在补料分批培养模式下的硝酸根平均同化速率也表现出极优的效果,达到2.06 g/(L·d) (P<0.01)。这可能是由于补料分批培养模式下,小球藻细胞一直处于碳充足的状态,营养物质比较丰富,更加适宜藻细胞生长,同时保证了较高的细胞密度,促进了培养过程中小球藻同化硝酸根的速率。以上研究结果表明,补料分批培养可以显著提高细胞密度和最终的生物量浓度[17],是最适宜小球藻高密度发酵培养并同时高效同化吸收硝态氮的培养模式。
不同培养模式下小球藻胞内类胡萝卜素、总叶绿素和蛋白质含量的影响情况如图2所示。四种不同的培养模式对于小球藻胞内蛋白质含量的影响程度,从高到低排序为:分批培养>50%回流补料分批>补料分批培养>25%回流补料分批。其中分批培养模式下蛋白质的最终含量可以占干重的45.04%,略高于本实验中的其他3种培养模式;在色素积累方面,分批培养模式获得最大的色素积累量,其总类胡萝卜素和总叶绿素含量分别为干重的 0.52%和 4.02%,相对于其他 3种培养模式具有显著差异 (P<0.01)。由以上结果可知,分批培养模式更有利于小球藻胞内色素和蛋白质的合成和积累。这可能是因为在分批培养过程中的C/N比随培养时间不断下降,而较低的C/N比更能促进微藻中含氮化合物如叶绿素和蛋白质的合成积累[18]。

表1 不同培养模式下蛋白核小球藻细胞生物量产率和营养物质消耗Table 1 Biomass productivity and nutrient consumption of C. pyrenoidosa cells under different cultivation modes

图2 不同培养模式下蛋白核小球藻细胞内色素和蛋白质含量Fig. 2 Pigments and protein contents in C. pyrenoidosa cells under different cultivation modes. The light intensity was constant at 210 μmol/(m2·s).
2.2 不同光照模式下硝酸根同化速率和细胞生长
本实验重点考察了不同光照模式对于摇瓶培养小球藻过程中的硝酸根同化速率和藻细胞生长的影响,结果如图3所示。培养过程中,小球藻在两种不同的光照模式下对于葡萄糖的同化速率都较快,并在培养的第2、3天时培养基中的葡萄糖基本都消耗完毕。此时,分别添加20 g/L葡萄糖,再培养到第5天时,硝酸盐基本消耗完毕。培养过程中共消耗葡萄糖60 g/L。与此同时,蛋白核小球藻在两种不同的光照模式下均生长良好,细胞的生长呈现相同的变化趋势,即在阶梯式光强和恒定光强下培养5 d后,细胞干重最大值分别达到了 28.90、28.85 g/L,细胞密度分别达到7.22×108、7.58×108CFU/mL。此外,在不同光照模式下,小球藻对于培养基中的葡萄糖和硝酸根同化量,也呈现相同的变化趋势。

图3 恒定和阶梯式光强下细胞生长 (A) 及培养基营养物质消耗 (B)Fig. 3 Cell growth (A) and nutrient consumption in medium (B) under constant and staged illumination modes. B1: 150 μmol/(m2·s); B2: 180 μmol/(m2·s); B3:210 μmol/(m2·s). After that, the light intensity was constant at 210 μmol/(m2·s).
不同光照模式对不同培养时间段小球藻硝酸根的平均同化速率和藻细胞比生长速率的影响如表2所示。由表2可知,在恒定和阶梯式光强下,蛋白核小球藻在培养初期均迅速繁殖。在恒定光强下,小球藻的比生长速率和硝酸根平均同化速率在第2天达到最大值,分别为0.39 d–1和4.46 g/(L·d)。在阶梯式光强培养模式下,当第一次开始补加葡萄糖时,即培养第 2–3天时,将光照强度从120 μmol/(m2·s)提高到 150 μmol/(m2·s),其硝酸根平均同化速率出现了明显的增加,并显著高于同时期下的恒定光强培养模式下的增加量 (P<0.01)。当第2次补加葡萄糖时,同时将光照强度提高到180 μmol/(m2·s),即培养第 3–4 天时,小球藻的比生长速率达到最大值为0.65 d–1,显著高于恒定光强下的最高比生长速率 (P<0.01),且硝酸根平均同化速率显著高于同时期下的恒定光强培养模式 (P<0.01)。当培养第4–5天时,阶梯式光强和恒定光强之间的差距逐渐缩小,比生长速率之间无显著性差异。
最后,综合比较不同光照模式对于小球藻的硝酸根平均同化速率和平均比生长速率可知,恒定光强模式下的硝酸根平均同化速率略高于阶梯式光强,但两者之间的细胞平均比生长速率之间无显著性差异。有研究表明,光是微藻进行光合作用的主要能量来源,光通过提供能量将电子从水转移到NADP+,形成NADPH (烟酰胺腺嘌呤二核苷酸磷酸) 和产生 ATP (腺苷三磷酸),为细胞的生命代谢提供需要的原材料。有研究证实,在黑暗条件下微藻无法进行光合作用,死亡速率高于生长速率,藻类停止生长;随着光照强度增强,光合速率逐渐提高,小球藻的生长速率随光强的增加而不断提高;当光照强度超过光饱和值,小球藻的生长速率随光照强度的增加而下降,这可能是因为过高的光照强度抑制了光合系统Ⅱ的活性,同时使与光合作用相关的色素和酶受到光氧化伤害而使光合作用速率下降[19-20]。由此可见,光对于微藻细胞的生长具有重要影响。同时,光照强度对于微藻同化硝酸根的能力也具有重要影响。有研究表明,光照强度的增加会提高微藻同化硝酸根的速率,这可能是因为小球藻在外界吸收的氮主要通过转化为含氮化合物的形式在体内储存,并且细胞内含氮化合物的含量与光合速率呈正相关的关系[21]。同时,有研究也发现,在光照条件下,蓝藻等微藻可以通过 Calvin-Benson循环为细胞氮吸收和同化途径的代谢过程提供光合作用产生的ATP、细胞还原力NADPH和铁氧还蛋白 (Fd),从而显著提高蓝藻对于硝态氮的同化能力[22-23]。另外,也有研究指出,在非营养条件的限制下,光照强度的增加可以提高细胞内的光合作用,促进藻细胞分裂增殖的能力,从而提高了培养基中硝酸根的同化[24]。这与本研究中发现的培养第2–3天时提高光强促进小球藻细胞生长和硝酸根同化速率的结果基本一致。同时,本研究还发现因光照强度导致细胞生长和硝酸根平均同化速率的差异在后期逐渐缩小,推测可能是因为细胞密度的增加,增强了细胞之间的掩蔽作用,降低了分配到每一个细胞的光照强度,从而减弱了光照强度对细胞生长的影响[10]。

表2 恒定和阶梯式光照模式下蛋白核小球藻的硝酸根平均同化速率和比生长速率Table 2 The average NO3– consumption rate and specific growth rate of C. pyrenoidosa under constant and staged illumination conditions
两种不同光照模式对于蛋白核小球藻细胞内色素和蛋白质含量的影响情况如图4所示。在恒定光强下,其蛋白质含量占干重的44.01%,比阶梯式光强下培养增加了 3.66%。但是,在阶梯式光强下,小球藻胞内总类胡萝卜素和总叶绿素占干重的百分比含量分别为 0.73%和 3.83%,显著高于恒定光强 (P<0.01)。推测这可能是因为恒定高光强下,光强过高对于藻细胞的叶绿体具有损伤作用,不利于叶绿素的合成,同时其中过量的光能以热能的形式被消耗,并不能被叶绿体的光合作用吸收而用于细胞生长;而在从低光强到高光强逐渐过渡的过程中,光强的逐步增强,一定程度上会减少过高光强对于细胞的损伤,同时提高叶绿体中光合作用的电子传递速率,从而最终促进了细胞内叶绿素的积累[25]。

图4 恒定和阶梯式光照模式下蛋白核小球藻细胞内色素和蛋白质含量Fig. 4 Contents of pigments and proteins in C. pyrenoidosa cells under constant and staged illumination conditions.
2.3 补料分批培养
图5展示了蛋白核小球藻在5 L光发酵罐中进行混养补料分批培养128 h的过程中,葡萄糖和硝酸根的消耗以及藻细胞的生长情况。在整个培养过程中,硝酸作为补充氮源,并用来维持发酵过程中的pH值。由图5可知,在培养0–24 h时,小球藻的生长出现短暂的延滞,同时培养基中的葡萄糖几乎没有出现消耗,小球藻同化硝酸根的速率十分缓慢。培养24 h后,葡萄糖消耗迅速,期间不断流加葡萄糖母液,维持培养基中葡萄糖浓度在25–30 g/L,此时蛋白核小球藻的干重含量随着葡萄糖消耗量的增加而不断增加,并在112 h达到最大值 (66.22 g/L);小球藻的快速生长与高效的硝酸根同化速率是一致的。小球藻对硝酸根的最大同化速率出现在64 h,在该时间段最大值可达到35.10 g/(L·d);之后,在72–88 h时,小球藻的硝酸根同化速率逐渐降低,培养基中的硝酸根在88 h之后未出现明显消耗,但88 h时小球藻的生物量产率达到最大值为 24.35 g/(L·d)。推测其原因可能是培养基中逐步增高的氮磷比,降低了细胞吸收利用氮的能力[26];同时可以发现在培养至 112 h后,细胞干重基本保持稳定。在0 h到128 h的整个发酵过程中,蛋白核小球藻的硝酸根平均同化速率为4.38 g/(L·d),达到较高的吸收同化速率。目前研究报道的微藻细胞对于硝酸根的同化速率为2.08 g/(L·d)[27],而本研究结果显著高于该值,这说明采用蛋白核小球藻来吸收同化硝酸根具有重要的生产优势和应用前景。

图5 光发酵罐补料分批培养过程中葡萄糖和硝酸根浓度以及细胞生物量的浓度变化Fig. 5 Changes in glucose and NO3– concentration with biomass yield in the fed-batch cultivation in 5 L photo fermenter of C. pyrenoidosa.
蛋白核小球藻在5 L光发酵罐中进行补料分批培养过程中的色素和蛋白质的变化情况如图 6所示。由图6可知,蛋白质含量随培养时间的增加,大约呈现先增加后下降的趋势。总叶绿素和总类胡萝卜素的含量随培养时间表现出与蛋白质含量相同的趋势,并且在培养至72 h时,达到最大值,分别占干重的 3.07%和 0.57%。同本研究中摇瓶培养的结果对比可知,发酵罐培养小球藻,其胞内的总叶绿素和总类胡萝卜素的含量略有下降。同文献对比可知,其色素含量差别较小[28]。此外,蛋白质含量在小球藻细胞内最高可以达到干重的 47.13%,是藻细胞内最主要的含氮化合物。但是通过文献对比可知,整个培养过程中,藻细胞内的蛋白质含量低于之前文献报道过的蛋白核小球藻中蛋白质的含量 (可高达50%以上)[26]。有研究报道指出培养过程中高的C/N比会刺激细胞内糖类和脂肪等含碳化合物的合成,不利于蛋白质和色素等含氮化合物的积累[29]。由此可见,发酵过程中的C/N比及其变化情况,对于蛋白核小球藻高效同化硝酸根具有重要的影响,后续实验中需要对碳氮比进一步优化,以提高小球藻对于培养液中硝酸根同化速率以及藻细胞生物量的转化效率。

图6 光发酵罐补料分批培养过程中色素和蛋白质含量的变化Fig. 6 Changes in pigments and protein contents in the fed-batch cultivation in 5 L photo fermenter.
利用微藻处理工业废硝酸或硝酸盐废水,其实用性主要取决于能否根据工业生产中废水的连续化及量大的特点提出合理而又有效的解决办法。针对工业废硝酸或硝酸盐废水连续化排放的特点,本研究采用分批培养取得了良好的效果。如果能实现多批次培养,有利于实现富含硝酸根废水的连续化处理。因此,采用这种混养小球藻多批次处理硝酸根废水具有良好的应用前景。目前研究表明,微藻在处理城市污水、畜禽粪便和工业废水等不同类型的废水处理方面有巨大潜力。微藻对培养环境中氮、磷的去除与细胞生物量的积累密切相关,并受生长条件和培养体系的影响[30]。实际生产中利用微藻处理工业废水的主要方式有以下几种:一是通过未搅拌的开放系统,圆形池塘和跑道池等开放系统。这些系统建造及配套设施简单、价格相对低廉,但占地面积大、培养环境差、可替代藻种较少,同时易受天气影响、培养过程中易受细菌等其他外来物的污染,因此处理废水的能力十分有限[30]。二是通过现在研究比较热门的光发酵系统进行培养。这是一种更可持续、更经济的方法,可以帮助微藻保持最佳的纯培养条件,不受外界环境的干扰[31]。本研究主要通过光发酵系统,可以抵抗外界的多种干扰,通过补料分批培养和培养基回流等培养策略,实现微藻连续化生产,能较好地适应工业废水排放的连续化特点。而对于硝酸根废水量大的特点,本实验结果将为后续的大规模批量工业化培养提供一定的基础数据。有研究表明,利用光发酵系统混养培养小球藻处理工业烟道气转化的硝酸盐废水,通过5 L到50 L生物反应器的比例放大,实现了小球藻对于氮的平均同化速率为0.45 g/(L·d),并获得了 1.83 g/(L·d) 的高脂产率[27]。本研究中小球藻能够高效同化硝态氮,其同化速率显著高于之前的研究,同时能够获得较高的蛋白含量。现有成果可以作为后期工业化培养的优化条件,从而最终实现硝态氮废水的大批量处理。
3 结论
本文主要研究了在混养条件下,不同培养模式、光照模式以及光发酵罐小试培养对蛋白核小球藻生长和硝酸根同化速率以及含氮化合物积累的影响。结果表明,在补料分批培养的模式下,蛋白核小球藻的最终生物量最大,可达到35.95 g/L。阶梯式增加光强,可以提高蛋白核小球藻的最高比生长速率至0.65 d–1。在光发酵培养条件下,补料分批以及阶梯式光强的调节模式有助于提高蛋白核小球藻的硝酸根平均同化速率,可达到4.38 g/(L·d),生物量最高可达到66.22 g/L。后续研究中需进一步优化光发酵罐补料分批培养过程中的C/N比等参数,并对优化参数进行光发酵验证。这将有助于利用微藻光发酵技术高效处理工业废硝酸或硝酸盐废水,实现硝态氮废水的连续化和规模化处理,将废水中硝态氮转化为高蛋白微藻生物质资源,变废为宝。

