小麦新品系鄂麦28及其系选后代的农艺性状及产量特点
王文学,王逸虹,刘易科,张宇庆,佟汉文,陈 泠,何伟杰,邹 娟,朱展望,高春保,
(1. 湖北省农业科学院粮食作物研究所/粮食作物种质创新与遗传改良湖北省重点实验室/农业部华中地区小麦病害生物学科学观测实验站/湖北省小麦工程技术研究中心,湖北武汉430064;2.长江大学/主要粮食作物产业化湖北省协同创新中心,湖北荆州 434025)
系统选择是对已经基本稳定的品种(系)进行选择,并对选育后代进行鉴定试验而选育新品种的育种方法[1]。我国近代育种历史中,采用系统选择方法育出了大批作物品种,并在生产上应用。江苏里下河地区农科所通过系统选择先后育成了扬麦1号、扬麦2号、扬麦3号、扬麦4号等小麦品种。在水稻中,通过系统选择先后育成了扬稻1号、扬稻2号等品种。随着育种水平的提高,杂交育种被广泛利用,系统选择在现代育种中的地位不断下降,但系统选择可保留原有品种优点,利用品种剩余变异克服原品种某些缺点,并可进一步提高品种的一致性与稳定性。因此,此育种方法仍被作为一种辅助手段在育种中应用。如江苏省农业科学院对宁麦9号进行系统选择,育成的宁麦13、宁麦14等品种克服了宁麦9号抗倒性差、千粒重较低的缺点,取代了宁麦9号,在生产上大面积应用[2-3]。
植物新品种必须要满足特异性、一致性和稳定性(distinctness, uniformity and stability, DUS)才能取得品种权[4]。DNA分子标记技术可用来直接检测品种间DNA水平上的差异,不受环境影响和季节限制,检测周期短、准确率高,已经被应用于多种领域。因SSR(simple sequence repeats)分子标记具有稳定性好、多态性高、共显性分离、位点专化性、标记覆盖整个基因组且分布均匀等优点,国内外科学家对其应用较为广泛,并取得了一定成果[5-11]。韩凤龙等[12]筛选出了6对骨干引物,它们具有较好的品种鉴别力和稳定性,可用于河南省小麦品种特异性和一致性鉴定。滕海涛等[13]认为,要保证对不同品种进行区分,需要建立核心引物。王立新等[14]根据小麦DUS测试的需求,筛选出105对引物,并将其分为21对核心引物、29对一级备用引物和55对二级备用引物。其中21对核心引物分辨力较高,可以完成约80%品系的特异性检测,约95%品系的种子纯度检测和约60%品系的一致性、稳定性检测。分子标记的应用极大地方便了品种DUS测试,可在基因型水平上反映品种间遗传相似性[15],结合田间性状鉴定,可有效鉴定品种特异性。
鄂麦28是用扬麦15/华2566杂交组合通过系谱法和改良集团育种法选育而成的小麦新品系,2016-2018年参加湖北省小麦区域试验,平均产量5 306.70 kg·hm-2,比对照郑麦9023增产4.97%。该品系具有中抗赤霉病、抗穗发芽、高产稳产等突出特点,推广应用价值较大。为进一步改良鄂麦28,对其群体进行了大规模的系统选择。本研究对鄂麦28系统选择的30个品系进行田间鉴定试验和小麦21对核心SSR标记检测,以有效利用其剩余变异,促进其生产利用。
1 材料与方法
1.1 材 料
供试材料为鄂麦28及其系统选择的18S268、18S270等30个品系。2016-2017年度选择鄂麦28单穗800个。2017-2018年度在襄阳原种场种植穗行,田间选择穗行65个,经产量比较和室内考种,保留30个品系进行产量试验和分子标记检测。

图1 鄂麦28与亲本扬麦15和华2566典型单株
1.2 方法
1.2.1 田间鉴定试验
2018-2019年在襄阳市原种场(襄阳市襄州区古驿镇,北纬32°17′6.3762″)和湖北省农业科学院粮食作物研究所南湖农场(武汉市洪山区,北纬30°29′3″)种植郑麦9023(对照)及鄂麦28系选的30个品系。襄阳市原种场属鄂北岗地麦区,冬季阴冷潮湿,夏季高温干旱,春秋常年较干旱,土壤黄棕壤,肥力中上等。南湖农场属江汉平原麦区,小麦生育期降雨偏多,抽穗扬花期光照相对不足,赤霉病流行较重,秋季雨量偏少。
试验采用完全随机设计,武汉和襄阳的小区面积分别为6和6.67 m2。武汉试验调查记录各小区抽穗期、开花期和成熟期;抽穗完全后测量株高,调查单位面积有效穗数,收获时取样调查穗粒数,并测量千粒重及小区产量。襄阳试验小麦收获后计产。
1.2.2 分子标记检测
待收获后取少量鄂麦28和30个品系的种子,在发芽盒中发芽,取少量新鲜嫩叶,采用CTAB法[16]提取其基因组DNA,用21对核心SSR引物(表3,含Genomic-SSR引物18对和EST-SSR 引物3对,均为单位点引物,分别位于21条染色体,引物类型退火温度等详见参考文献[14])进行检测,根据21对引物比对结果计算品系间的遗传相似系数(GS)。GS≤0.90时品系之间具有特异性,GS在0.91~0.95之间时品系比较相似,GS大于0.95时品系为高度相似[17-18]。1.2.3 PCR反应体系及扩增结果分析
PCR反应体系为康为世纪的2×Es Taq MasterMix (Dye)反应体系15 μL:7.5 μL 2×PCR 反应缓冲液,10 μmol·L-1的引物 1 μL,模板DNA 2 μL。PCR反应条件:94 ℃预变性5 min,94 ℃变性30 s,50~68 ℃(根据引物不同,见表1)退火1 min,72 ℃延伸30 s,扩增30个循环;72 ℃延伸5 min,4 ℃保存。PCR产物用6%非变性聚丙烯酰胺凝胶200 V电泳1.2 h,采用硝酸银染色法显色后进行人工读带。扩增产物的带型与鄂麦28相同记为“1”,不同的依次记为“2”、“3”、“4”,以此方法标记带型编号。
1.2.4 遗传相似系数(GS)的计算方法
GSij=2Nij/(Ni+Nj)。式中Nij为第i和第j两品系相同带型的DNA位点总数,Ni和Nj为鄂麦28和参试品系相对比的DNA位点总数。
2 结果与分析
2.1 田间鉴定结果
2.1.1 产量及及其构成表现
由表1可知,30个品系产量变化范围为 4 788.33~6 541.00 kg·hm-2,穗粒数变化范围为36.00~48.53,千粒重变化范围为32.93~ 46.67 g,每公顷穗数变化范围为313.33万~451.67万。产量的变异系数为7.73%,产量构成因素与产量的相关性均未达到显著。穗数变异系数为9.37%,穗粒数和千粒重变异系数均较小。
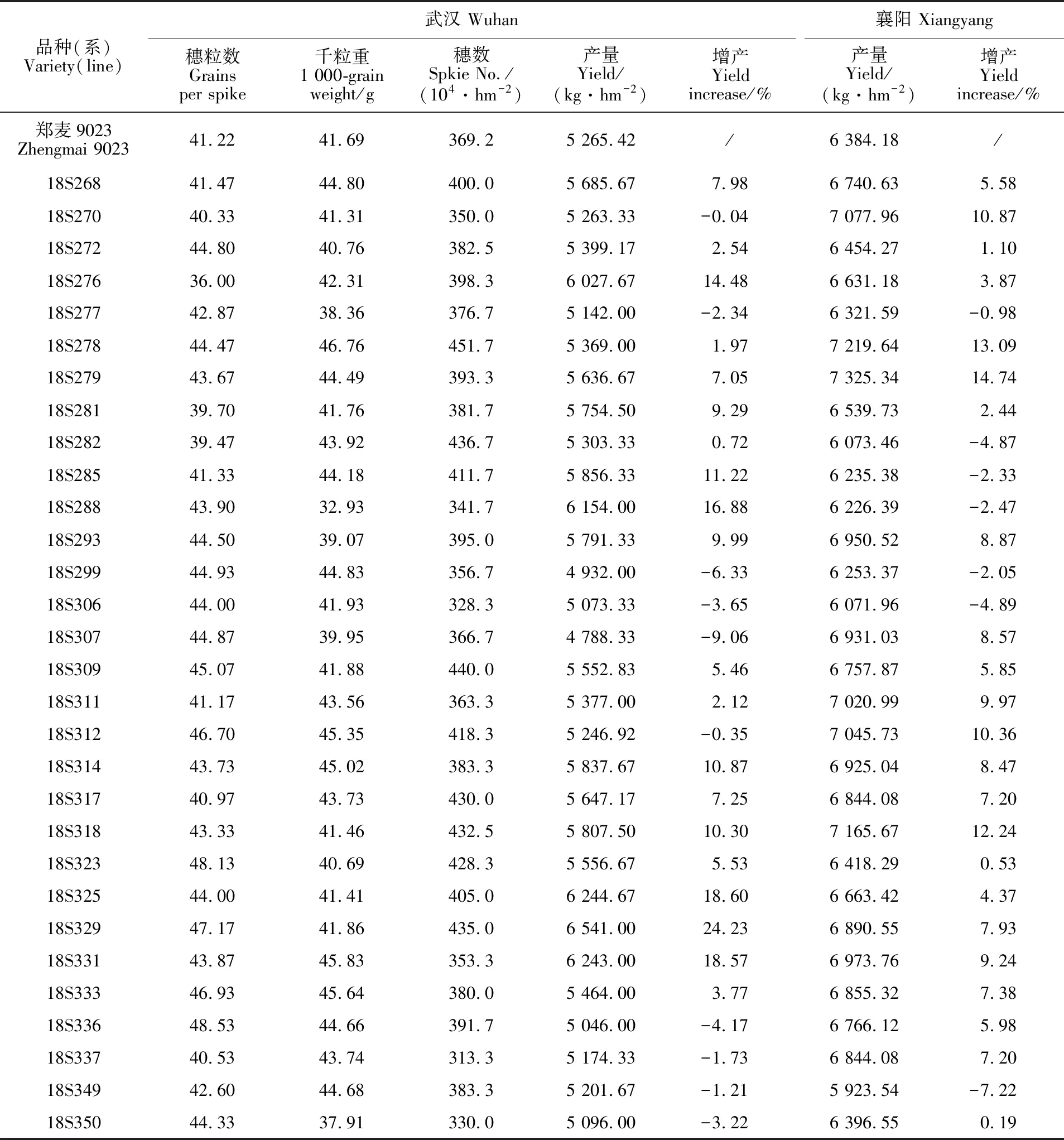
表1 不同小麦品种(系)在武汉和襄阳的产量调查结果Table 1 Yield of different wheat materials in Wuhan and Xiangyang
与郑麦9023相比,武汉试验中18S329等20个品系表现增产,襄阳试验中18S279等23个品系增产。其中,18S268、18S272、18S281、18S309、18S311、18S314、18S317、18S318、18S323、18S325、18S276、18S278、18S279、18S293、18S329、18S331、18S333等17个品系在两地均增产,两地增产幅度均超过5%的品系有18S268、18S309、18S314、18S317、18S318、18S279、18S293、18S329、18S331等9个品系。18S325和18S276在武汉增产显著,但在襄阳增产不明显。18S278在襄阳增产显著,而在武汉增产不明显。18S318增产幅度在两地均超过10%,丰产性和稳产性均较好。18S329的产量在武汉鉴定试验中居第一位,增产24.23%,其穗粒数和穗数均最高,千粒重中等;在襄阳试验中增产7.93%,产量表现优异。18S279的产量在襄阳鉴定试验中居第一位,增产14.74%;在武汉鉴定试验中增产 7.05%,产量表现优异,千粒重较高,穗粒数和穗数中等。
2.1.2 其他性状表现
30个品系株高变化范围为83.67~93.33 cm,变异系数为2.65%,品系之间差异不大(表2)。18S349、18S323、18S337、18S282、18S279、18S272、18S333、18S278、18S336等9个品系株高高于对照品种,其余21个品系矮于对照品种。30个品系中,18S299生育期比对照品种早2 d,18S278抽穗开花较早,其余品系生育期与对照品种一致或晚1~4 d。
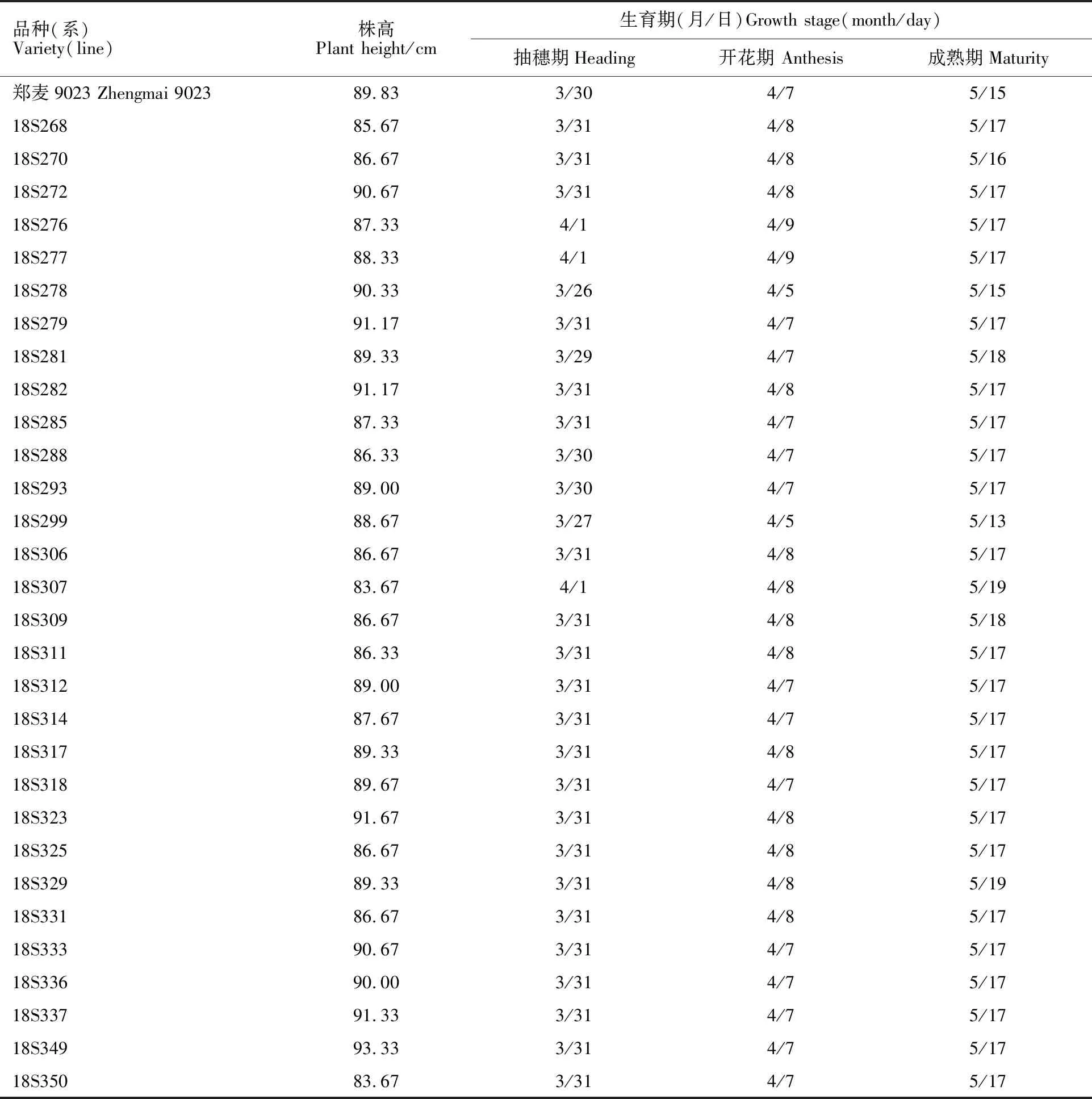
表2 武汉试点小麦不同品种(系)株高和生育期Table 2 Plant height and growth stages of different wheat materials in Wuhan
2.2 鄂麦28选系的相似性
根据王立新等[14]的方法,在19~21个核心SSR标记相同的品系中,均有GS大于0.95的可能性,需利用备用引物进行更多位点比对,以确定GS大于0.95的品系,即3个及以上核心标记不同的品系可以确定其特异性。鄂麦28及其30个后代家系经21对核心SSR引物扩增,再经6%非变性聚丙烯酰胺凝胶电泳,结果(图2、表3)表明,18S270、18S281、18S306、18S309、18S311、18S314、18S323、18S325、18S276、18S329、18S331、18S337等12个品系标记结果与鄂麦28完全一致,GS 为 1,不具有特异性。其中18S325、18S314、18S329、18S331等4个品系产量性状优异,可作为鄂麦28优系进行繁殖推广。18S268、18S272、18S288、18S307、18S317、18S318、18S277、18S293、18S333、18S350等10个品系有一个变异位点,18S282和18S285有两个变异位点。这12个品系遗传相似系数较高,特异性需进一步检测。18S268、18S293、18S317、18S318四个品系产量性状优良,在田间也表现出一定的差异,可作为新品系进一步利用。18S279、18S349、18S278、18S336、18S299分别有3、4、5、6、7个位点变异,18S312变异位点最多,为12个。这6个品系遗传相似系数小于0.90,可以确定其特异性。其中18S279产量表现优异,两地均增产;18S278在襄阳增产显著,在武汉增产不明显,抽穗开花较早,成熟期与对照一致;其余4个品 系不同程度减产。这两个品系可作为新品系利用。
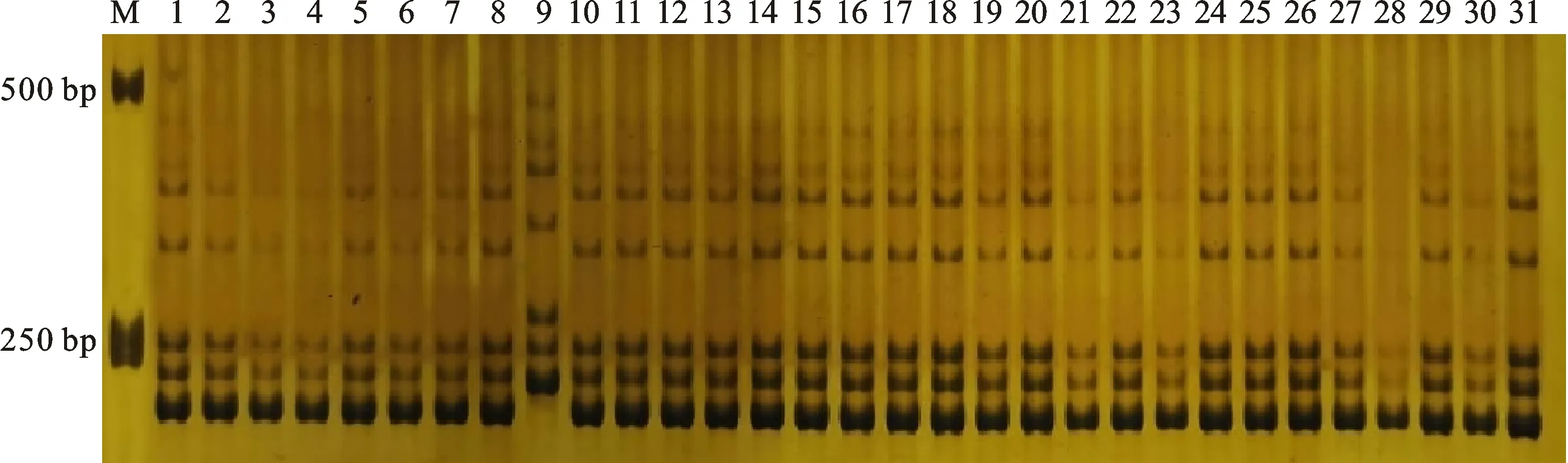
M:DNA marker; 1泳道:鄂麦28典型单株;2~31泳道:鄂麦28的30个选系。
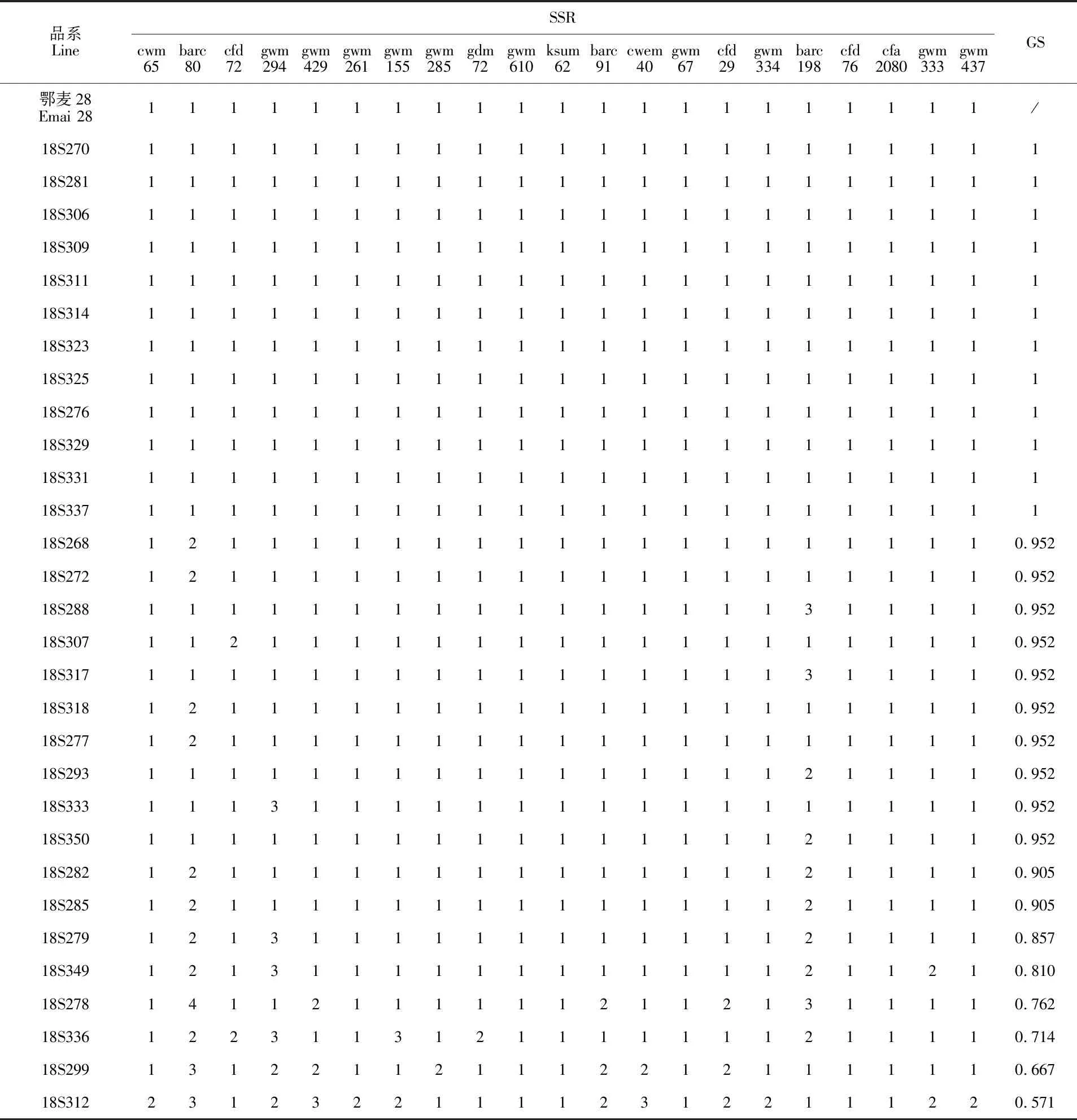
表3 鄂麦28及其30个选系21对SSR核心引物检测结果Table 3 Genotypes of Emai 28 and its 30 re-selected lines at 21 wheat core SSR loci
3 讨 论
杂交育种是目前小麦育种的主要方法,系统选择在育种中应用相对较少。但本研究发现,新育成品系仍存在较多的剩余变异,比如18S312品系,经检测与鄂麦28在21个位点中有12个位点变异。系统选择方法虽然在新品种选育中效率较低,但可将其应用在新品系剩余变异的挖掘利用中。在品种育成后对苗头品种进行较大规模的穗选或单株选择,尤其是对于综合性状好、优点突出、应用前景较大的新品种,对其进行系统选择,有望改良某些缺点,并提升品种的一致性和稳定性,对该品种的推广应用大具有较大价值。
系统选择结合杂交育种是一个快速有效的育种手段。如对杂交育种育成的小麦品种宁麦9号进行系统选择,育成了宁麦13、宁麦14等品种。这些品种,特别是宁麦13,克服了宁麦9号抗倒性差、千粒重较低的缺点,取代了宁麦9号,得到大面积种植[2-3]。程顺和等[19]指出,在品种育成初期,由于剩余分离和天然杂交等原因,其原始群体内个体或株系间许多重要经济性状均存在遗传差异。从原始群体中进行再选择,可以使许多经济性状上的缺陷得到改良或使原本优良的性状得到加强。扬麦5号优系在产量、抗病性等方面均比扬麦5号有明显提高。扬麦158的优系的产量性状显著好于原始群体,扬麦158育成初期成熟期有少量青穗、植株不整齐等缺点明显改善。系统选择对于这两个品种的推广利用起到了重要推动作用。杂交育种亲本选配原则之一是要求亲本综合性状好、优点多、缺点少,而系统育种能针对某个缺点进行改良,优中选优,连续选优,因此把系统选择用于亲本的选择,提高亲本的水平,有助于育成新品种和提高育成品种的水平。彭绍峰等[20]研究表明,同一小麦品系内不同株系作亲本对杂种优势表现有显著影响,对优良组合亲本进行分离筛选能进一步提高杂种优势水平。
分子标记的应用极大地方便了育种工作,利用分子标记对系统选择的后代的遗传相似性进行鉴定,可帮助我们从基因型的角度了解不同家系的遗传差异,其检测结果可有效区分各家系的特异性,具有特异性的家系还可作为新品种进行应用。对系统选择的后代,如果在某个性状如抗病性有明显差异,且遗传相似性较高,可以作为遗传材料进行该性状的研究。
目前,基于SSR分子标记的小麦DNA指纹鉴定主要有聚丙烯酰胺凝胶电泳检测和毛细管电泳荧光检测2种方法。Röder等[21]利用19个小麦SSR荧光标记,建立了欧洲主栽小麦品种DNA指纹数据库。郑永胜等[22]从2 438个定位到小麦染色体上的SSR标记中,筛选出了42个PCR扩增稳定、带型易读、在基因组中分布较均匀、适合对中国小麦育成品种进行鉴定的SSR标记,建立了基于SSR荧光标记的高通量小麦品种DNA指纹鉴定体系。王立新等[14]提出检测小麦特异性采用3种分子标记的105对引物,包含21对核心引物、84对备用引物。刘丽华等[23]利用21对核心SSR引物对2009-2014年参加国家冬小麦区域试验的430个品系进行了遗传多样性和群体结构分析,发现这21对SSR引物能够区分430个品系中的408个品系,引物区分能力为95%,表明21对核心引物的多态性非常高,具有较高的代表性。本研究利用21对核心引物对鄂麦28系统选育后代进行检测,研究结果有效反映了参试材料在基因组水平存在的差异,有助于准确分析各优系和原始品种之间存在的差异,对于进一步分析各优系的潜在利用价值有重要参考 意义。

